

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
1.Актуальность: Коллоидные системы широко распространены в природе. К дисперсным системам относятся кровь, слюна, лимфа, спинномозговая жидкость, костная ткань и др.; в коллоидном состоянии в организме находится ряд веществ: фосфаты, жиры, липиды. Некоторые лекарственные формы представляют собой коллоидные растворы. Диализ и электродиализ используют в стоматологической практике.
2.Учебные цели: знакомство с методами получения и некоторыми свойствами дисперсных систем.
Для формирования необходимых компетенций обучающийся должен
знать
-правила работы в химической лаборатории с реактивами и приборами
-классификацию дисперсных систем, способы их получения, особенности строения коллоидных частиц
Для формирования необходимых компетенций обучающийся должен
уметь
- производить расчеты и оценивать их результаты
-определять заряд гранулы по результатам расчетов
-написать условную формулу коллоидной частицы и определять ее составные частицы
Для формирования необходимых компетенций обучающийся должен
владеть
-самостоятельной работой с учебной и справочной литературой
-безопасной работы в химической лаборатории и обращаться с химической посудой и реактивами
3.Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки.
1.Классификация дисперсных систем по степени дисперсности, агрегатному состоянию фаз.
2.Строение коллоидных частиц.
3.Методы получения и очистки дисперсных систем.
4.Свойства дисперсных систем: броуновское движение, диффузия, осмос, оптические и электрические свойства.
5.Кинетическая и агрегативная устойчивость золей. Коагуляция (скрытая и явная, медленная и быстрая).
6.Порог коагуляции, коагулирующее действие. Правило Шульце-Гарди. Взаимная коагуляция.
7.Седиментационный анализ.
8.Коллоидные ПАВ. Критическая концентрация мицеллообразования (ККМ).
- 4. Вид занятия: лабораторное занятие.
5. Продолжительность занятия: 3 академических часа.
Оснащение рабочего места.
6.1. Дидактический материал: справочник физико-химических величин,
6.2. ТСО: калькуляторы.
| 6.3. Посуда и приборы. | |
| Штатив с пробирками, спиртовка, пипетки, бюретка, резиновая груша, фильтровальная бумага, диализатор, 3 конические колбы, мерная пробирка. | на группу |
| 6.4.Объекты исследования. | |
| Раствор серы или канифоли в спирте. Водные растворы: 2% FeCl3; 0,001М K4[Fe(CN)6], 2 % мыла; 0,5% крахмала; 0,1М НСl; эозина, метиленовой сини, гидрозоля Fe(OH)3. Растительное масло или углеводород. | на группу |
| 6.5.Реактивы: | |
| 5% раствор J2 в спирте; растворы: 6М NaCl; 0,01MNa2SO4; 0,001MK3[Fe(CN)6]; дистиллированная вода. | на группу |
7. Содержание занятия:
Типовой тест входного контроля.
1.Размер частиц в коллоидных растворах
1) менее 10-9 м 2)10-9-10-7 м 3) более 10-7м 4) 10-5-10-7м.
2. Дисперсная система, состоящая из жидкой дисперсной фазы и жидкой
дисперсионной среды
1) эмульсия 2) пена3) аэрозоль 4) суспензия.
3.Оптическое свойство коллоидных растворов
1) рассеивание 2) поглощение 3) отражение 4) прохождение света
4. Строение мицеллы слюны при рН=6,7
1){mCa3(P04)2 ∙nHPO42- (n-x)Ca2+}x-∙хСа2+;
2) {m Са3 (РО4)2∙nH2 P04-∙(n-x)/2∙Ca2+}x- ∙(х/2)Са2+;
3) {СаСО3 ∙nСа2+ ∙(2n-x)С1- }x +∙хС1-;
4){mCa3(P04)2 ∙nPO43-∙3/2(n-x)Ca2+}3x-∙3/2хСа2+;
5. Переход нерастворимых в воде органических веществ в водную фазу в
присутствии коллоидных ПАВ называется...
1)коагуляция; 2) адсорбция;
3) солюбилизация; 4) коллоидная защита.
7.2. Узловые вопросы, необходимые для усвоения темы занятия.
1.Классификация дисперсных систем по степени дисперсности, агрегатному состоянию фаз.
2. Строение коллоидных частиц.
3. Методы получения и очистки дисперсных систем.
4. Свойства дисперсных систем: броуновское движение, диффузия, осмос, оптические и электрические свойства.
5. Кинетическая и агрегативная устойчивость золей. Коагуляция (скрытая и явная, медленная и быстрая).
6. Порог коагуляции, коагулирующее действие. Правило Шульце-Гарди. Взаимная коагуляция.
7. Седиментационный анализ.
8. Коллоидные ПАВ. Критическая концентрация мицеллообразования (ККМ).
7.3. Самостоятельная работа обучающихся.
Лабораторная работа.
Получение и свойства дисперсных систем.
Опыт 1. Получение гидрозоля методом замены растворителя (физическая конденсация).
К 10 мл дистиллированной воды добавьте 0,5-1 мл 2% спиртового раствора канифоли (или серы), перемешайте. Получается голубовато-желтый гидрозоль. Направьте на раствор узкий пучок света фонарика, наблюдайте и зарисуйте эффект Тиндаля.
Опыт 2. Получение золя методом гидролиза соли (химическая конденсация).В пробирку налейте 5 мл дистиллированной воды и 0,5-1 мл 2% FeCl3, нагрейте до кипения. Получается красно-коричневый, прозрачный золь гидроксида железа, его мицелла: {Fe(OH)3∙nFeO+∙(n-x) Cl-}x+∙xCl-.
Опыт 3. Получение золя берлинской лазури (реакция обмена).
А) К 1-2 мл 0,001М раствора K4[Fe(CN)6] прибавляют 2-3 капли раствора FeCl3. Получается отрицательный синий золь, его мицелла:
{mKFe[Fe(CN)6] ∙ n [Fe(CN)6]4 -∙ (4n-x)K+}x- ∙ xK+.
Какой знак заряда у частиц?
Б) К 2-3 мл раствора FeCl3прибавьте 1-2 капли раствораK4[Fe(CN)6]. Получается зеленый золь, его мицелла:
{mKFe[Fe(CN)6] ∙ nFe3+∙ (3n-x)Cl-}x+ ∙ xCl-.
Какой знак заряда у частиц?
Опыт 4. Определение знака зарядов коллоидных частиц.
При погружении фильтровальной бумаги в воду, бумага приобретает отрицательный заряд. Если каплю коллоидного раствора нанести на фильтровальную бумагу, то при отрицательном заряде частиц происходит пропитывание краской бумаги. При положительном заряде коллоидных частиц происходит разложение раствора на две фазы: дисперсную фазу и дисперсную среду. На этом основано определение знака заряда окрашенных коллоидных частиц. Используйте растворы метиленовой сини и эозина.

Опыт 5. Получение эмульсий.
Налейте в пробирку 2-3 мл воды, 2-3 капли углеводорода или растительного масла, встряхните. Устойчивая ли эмульсия? Добавьте в эту же пробирку 1-2 мл раствора мыла, встряхните. Запишите наблюдения. Какова роль мыла в получении эмульсии? Каков тип эмульсии: масло в воде (м/в) или вода в масле (м/в)? Нарисуйте как молекулы мыла адсорбируются на каплях масла.
Опыт 6. Определение порога коагуляции электролитов.
В коническую колбу налейте 10 мл гидрозоля Fe(OH)3и титруйте до появления мути одним из электролитов:
1) 6М NaCl;
2) 0,01M K2SO4;
3) 0,001M K3[Fe(CN)6].
Запишите объем в мл электролита (Vэ), пошедшего на титрование. Рассчитайте порог коагуляции:
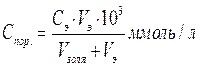
где Сэ– молярная концентрация коагулирующего электролита,
Vэ – объем (мл) электролита, вызывающего коагуляцию золя объемом Vзоля.
Для всех электролитов рассчитайте коагулирующее действие КД = 1/Спор ммоль/л.Результаты запишите в таблицу:
| Электролит | Сэ,М | Vэ,мл | Спор, ммоль/л | КД, л/ммоль |
| NaCl | ||||
| K2SO4 | ||||
| K3[Fe(CN)6]. |
Из полученных данных сделайте вывод о соответствии с правилом Шульце-Гарди: порог коагуляции обратно пропорционален заряду коагулирующего иона в шестой степени.

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!