1. Актуальность: кондуктометрия используется для определения концентрации растворенного вещества, степени и константы диссоциации, растворимости.
2. Учебные цели: научиться определять степень и константу диссоциации слабого электролита в водном растворе.
Для формирования необходимых компетенций обучающийся должен знать:
-понятия сила тока, напряжение, сопротивление, электропроводимость
-проводники I и II рода
-окислительно-востановительные реакции
Для формирования необходимых компетенций обучающийся должен уметь:
-пользоваться химическим оборудованием и реактивами
-производить расчеты по результатам эксперимента
Для формирования необходимых компетенций обучающийся должен владеть:
-самостоятельной работой с учебной и справочной литературой
-навыками безопасной работы в химической лаборатории и умение обращаться с химической посудой и реактивами
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки.
1.Проводники электричества I и II рода.
2. Удельная электропроводность, зависимость ее от: концентрации, температуры, частоты тока (для биологических клеток)
3. Молярная электропроводность, зависимость ее от: концентрации, температуры.
4. Закон Кольрауша.
5. Кондуктометрическое титрование.
4. Вид занятия: лабораторное занятие.
5. Продолжительность занятия: 3 академических часа.
Оснащение рабочего места.
6.1. Дидактический материал: справочник физико-химических величин,
6.2. ТСО: калькуляторы.
6.3. Посуда и приборы:
| Кондуктометр, электрохимическая ячейка, платиновые электроды
| на группу
|
| 6.4. Объекты исследования:
|
| раствор0,1нСН3СООН
| на группу
|
| 6.5. Реактивы:
|
| раствор 0,02н KCl, вода дистиллированная
| на группу
|
7. Содержание занятия:
Типовой тест входного контроля.
1.Носители электрического тока в проводниках I рода:
1) ионы 2)электроны3)ионы и электроны4) радикалы
2. Ионы являются носителями электрического тока в:
1) проводниках I рода 2) проводниках II рода 3) металлах
4) электролитах
3. Более высокую электрическую проводимость имеет раствор
1) HCl 2)CH3COOH 3)NH4OH 4)C2H5OH
4. Электрическая проводимость ниже у:
1) костной ткани 2) кожи 3)желудочного сока 4) крови
5. Кондуктометрическим методом определяют:
1) редокс-потенциал 2)электрическую проводимость 3)точку эквивалентности 4) константу ячейки
7.2. Узловые вопросы, необходимые для усвоения темы занятия.
1.Электропроводность растворов электролитов
2. Удельная электропроводность, ее зависимость от концентрации для слабых и сильных электролитов
3. Молярная электропроводность при бесконечном разведении. Закон Кольрауша. Подвижности ионов.
4. Определение степени диссоциации по данным измерения электропроводности.
5. Кондуктометрия: принцип действия, применение в аналитической химии и санитарно-гигиенических исследованиях.
Самостоятельная работа обучающихся.
Лабораторная работа.
Опыт 1. Определение константы диссоциации слабого электролита.
Включите кондуктометр в сеть и прогрейте его. Определите постоянную электрохимической ячейки. Для этого измерьте сопротивление 0,02н раствора KCl.
К = Rст·æст, где æст = 0,0025 [1 + 0,021(t-20)]Ом-1·см-1, t = 15…25ºС
Если кондуктометр сразу показывает удельную электропроводность (æ), то по стандартному раствору установите рассчитанное æст показание. Последовательным двукратным разбавлением приготовьте серию из 5-ти растворов слабого электролита СН3СООН разных концентраций С: 0,1н, 0,05н, 0,025н, 0,0125н, 0,00625н и измерьте сопротивление Rxили электропроводность æх всех приготовленных растворов.
Рассчитайте æ, если измеряли Rx, λ, α, λ∞, КД:
æ∞ = K/Rx, Ом-1·см-1;
λ = æ/с·103, см2/Ом·моль;
α = λ/λ∞;
λ∞ = λ+ + λ- (по справочнику)
К дис = 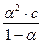
Результаты опыта запишите в таблицу:
| раствор
| R, Ом
| æ, Ом-1·см-1
| λ, см2/Ом·моль
| α
| К дис
| 1/λ
| λ·с
| Кдис.тр
|
| 0,02н KCl
|
|
| К = ………
|
|
|
|
| 0,1н
|
|
|
|
|
|
|
|
|
| 0,05н
|
|
|
|
|
|
|
|
|
| 0,025н
|
|
|
|
|
|
|
|
|
| 0,0125н
|
|
|
|
|
|
|
|
|
| 0,00625н
|
|
|
|
|
|
|
|
|
Кдис. ср. = ………
По данным таблицы постройте графики: 1) æ = f(C); 2) λ = f(C); 3) α = f(C);
4) 1/λ = f(λ·C)
Рассчитайте Кдис как среднеарифметическое и графически из зависимости (4): К = 1/(tgφ·λ2∞), и сравните полученные значения.
Вывод: Кдис = ………
7.4. Контроль усвоения темы занятия.