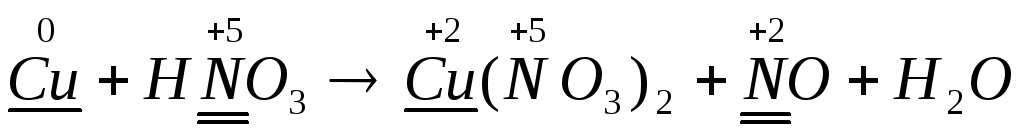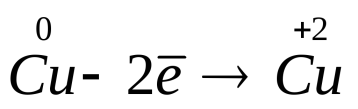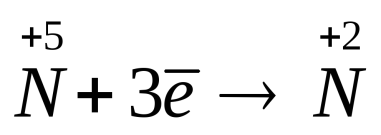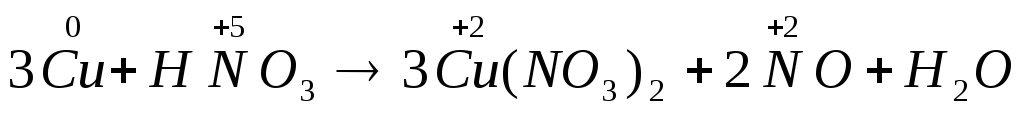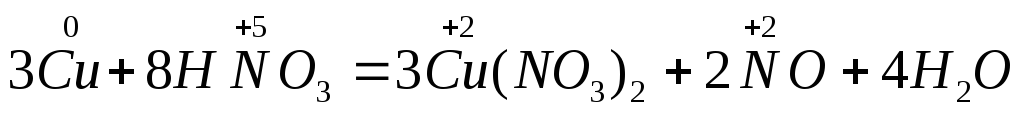Окислительно-восстановительная реакция - реакция с изменением степеней окисления химических элементов.
Алгоритм определения типа окислительно-восстановительной реакций:
1. Расставить степени окисления у химических элементов, входящих в окислительно-восстановительную реакцию.
2. Определить в каких веществах меняется степень окисления химического элемента:
- если атомы окислителя и восстановителя находятся в молекулах разных веществ, то реакция межмолекулярная;
-если степень окисления меняется у разных атомов, входящих в состав одной молекулы, то реакция внутримолекулярная;
-если один элемент меняет свою степень окисления, то реакция диспропорционирования.
Цель задания:
- углубление и расширение знаний по предложенной теме;
- формирование умений использовать специальную и дополнительную литературу.
Срок выполнения:
- подготовить к следующему теоретическому занятию.
Форма контроля:
- проверка наличия выполненного задания у каждого студента.
Критерии оценки:
1. Правильное определение степеней окисления(3 балла).
2. Правильное нахождение элементов меняющих свою степень окисления(2 балла).
3. Правильное определение типа окислительно-восстановительных реакций(1 балл).
Оценка:
2-3 баллов «удовлетворительно»
3-5 баллов «хорошо»
6 баллов «отлично».
5. Упражнения по расстановке коэффициентов в окислительно-восстановительных реакциях.
Алгоритм расстановки коэффициентов в окислительно-восстановительных реакциях:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:

2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
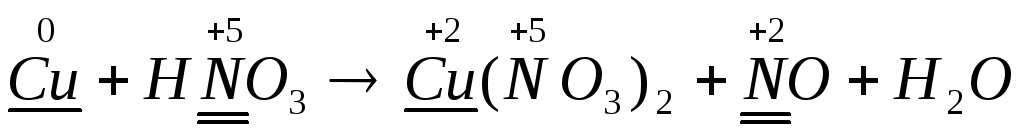
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
|
| Число электронов
| Коэффициенты
| Процесс
|
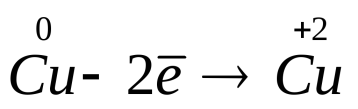
| 2
| 3
| окисление
|
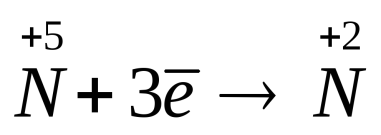
|
3
| 2
| восстановление
|
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
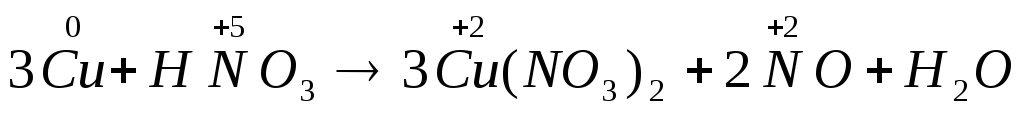
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
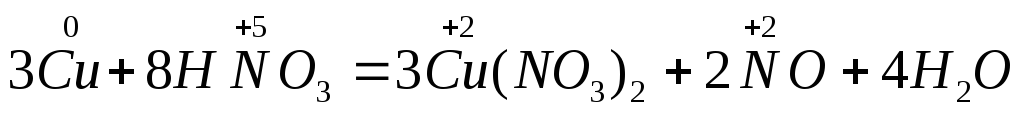
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Цель задания:
- углубление и расширение знаний по предложенной теме;
- формирование умений использовать специальную и дополнительную литературу.
Срок выполнения:
- подготовить к следующему теоретическому занятию.
Форма контроля:
- проверка наличия выполненного задания у каждого студента.
Критерии оценки:
1. Правильное определение степеней окисления химических элементов(2 балла).
2. Правильное определение процессов окисления и восстановления(2 балл).
3. Правильная расстановка коэффициентов(3 балл).
Оценка:
3-4 баллов «удовлетворительно»
5-6 баллов «хорошо»
7 баллов «отлично».
6. Упражнения по составлению формул и названий комплексных соединений.
Названия комплексных соединений (солей) образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже.
1. Название комплексного катиона составляют следующим образом:
А. Сначала указывают числа (используя греческие числительные) и названия анионных (отрицательно заряженных) лигандов с окончанием «о».
Греческие числительные:
|
|
|
|
|
|
|
|
|
|
|
| моно
| ди
| три
| тетра
| пента
| гекса
| гепта
| окта
| нона
| дека
|
Названия анионных лигандов:
| Сl–
| CN–
| SО32–
| SО42–
| ОН–
| NО2–
| СNS–
| СО32–
| N3–
|
| хлоро
| циано
| сульфито
| сульфато
| гидроксо
| нитро
| родано
| карбонато
| азидо
|
Б. Затем называют числа и названия нейтральных лигандов:
| Н2О
| NН3
| СО
| NO
|
| аква
| аммин
| карбонил
| нитрозил
|
В. Последним называется комплексообразователь в родительном падеже с указанием степени его окисления (в скобках римскими цифрами после названия комплексообразователя).
Например, [Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины (II).
Если металл образует ион с одной степенью окисления, то она в название комплекса может не входить. Например, [Zn(NH3)4]Cl2 – дихлорид тетраамминцинка.
2. Название комплексного аниона образуется аналогичным образом, с добавлением суффикса «ат» к корню латинского названия комплексообразователя (например, феррат, никелат, хромат, кобальтат, купрат и т.д.). Например:
K2[PtCl6] – гексахлороплатинат (IV) калия;
Ba[Cr(NH3)2(SCN)4]2 – тетрароданодиамминхромат (III) бария;
K3[Fe(CN)6] – гексацианоферрат (III) калия;
K2[BeF4] – тетрафторобериллат калия.
3. Названия нейтральных комплексных частиц образуются так же, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисления не указывают, т.к. она определяется электронейтральностью комплекса. Например:
[Pt(NH3)2Cl2] – дихлородиамминплатина;
[Ni(CO)4] – тетракарбонилникель.
Цель задания:
- углубление и расширение знаний по предложенной теме;
- формирование умений использовать специальную и дополнительную литературу.
Срок выполнения:
- подготовить к следующему теоретическому занятию.
Форма контроля:
- проверка наличия выполненного задания у каждого студента.
Критерии оценки:
Правильное написание комплексного соединения - «отлично».
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ОБУЧАЮЩИХСЯ
Тема №1. Предметы и задачи химии. Основные понятия и законы химии.
Уметь: углубить и расширить знания по предложенной теме; формирование умений использовать специальную и дополнительную литературу.
Знать: русских ученых в развитие общей и неорганической химии, знаменательные открытия.
Задание: подготовить сообщение на тему «Вклад русских ученых в развитие неорганической химии».