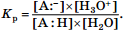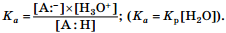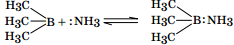Конформации ациклических соединений. Этан — одна из простейших молекул, для которой возможно существование конформаиий. В результате полного оборота, совершаемого одной метильной группой относительно другой, возникает бесконечное множество конформаций, шесть из них с торсионными углами, кратными 60°, — три заслоненных и три заторможенных — соответствуют максимумам и минимумам на энергетической кривой. 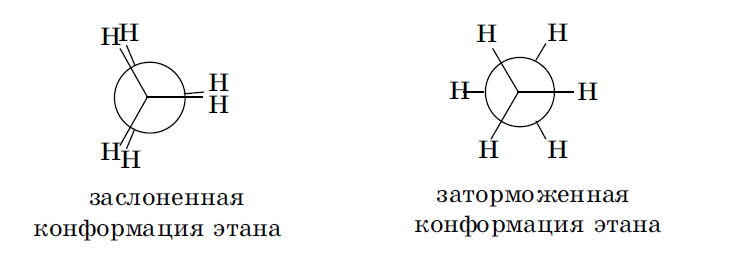
Заслоненные и заторможенные конформации отличаются уровнем потенциальной энергии. Заслоненные конформации этана неустойчивы, причиной этого является отталкивание электронных оболочек противостоящих связей, называемое торсионным напряжением. Торсионным напряжением объясняется неустойчивость отдельных конформаций более сложных молекул. В молекуле бутана при повороте вокруг связи С-2—С-3 возникает большее по сравнению с этаном число различающихся по энергии конформаций, что связано с различным взаимным расположением метильных групп. В наиболее энергетически выгодной антиперипланарной конформации метильные группы максимально удалены друг от друга. Наименее устойчива синперипланарная конформация, в ней кроме упоминавшегося ранее торсионного напряжения имеется взаимное отталкивание сближенных в пространстве метильных групп — Ван-дер-ваальсово напряжение. В синклинальной (скошенной, или гош-) конформации отсутствует торсионное напряжение, но сохраняется ван-дер-ваальсово напряжение. В антиклинальной конформации сохраняется торсионное напряжение, но отсутствует ван-дер-ваальсово.
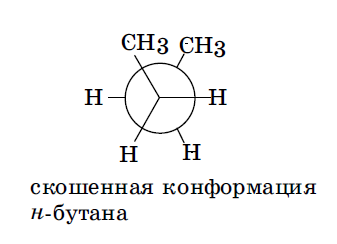
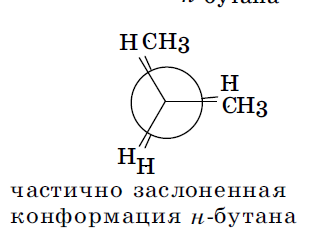
Отдельные, относительно устойчивые конформации называются конформерами. Например, для бутана таковыми являются антиперипланарная и синклинальные конформации. Конформерам соответствуют минимумы на энергетических кривых. Заслоненные конформации можно рассматривать как переходное состояние между относительно устойчивыми конформерами. Большую часть времени молекулы существуют в виде устойчивых заторможенных конформеров. Так, у бутана 69% молекул существуют в виде энергетически самой выгодной антиперипланарной конформации и 31%— в виде синклинальной (скошенной) конформации.
Молекулы с длинными углеродными цепями принимают сложные конформации, которые можно рассматривать как сочетание конформаций простых двухуглеродных фрагментов. Термодинамически наиболее выгодны зигзагообразные конформации, в которых отсутствует как торсионное, так и ван-дер-ваальсово напряжение. В зигзагообразных конформациях все объемные группировки атомов занимают друг относительно друга антиперипланарное положение, в такой конформации все связи С—С длинной углеродной цепи располагаются в одной плоскости.
Конформации циклогексана.
Из разных конформаций, принимаемых молекулой циклогексана, наиболее устойчивой является конформация кресла. Конформация кресла наиболее симметрична, каждый атом углерода имеет по две неэквивалентные связи С—Н. Связи, расположенные параллельно вертикальной оси симметрии третьего порядка, называют аксиальными (а), а связи, ориентированные под утлом 109,5° относительно упомянутой оси, называют экваториальными (е). В процессе конформационных превращений аксиальные заместители становятся экваториальными и соответственно экваториальные — аксиальными. С этой точки зрения конформационные переходы циклогексана называются инверсией.
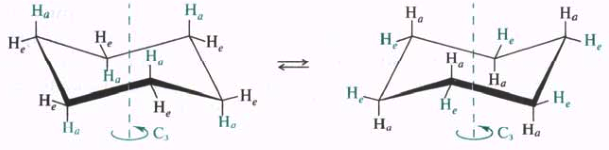
Молекулы монозамещеиных циклогексанов в процессе конформационных превращений могут принимать две неэквивалентные конформации кресла с аксиальным (аксиальный конформер) или экваториальным (экваториальный конформер) положением заместителя. Термодинамически более выгоден экваториальный конформер. Причина относительной неустойчивости аксиальной конформации метил циклогексана заключается в 1,3-диаксиальном взаимодействии (разновидность ван-дер-ваальсова напряжения) метильной группы и аксиальных атомов водорода в положениях 3 и 5 циклогексанового кольца, при этом происходит взаимное отталкивание метильной группы и атомов водорода.
Еще одной причиной, обусловливающей предпочтительное нахождение объемных заместителей в экваториальном положении, является то, что аксиальная метильная группа находится в скошенном положении относительно группы СН2 алицикла, и в этом случае также возникает ван-дер-ваальсово напряжение:
Торсионное напряжение (напряжение Питцера) вызвано электростатическим взаимодействием противостоящих связей.
Напряжение Ван-дер-Ваальса, возникающее при расположении заместителей на расстоянии, приблизительно равном сумме их ван-дер-ваальсовых радиусов.
Угловое напряжение (напряжение Байера),вызванное отклонением валентного угла в цикле от нормального угла для данного валентного состояния.
17. Кислотные и основные свойства органических соединений. Теории Бренстеда-Лоури и Льюиса. Примеры.
в 1923 г. датчанин Й. Бренстед и англичанин Т. Лоури независимо друг от друга для описания кислотно-основных свойств соединений предложили более общую протонную теорию, согласно которой кислотно-основные взаимодействия рассматривались как результат межмолекулярного переноса протона. При этом кислотами А (Acid) были названы соединения, способные при таком взаимодействии отщеплять протон: 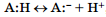 , а основаниями — В: (Base) — соединения, способные присоединять протон:
, а основаниями — В: (Base) — соединения, способные присоединять протон: 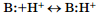 Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию:
Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию: 
При этом кислота, отдав протон, приобретает способность к его присоединению и превращается в сопряженное с ней основание А:–, а основание, присоединив протон, становится способным его отдавать и превращается в сопряженную с ним кислоту В:Н+. Таким образом, кислотные свойства вещество может проявить только в присутствии оснований, и наоборот, т. е. эти понятия являются относительными.
Этот равновесный процесс может быть количественно охарактеризован с помощью константы равновесия Kр: 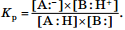 Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:
Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:  Для данного взаимодействия константа равновесия рассчитывается по формуле
Для данного взаимодействия константа равновесия рассчитывается по формуле
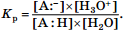
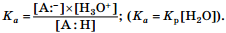
Для органических соединений эта константа оказалась очень маленькой величиной, и на практике было предложено пользоваться ее отрицательным десятичным логарифмом: рKа = –lgKа. Чем меньше значение рKа, тем сильнее кислота, и наоборот. Как правило, при прочих равных условиях (температура, природа растворителя) кислотность органического соединения определяется стабильностью аниона, образующегося из него после отщепления протона (стабильностью сопряженного основания): чем стабильнее анион, тем сильнее кислота.
Американский химик Г. Н. Льюис для описания подобных взаимодействий предложил апротонную теорию, в соответствии с которой кислотно-основные свойства соединений определяются их способностью принимать или отдавать электронную пару при образовании новой ковалентной связи. В соответствии с этой теорией кислотами (А) называют соединения, способные присоединять электронную пару (акцепторы электронной пары), основаниями (В) — соединения, способные отдавать электронную пару (доноры электронной пары). 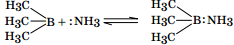
Триметилбор в приведенной выше реакции является кислотой Льюиса, аммиак — основанием. Поэтому все химические реакции, сопровождающиеся переносом протона, также являются кислотно-основными взаимодействиями в соответствии с теорией Льюиса. Недостатком теории Льюиса является невозможность точной количественной оценки выраженности кислотно-основных свойств соединений. В определенной мере этот недостаток был устранен американским химиком Р. Пирсоном, который предложил все кислоты и основания Льюиса разделить на «мягкие» и «жесткие». Принцип Пирсона оценивает лишь конкретные кислотно-основные взаимодействия с образованием донорно-акцепторной связи. Жесткие кислоты более энергично, с образованием более прочных связей реагируют с жесткими основаниями, мягкие кислоты — с мягкими основаниями. Степень жесткости или же мягкости органических оснований определяют по реакции СН3Hg+ + BH CH3HgB + H+ Если ее константа равновесия > 1, то основание В мягкое, если < 1, то жесткое. Донорные атомы жестких оснований имеют высокую электроотрицательность и низкую поляризуемость, вследствие чего с трудом отдают свои электроны для образования донорно-акцепторных связей (вследствие этого они трудно окисляются, легко образуют водородные связи). К жестким основаниям относятся Н2О, ОН–, ROH, RO–, R2O, NH3, RNH2, F–, Cl–. Наиболее жестким основанием является гидроксильный анион ОН–. В мягких основаниях донорные атомы, напротив, характеризуются низкой электроотрицательностью и легко поляризуются (они также легко окисляются). Мягкими основаниями являются I–, R2S, RSH, CN–, H–, R–. В жестких кислотах акцепторные атомы имеют высокую электроотрицательность, трудно поляризуются, часто несут положительный заряд. Например, Н+, Li+, Na+, K+, BF3, AlCl3, HHal. Наиболее жесткой кислотой Льюиса является протон Н+. В мягких кислотах акцепторные атомы имеют низкую электроотрицательность и легко поляризуются, обычно имеют большой объем. Примером могут являться I2, Br2, CH3Hg+. Значение теории Льюиса состоит в том, что она позволяет предположить наиболее вероятный исход взаимодействия двух соединений при возможности альтернативного течения реакции.







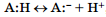 , а основаниями — В: (Base) — соединения, способные присоединять протон:
, а основаниями — В: (Base) — соединения, способные присоединять протон: 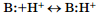 Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию:
Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию: 
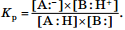 Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:
Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:  Для данного взаимодействия константа равновесия рассчитывается по формуле
Для данного взаимодействия константа равновесия рассчитывается по формуле