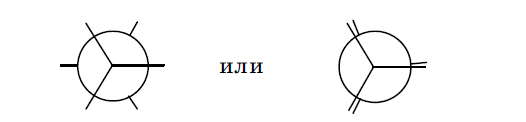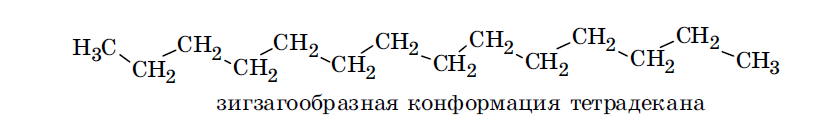Нередко органическую химию обозначают как химию соединений углерода. Атомы углерода уникальны тем, что могут соединяться между собой практически в неограниченном количестве с образованием линейных и разветвленных цепей, циклов. При этом оставшиеся свободными (не затраченные на связывание друг с другом) его валентности заполняются атомами водорода и различными другими атомами периодической системы Д. И. Менделеева. Чаще других — это атомы азота, кислорода, серы, фосфора и галогенов, которые носят название элементов — органогенов.
Электроны атомов располагаются в пространстве вокруг ядра на различных энергетических уровнях, количество которых соответствует номеру периода в таблице Д. И. Менделеева. Электроны, располагающиеся на более высоком уровне, обладают большей энергией. Часть пространства вокруг ядра, в котором нахождение электрона наиболее вероятно, называется электронной орбиталью. Именно в этой части пространства создается максимальная концентрация электронной плотности (отрицательного заряда). Орбитали могут иметь различную форму, что принято обозначать буквами s, p, d и f. На каждой орбита ли могут находиться не более двух электронов. Заполнение орбиталей электронами происходит по мере увеличения их энергии. Наименьшей энергией обладают электроны, находящиеся на s орбитали, поэтому она заполняется в первую очередь. Далее по мере увеличения энергии следуют p, d и f орбитали. Электроны внешнего энергетического уровня, обладающие наибольшей энергией, называются валентными. В возбужденном состоянии атома возможен переход электронов на имеющиеся вакантные орбитали более высокого уровня, в результате чего возможно их распаривание. Затрачиваемая на это энергия в последствии с избытком компенсируется при образовании дополнительных химических связей.
S орбиталь имеет центр симметрии и сферическую форму:
На каждом энергетическом уровне имеется 1 s орбиталь.
р орбиталь имеет ось симметрии и форму равноплечей восьмерки (гантели), в пространстве может располагаться в трех взаимно перпендикулярных плоскостях (по осям декартовых координат x, y и z):
У атома водорода имеется всего 1 электрон на s- орбитали: 1 s 1.
Атомы углерода, кислорода и азота располагаются во втором периоде системы Д. И. Менделеева и имеют электроны только на s и p уровнях. У атома серы, находящегося в третьем периоде, имеются s, p и d5 уровни.
Атом углерода содержит 6 электронов, которые распределяются по орбиталям следующим образом: 1 s 22 s 22 p 2. В возбужденном состоянии 1 электрон с s орбитали пере ходит на свободную р орбиталь: 1 2 22 1 12 12 1 В этом состоит уникальность атома углерода: все его валентные орбитали внешнего энергетического уровня заполнены неспаренными электронами.
При образовании различных химических соединений атома углерода электроны его валентного (внешнего) уровня вовлекаются в процесс гибридизации (смешения). Смешение, например, s и p орбиталей приводит к образованию гибридных орбиталей (орбиталей), форма которых представлена неравноплечей восьмеркой (гантелей). Параметры гибридных орбиталей и их ориентация в пространстве могут быть различными в зависимости от типа гибридизации.
sp 3гибридизация. В процесс объединения вовлекаются 1 s- и 3 р- орбитали с образованием 4 sp 3гибридизованных орбиталей:
sp 2гибридизация. В процесс объединения вовлекаются 1 s и 2 р -орбитали с образованием 3 sp 2 гибридизованных орбиталей:
Sp- гибридизация. В процесс объединения вовлекаются 1 s- и 1 р- орбиталь с образованием 2 sp -гибридизованных орбиталей:
Процесс гибридизации электронных орбиталей сопровождается некоторым увеличением энергии валентных электронов. Но при объединении атомов в молекулы перекрывание гибридизованных облаков оказывается более эффективным, образующиеся ковалентные связи более прочные, что в конечном итоге делает процесс гибридизации термодинамически выгодным. По мере увеличения доли s- орбитали в гибридной орбитали возрастает электроотрицательность атомов: sp > sp 2 > sp 3.
Рассмотренные принципы гибридизации применимы и к другим атомам, встречающимся в составе органических соединений.
Атом азота на внешнем уровне имеет 5 электронов. Поскольку на втором уровне имеется только 4 электронные орбитали, одна из них обязательно должна содержать 2 электрона.
В состоянии sp 3 гибридизации (таковым атом азота бывает в составе аминов, в аммиаке) распределение электронов имеет следующий вид: 1 s 22(sp 3)5. На одной из 4 гибридных орбиталей располагаются 2 электрона. За счет этой неподеленной электронной пары атом азота может образовывать донорно-акцепторную связь, например с протоном Н+, и обусловливать наличие у соединения основных свойств.
sp2 гибридизация атома азота возможна в двух вариантах.
sp2 I. Неподеленная пара электронов располагается на негибридизованной рz -орбитали: 1 s 22(sp 2)32 pz 2. В таком гибридном состоянии атом азота присутствует в составе пиррола, амидов карбоновых кислот, анилина и носит на звание пиррольного.

Находящаяся на негибридизованной pz -орбитали неподеленная пара электронов вовлекается в сопряжение с электронами связей и становится малодоступной для присоединения протона. Поэтому основные свойства такого атома азота выражены очень слабо.
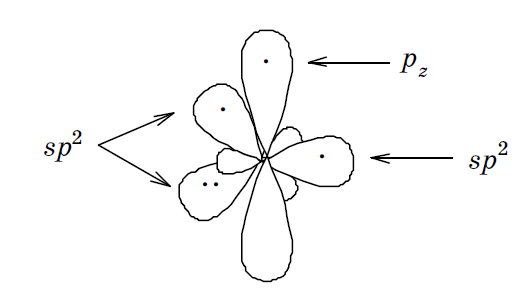
sp 2II. Пара электронов в данном случае располагаетсяна одной из трех sp 2- гибридных орбиталей и не участвует в образовании ковалентных связей: 1 s 2 (sp 2) 4 2 pz 1. Обычно в таком гибридном состоянии атом азота присутствует в том случае, если он участвует в образовании двойной связи, например, в пиридине и носит название пиридинового.

За счет свободной пары электронов подобные соединения легко присоединяют протон и проявляют заметные основные свойства, хотя выражены они слабее, чем у соединений с sp3- гибридизованным атомом азота. Причина заключается в большей электроотрицательности sp2- гибридизованного азота.
Sp- гибридизованным атом азота бывает при образовании тройной связи, например в нитрилах: 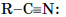 1s2 2(sp)3 2 p1y 2 pz1. Основные свойства у такого атома азота практически не проявляются.
1s2 2(sp)3 2 p1y 2 pz1. Основные свойства у такого атома азота практически не проявляются.
· Атом кислорода имеет 8 электронов: 1s2 2s2 2р4 и в органических соединениях обычно присутствует в состоянии sp2 гибридизации (1 s 22(sp 2)52 pz 1).Наличие 2 неспаренных электронов в триплетном состоянии (основное состояние) делает кислород двухвалентным. Отсутствие вакантных орбиталей во внешнем электронном слое не позволяет атому кислорода распаривать свои электроны и за счет этого повышать свою валентность. В то же время наличие двух неподеленных электронных пар делает возможным для кислорода выступать в роли донора одной из них при образовании донорно-акцепторной (в том числе и водородной) связи.
· Атом серы имеет с кислородом схожее строение внешнего электронного уровня: 1(s2)2(s2)2(р6)3(s2)3(р4). В отличие же от атома кислорода, у атома серы во внешнем электронном слое имеются вакантные d орбитали. За счет этого возможно распаривание электронов третьего уровня (в возбужденном состоянии) с появлением 4 или 6 неспаренных электронов, что позволяет атому серы образовывать 2, 4 или 6 ковалентных связей.
5. Типы химических связей в органических соединениях. Ковалентные s- и p-связи. Атомы подавляющего большинства химических элементов в свободном виде в природе практически не встречаются, они, как правило, присутствуют в составе молекул различных химических соединений. Причина заключается в том, что для атомов термодинамически выгодным является наличие полностью заполненного электронами внешнего (валентного) электронного уровня. Исходно он заполнен только у атомов VIII группы периодической системы, и это определяет их химическую инертность. Остальные химические элементы имеют в той или иной степени не заполненные внешние электронные уровни (оболочки). Именно поэтому их атомы объединяются в молекулы различных химических соединений, образуя при этом заполненные свои внешние энергетические уровни.
При наличии небольшого количества электронов на внешнем уровне атомы склонны их отдавать и превращаться в катионы: Na – 1е– Na+.
Атомы, имеющие небольшую нехватку электронов (до полного заполнения) на внешнем уровне, в большей степени склонны присоединять недостающее количество электронов и превращаться в анионы: Cl + 1е– Cl–.
Впоследствии разноименно заряженные ионы притягиваются друг к другу и могут образовывать различные соединения, например: Na+ + Cl– NaCl.
Совокупность сил и взаимодействий, удерживающих атомы в составе молекул, называется химической связью. В рассмотренном примере возникает ионная связь.
Атом углерода имеет на внешнем валентном уровне 4 электрона. На втором энергетическом уровне возможно расположение 8 электронов (при полном его заполнении). Следовательно, для атома углерода «одинаково длинным» оказывается путь, как в сторону отдачи имеющихся электронов, так и в сторону присоединения недостающих. Именно поэтому основным типом химической связи в органических соединениях является ковалентная связь.
Ковалентная связь образуется за счет обобществления валентных электронов атомов, участвующих в формировании связи, и образования ковалентных пар. Происходит это в результате взаимного перекрывания их электронных орбиталей. В области перекрывания создается повышенная электронная плотность, к которой электростатически притягиваются положительно заряженные ядра атомов. Атомы углерода способны образовывать подобные связи друг с другом, с атомами, легко принимающими электроны (галогены, кислород) и легко отдающими электроны (водород).
В зависимости от характера перекрывания различают 2 типа ковалентных связей.
Ơ связь. Она возникает при осевом перекрывании электронных орбиталей в результате чего область перекрывания оказывается расположенной на линии, соединяющей центры атомов, образующих эту связь. Это возможно при перекрывании двух s орбиталей, двух гибридных ơ орбиталей (sp3, sp2, sp), двух р орбиталей, одной s и одной ơ орбитали:
Ơ связь обладает цилиндрической симметрией и допускает свободное вращение атомов вокруг своей оси. Между двумя атомами возможно образование только одной связи.
Π связь. Образуется при боковом перекрывании негибридизованных р орбиталей атомов. Очевидно, что в этом случае область перекрывания орбиталей будет находиться вне линии, соединяющей центры атомов, притяжение ядер к области перекрывания будет слабее, чем в случае ơ связи, и свободное вращение атомов относительно друг друга невозможно:
Поскольку у атомов возможно наличие одной (pz) или двух (py и pz) негибридизованных орбиталей, они могут образовывать одну или две π связи. Для образования π связи атомы должны быть связаны между собой ơсвязью. Меньшая прочность и большая доступность для внешних воздействий определяют более высокую реакционную способность соединений, содержащих π связи.
Количество обобществленных ковалентных пар определяет кратность связи. Они могут быть одинарными (1 общая ковалентная пара), двойными (2 пары) и тройными (3 пары).
Процесс образования химических связей сопровождается выделением энергии, количество которой характеризует энергию связи. При прочих равных условиях чем выше кратность связи, тем меньше ее длина и больше энергия. Связи с большей энергией являются более прочными.
В зависимости от способности атомов, участвующих в образовании связи, притягивать к себе электроны (их электроотрицательности) ковалентные связи могут быть не полярными или полярными. Неполярные связи образуют
Типы химических связей в органических соединениях атомы с одинаковой или близкой электроотрицательностью. В этом случае область перекрывания электронных орбиталей находится посередине между их ядрами. В случае разной электроотрицательности область перекрывания смещается в сторону более электроотрицательного атома, и такие связи называются полярными. На атомах, образующих подобные связи, возникают частичные электрические заряды.
Область перекрывания электронных орбиталей между атомами в молекулах может смещаться под действием внешних воздействий. Подверженность ковалентной связи этому процессу определяет ее поляризуемость. Разновидностью ковалентной связи является донорноакцепторная (координационная) связь. В этом случае имеющаяся у одного из атомов свободная пара электронов поступает на вакантную электронную орбиталь другого атома.
6.Электронное строение главных функциональных групп.
Гидроксильная:
-спирты: имеются полярные связи с-о;о-н. Атом водорода имеет кислотный характер, за счет положительного заряда и полярной связи, атом кислорода имеет частично отрицательный заряд и 2 неподеленные электронные пары, это дает возможность образовывать водородные связи.
-фенолы: бензольное ядро частично вовлекает неподеленную электронную пару атома кислорода гидроксильной группы, электронная плотность кислорода снижается, а положительный заряд на атоме водорода увеличивается и он может проявлять кислотные свойства.
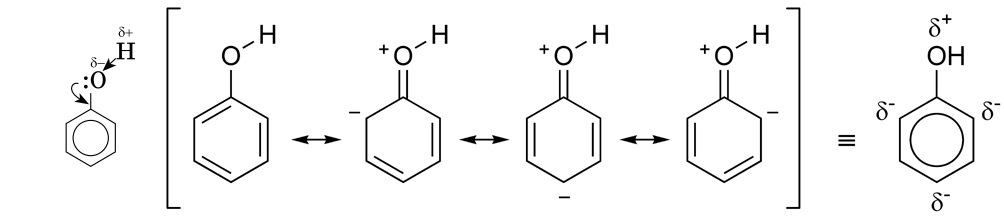
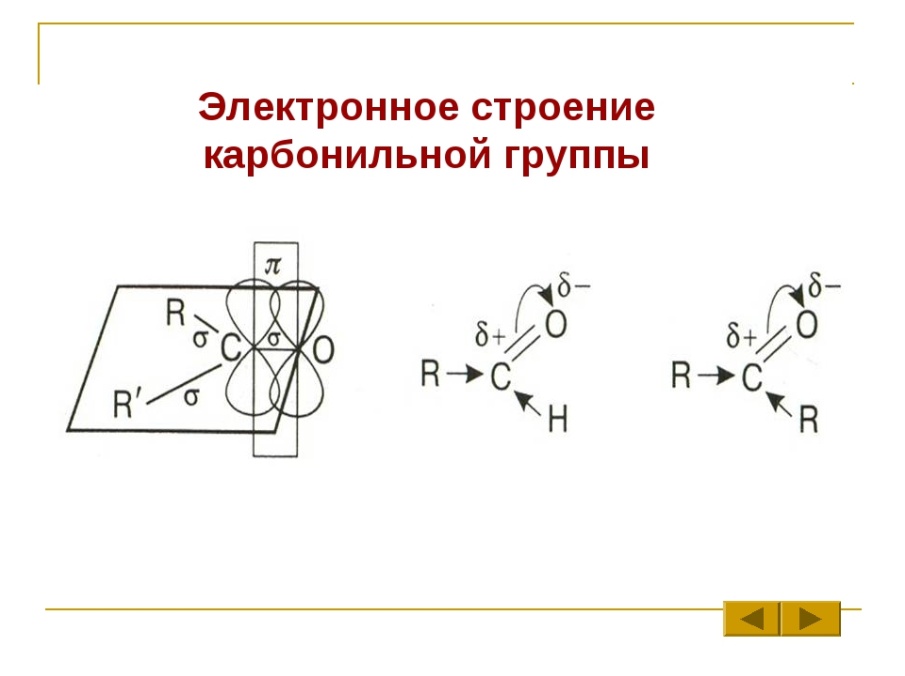
Карбонильная:
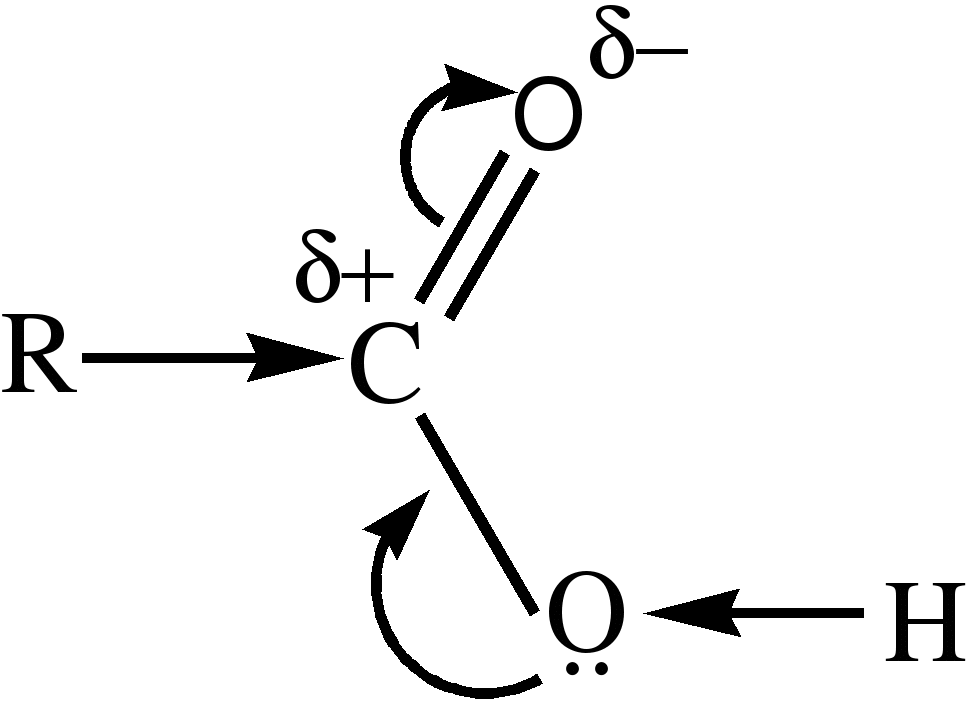
-альдегиды: имеют с=о карбонильную группу. Атом углерода sp2 гибридизирован. Атомы, связанные с ним находятся в одной плоскости, из-за большой электроотрицательности атома кислорода. Связь с=о сильно поляризована за счет смещения электронной плотности π связи к кислороду. Под влиянием атома углерода увеличивается полярность связи с-н, что повышает реакционную способность атома Н.
Карбоксильная:
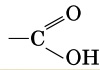 карбоксильная группа состоит из с=о карбонильной и –он гидроксильной. Ослабление связи между O и Н в гидроксильной группе объясняется разностью электроотрицательности атомов С, O, Н. Атом С приобретает некоторый + заряд, этот атом притягивает к себе электронное облако от атома O гидроксильной группы. Атом O оттягивает к себе электронное облако соседнего атома Н. Связь О-Н становится более полярной и атом Н приобретает большую подвижность.
карбоксильная группа состоит из с=о карбонильной и –он гидроксильной. Ослабление связи между O и Н в гидроксильной группе объясняется разностью электроотрицательности атомов С, O, Н. Атом С приобретает некоторый + заряд, этот атом притягивает к себе электронное облако от атома O гидроксильной группы. Атом O оттягивает к себе электронное облако соседнего атома Н. Связь О-Н становится более полярной и атом Н приобретает большую подвижность.
Аминная:
-алифатические
-ароматические
Аминогруппа:
связана с ароматическим кольцом. Имеется неподеленная электронная пара, поэтому амины проявляют свойства оснований.
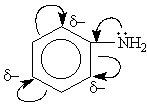
Нитрогруппа:
Плоская конфигурация, атомы N и O в sp2-гибридизации

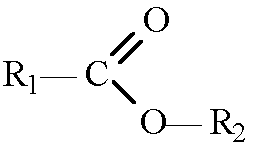
Сложно-эфирная:
При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры.
Галогенангидридная:
Производные кислот, в которых гидроксильные группы замещены атомами галогенов.
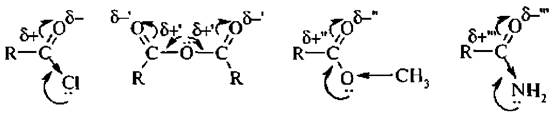
Амидная:
Производные кислот, в которых гидроксильные группы замещены на амино-группу.

Цианогруппа:
Цианиды-соли цианистоводородной кислоты
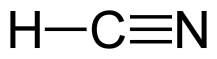
7.Делокализованная химическая связь. Сопряжение (π,π - р,π).
Если молекулярные электронные орбитали охватывают ядра более чем двух атомов, то это делокализованные связи. Такие связи присутствуют в сопряженных системах — молекулах, в которых имеет место чередование одинарных и двойных связей.
В сопряженных системах с открытой (незамкнутой) цепью всегда можно определить начало и конец цепи сопряжения.
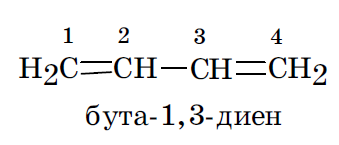
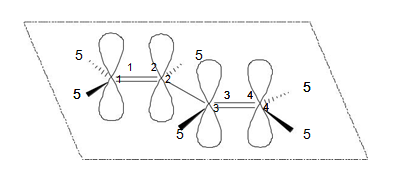
Перекрывание орбиталей происходит не только в положениях С1–С2 и С3–С4, как это следует из структурной формулы, но также и в положении С2–С3. В результате образуется единая делокализованная молекулярная орбиталь, охватывающая все 4 атома углерода молекулы. В этом и заключается суть явления сопряжения, т. е. сопряжение — это перекрывание негибридизованных электронов нескольких локализованных связей с образованием единой делокализованной многоцентровой молекулярной орбитали. Данный процесс выгоден в термодинамическом плане, поскольку он сопровождается уменьшением энергии молекулы и, следовательно, ее термодинамической стабилизацией. Степень снижения энергии молекулы в результате сопряжения называется энергией сопряжения. Величина этой энергии при прочих равных условиях тем больше, чем длиннее цепь сопряжения. Сопряжение сопровождается также и выравниванием межатомных расстояний: одинарные связи при этом укорачиваются, а двойные удлиняются по сравнению с их длиной в изолированном виде.
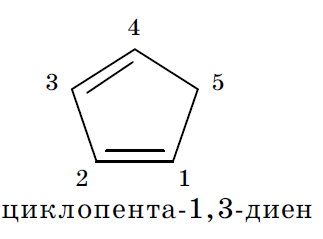
В рассмотренных молекулах бута 1,3 диена и цикло пента 1,3 диена имеет место, сопряжение, поскольку в процесс объединения вовлекаются электроны связей. Существует также и р, π сопряжение, при котором с электронами связей в сопряжение вовлекается электронная пара гетероатома, находящаяся на его негибридизованной pz орбитали.
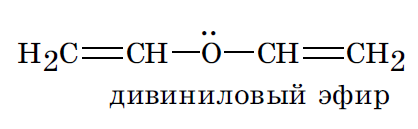
Возможно вовлечение в процесс сопряжения негибридизованных орбиталей заряженных атомов углерода в карбоанионах и карбокатионах, атомов углерода с неспаренным электроном в карборадикалах, что делает эти обычно нестабильные частицы относительно устойчивыми.
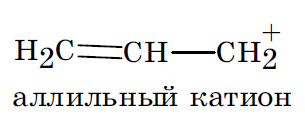
В сопряженных системах с замкнутой цепью сопряжения невозможно определить ни начало, ни конец цепи сопряжения. Круговая делокализация электронов по сравнению c таковой в рассмотренных ранее сопряженных системах с открытой цепью более выражена. Поэтому для замкнутых сопряженных систем характерны большая величина энергии сопряжения и, как следствие, более высокая термодинамическая стабильность по сравнению с таковыми у незамкнутых систем.
Их взаимное боковое перекрывание приводит к образованию единого делокализованного электронного облака, максимальная концентрация плотности которого оказывется сосредоточенной над и под плоскостью скелета молекулы (π, π сопряжение):
В ароматических гетероциклах может встречаться и р, π сопряжение, при котором с электронами π связей в объединение вовлекаются p электроны гетероатомов или p орбитали заряженных атомов углерода.
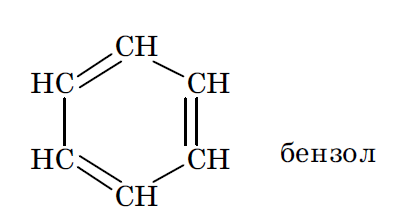
8. Ароматичность, ее критерии. Энергия резонанса (сопряжения) на примерах бензола, нафталина, гетероциклических соединений.
Ароматичность – это скопление максимальной концентрации плотности над и под плоскостью скелета молекулы, хоть и имеет ненасыщенный характер, чаще соединения вступают в реакции замещения, достаточно устойчивы к окислению. Критерии:
- плоский цикл (все атомы находятся в sp 2 гибридизованном состоянии);
-единая π электронная система
-количество электронов в сопряженной системе (N) соответствует формуле: N = 4 n + 2, где n — любое целое число (правило Хюккеля).
Степень снижения энергии молекулы в результате сопряжения называется энергией сопряжения. Величина этой энергии при прочих равных условиях тем больше, чем длиннее цепь сопряжения. Сопряжение сопровождается также и выравниванием межатомных расстояний: одинарные связи при этом укорачиваются, а двойные удлиняются по сравнению с их длиной в изолированном виде.

 N=6
N=6
Все атомы углерода циклогексатриенового цикла находятся в sp 2 гибридизованном состоянии, что обусловливает плоское строение скелета его молекулы. Негибридизованные pz орбитали всех шести атомов углерода расположены параллельно друг другу и перпендикулярно плоскости скелета. Их взаимное боковое перекрывание приводит к образованию единого делокализованного электронного облака, максимальная концентрация плотности которого оказывется сосредоточенной над и под плоскостью скелета молекулы (π,π сопряжение).
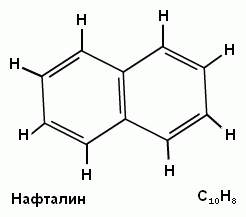 N=10
N=10 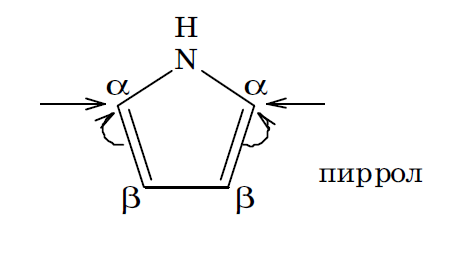
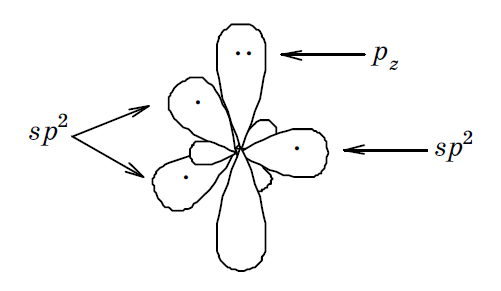
Атом азота этого пятичленного гетероцикла находится в sp 2 гибридизованном состоянии (sp 2 І): 1 s 2,2(sp 2) 3 2 pz 2.
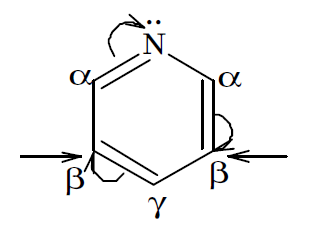
 пиридин
пиридин
Находится в sp 2 гибридизованном состоянии, распределением электронов на орбиталях: (sp 2 ІІ): 1 s 2,2(sp 2) 4 2 pz 1. Поэтому по сравнению с молекулой бензола ароматическая шести электронная система пиридина является электронодефицитной. Вследствие этого реакции S Е с пиридином протекают труднее, чем с бензолом, требуют более жестких условий, присутствия катализаторов.
Взаимное влияние атомов в молекулах органических соединений и способы его передачи. Индуктивный и мезомерный эффекты. Примеры.
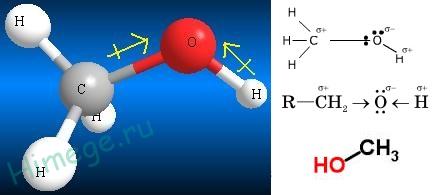
Все атомы, из которых построены молекулы любых органических соединений, оказывают друг на друга взаимное влияние. Например, этанол можно представить, как продукт замещения в этане одного из водородных атомов на гидроксильную группу –ОН.
Полученный в результате такой замены этанол обладает весьма разнообразной реакционной способностью и существенно отличается по своим химическим свойствам от инертного в химическом отношении этана. В то же время гидроксильная группа в этаноле по своим свойствам заметно отличается от фенольного гидроксила в молекуле фенола
Различия реакционной способности может быть реализовано электронным и стерическим путями. Электронный путь зависит от перераспределения электронной плотности в молекуле.
Электронная плотность в молекуле может располагаться в межъядерном пространстве на линии, соединяющей центры атомов (электроны σ связей) и вне этой линии (электроны π связей).
Электронные влияния заместителей в молекулах органических соединений могут быть реализованы посредством индуктивного и мезомерного эффектов.
Индуктивным (индукционным) эффектом называют перераспределение под действием заместителя электронной плотности в исходной молекуле вдоль оси σ связей.
Если связь образована атомами с одинаковой или очень близкой электроотрицательностью, то электроны ее ковалентной пары располагаются посередине между центрами этих атомов. В этом случае связь является неполярной. Таковыми являются, например, связи С–С и С–Н. Если же в образовании связи участвуют атомы с разной электроотрицательностью, то электронная плотность связи оказывается смещенной в сторону атома с большей электроотрицательностью. Такие связи называются полярными, поскольку на образующих их атомах возникают частичные заряды: + и – Качественно индуктивный эффект заместителей оценивают в сравнении с таковым у атома водорода.
Если заместитель притягивает к себе электроны слабее, чем это делает атом водорода, то считается, что он оказывает положительный индуктивный эффект (+I). В этом случае на замещенном атоме углерода возникает частичный отрицательный заряд –.
Если же заместитель по сравнению с атомом водорода притягивает к себе электроны сильнее, то считается, что он оказывает отрицательный индуктивный эффект (–I).
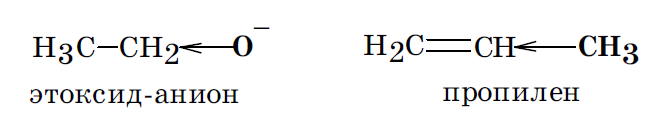
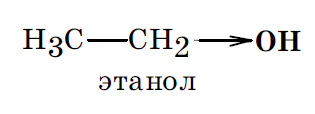
Мезомерный эффект (эффект сопряжения (С) или эффект резонанса (R)) — это перераспределение под действием заместителя электронной плотности в области π связей исходной молекулы.
Такой эффект могут оказывать лишь заместители, в структуре которых имеются либо р-, π- либо электроны на негибридизованных p орбиталях. Например, π-электроны присутствуют в заместителях, содержащих кратные связи (альдегидная, карбоксильные группы).
Неподеленную пару р электронов имеют в своем составе атомы галогенов (–Cl, –F, –Br, –I), гетероатомы в функциональных группах –ОН, –SH, –NH2.
После внедрения заместителя его р или π электроны должны быть вовлечены в сопряжение с π электронами исходной молекулы.
Если после внедрения заместителя электронная плотность связей исходной молекулы увеличивается, то считают, что заместитель оказывает положительный мезомерный эффект (+М). Такой эффект характерен для ОН, SH, NH2 группы, галогены.
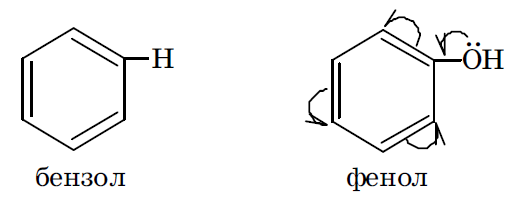

Если же электронная плотность π связей исходной молекулы под действием введенного в нее заместителя снижается, то считается, что заместитель оказывает отрицательный мезомерный эффект (–М). Такой эффект характерен для заместителей, имеющих в своем составе кратные связи, в образовании которых участвуют гетеро атомы с электроотрицательностью большей, чем у атома углерода. Например, это имеет место в карбоксильной, альдегидной, нитрильной группах.
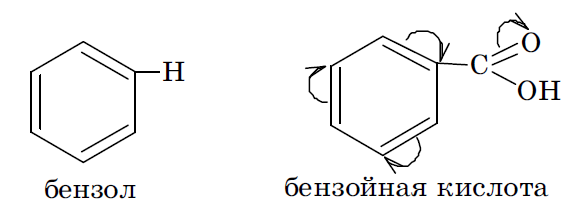
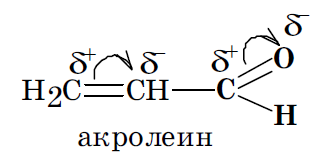
10. Электронодонорные и электроноакцепторные заместители.
В зависимости от интегрального изменения электронной плотности в молекуле, вызываемого введением заместителя, заместители принято делить на электронодонорные (ЭД) и электроноакцепторные (ЭА). Один и тот же заместитель в молекулах различных соединений может быть и электронодонорным, и электроноакцепторным. Это определяется характером оказываемых им электронных эффектов, соотношением их величины и возможностью их реализации в данной молекуле. Заместители, содержащие кратные связи и гетероатомы с большей, чем у водорода, электроотрицательностью (карбоксильная, карбонильная, нитрильная группы, сульфогруппа, нитрогруппа, у которых –I и –М), а также галогены, у которых –I > +M, во всех случаях являются электроноакцепторными заместителями. Гидроксильная же группа –ОН и аминогруппа –NН2 могут оказывать +М и –I эффекты, при этом +М > –I. Поэтому в зависимости от возможности реализации только индуктивного или же совместно индуктивного и мезомерного эффектов эти группы могут быть как электроноакцепторными, так и электронодонорными заместителями. Это определяется как строением исходной молекулы, так и местом внедрения такого заместителя.
Например, в феноле гидроксильная группа, оказывая оба эти эффекта, является электронодонорным заместителем, увеличивающим суммарную электронную плотность в ароматическом кольце. В молекуле же этанола гидроксильная группа может оказать только –I эффект (проявление мезомерного эффекта невозможно) и, следовательно, является электроноакцепторным заместителем.
Замещая в молекуле толуола различные атомы водорода на гидроксильную группу, можно получить бензиловый спирт и о- крезол:
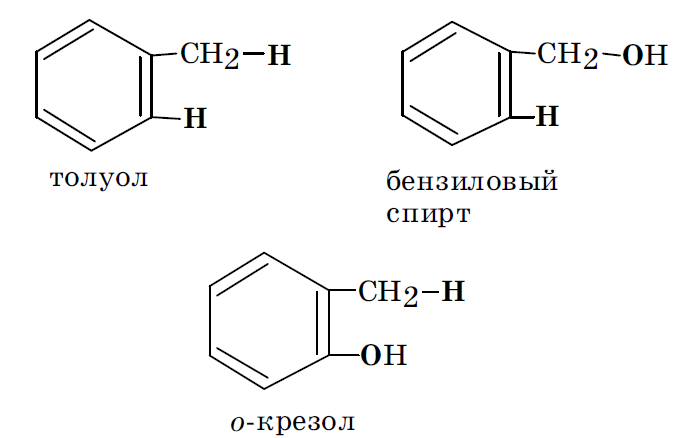
В бензиловом спирте ОН группа может реализовать только –I эффект и, следовательно, является электроноакцепторным заместителем. В о-крезоле эта же группа реализует и –I и +М эффекты. Поскольку у гидроксила +М > –I, он в данном случае будет являться электронодонорным заместителем
Пространственное строение органических соединений: конфигурация, конформация, способы их графического изображения. Примеры.
Пространственное расположение заместителей у атома углерода называется его конфигурацией. Например, у метана СН4 в одной плоскости могут быть расположены только 2 из 4 имеющихся в молекуле сигма связей.
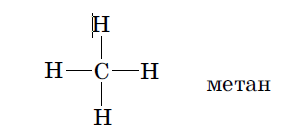
Такие связи при графическом изображении конфигурации принято обозначать валентными штрихами «—». Те связи, которые не лежат в плоскости чертежа и как бы уходят за нее от наблюдателя, изображаются заштрихованным треугольником: « », а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: «
», а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: « ». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом:
». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом: 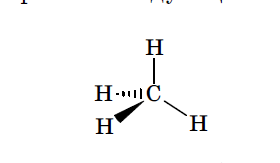
Вокруг одинарных сигма связей, обладающих цилиндрической (осевой) симметрией, возможно вращение атомов углерода. В результате этого заместители, имеющиеся у этих атомов, в пространстве могут занимать относительно друг друга различное положение, и молекула может приобретать различные варианты пространственного строения, которые в органической химии принято называть конформациями (конформерами, поворотными стереоизомерами). Для графического изображения конформаций какого-либо соединения обычно пользуются проекциями Ньюмена. При этом в соединении выбирают С–С связь, по оси которой происходит вращение остальных частей молекулы. Мысленно ось этой связи располагают перпендикулярно плоскости чертежа (наблюдатель смотрит как бы в торец этой связи). Ближний к наблюдателю атом углерода изображают точкой с отходящими от нее под равными углами 120 град. тремя лучами (связями):
Дальний атом изображается в виде окружности, от которой также отходят три луча под углом 120 град. друг к другу:
Изображения двух этих атомов углерода накладываются друг на друга, в результате чего и получается проекция Ньюмена:
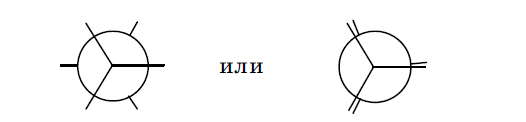
При наличии объемных заместителей у каждого из вращающихся атомов углерода возможно существование ряда скошенных конформаций (Гош-конформаций) и частично заслоненных конформаций, например, в молекулах 1-бромпропана (вращение атомов С1 и С2) и н -бутана (вращение атомов С2 и С3):
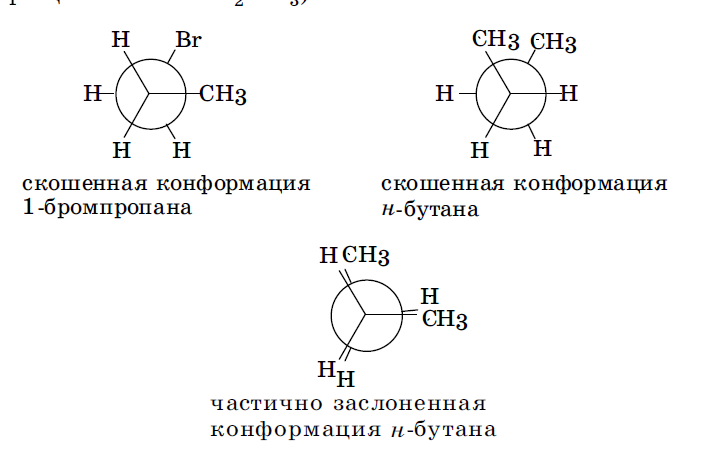
Заслоненная конформация обладает наибольшей потенциальной энергией и поэтому наименьшей термодинамической устойчивостью. Причина заключается во взаимном отталкивании электронов противолежащих ковалентных связей и возникновении вследствие этого в молекуле торсионного (вращательного) напряжения. Это напряжение может быть обусловлено также и взаимным отталкиванием близко расположенных объемных заместителей у соседних атомов углерода. В заторможенной конформации электроны противолежащих связей и объемные заместители (если имеются) максимально удалены друг от друга, молекула обладает наименьшей свободной энергией и, как следствие, наибольшей термодинамической устойчивостью. Скошенные и частично заслоненные конформации обладают промежуточными значениями свободной энергии и термодиначеской устойчивости. В результате подобного вращения соседних атомов углерода длинные незамкнутые цепи углеродных атомов могут приобретать различные пространственные формы. Среди множества возможных конформаций таких цепей наиболее стабильной является зигзагообразная. В этой конформации у всех соседних атомов углерода заместите ли (или атомы водорода) располагаются так же, как и в заторможенной конформации этана. 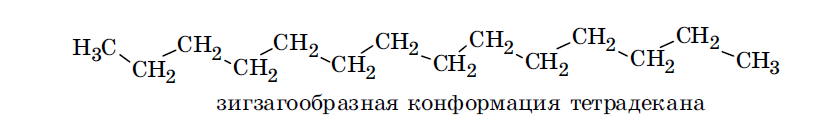
Выделяют также нерегулярную и клешневидную (термодинамически наименее выгодную) конформации. Для некоторых гетерофункциональных соединений в результате клешневидной конформации их углеродного скелета возможно пространственное сближение и взаимодействие этих групп с образованием новой связи и замыканием цикла, что в конечном итоге приводит к термодинамической стабилизации молекулы.





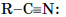 1s2 2(sp)3 2 p1y 2 pz1. Основные свойства у такого атома азота практически не проявляются.
1s2 2(sp)3 2 p1y 2 pz1. Основные свойства у такого атома азота практически не проявляются.


 карбоксильная группа состоит из с=о карбонильной и –он гидроксильной. Ослабление связи между O и Н в гидроксильной группе объясняется разностью электроотрицательности атомов С, O, Н. Атом С приобретает некоторый + заряд, этот атом притягивает к себе электронное облако от атома O гидроксильной группы. Атом O оттягивает к себе электронное облако соседнего атома Н. Связь О-Н становится более полярной и атом Н приобретает большую подвижность.
карбоксильная группа состоит из с=о карбонильной и –он гидроксильной. Ослабление связи между O и Н в гидроксильной группе объясняется разностью электроотрицательности атомов С, O, Н. Атом С приобретает некоторый + заряд, этот атом притягивает к себе электронное облако от атома O гидроксильной группы. Атом O оттягивает к себе электронное облако соседнего атома Н. Связь О-Н становится более полярной и атом Н приобретает большую подвижность.

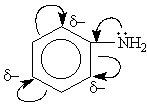



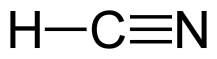
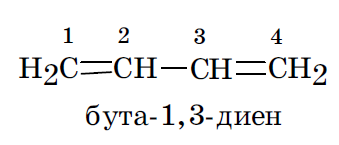


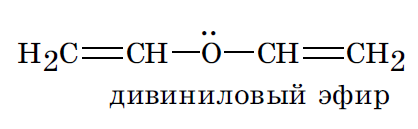
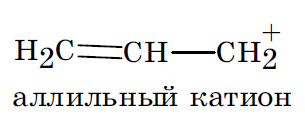

 N=6
N=6  N=10
N=10 


 пиридин
пиридин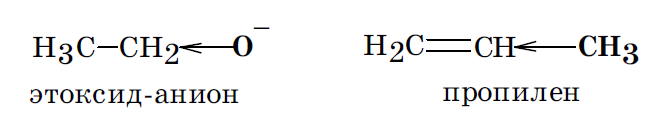
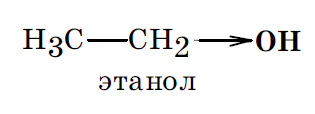



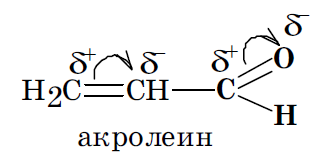


 », а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: «
», а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: « ». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом:
». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом: