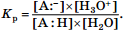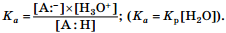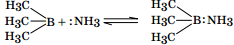Функциональная группа и строение углеродного скелета как классификационные признаки органических соединений.
Функциональной группой называют заместитель не углеводородной природы (следовательно, в его составе обязательно должен присутствовать гетероатом), определяющий принадлежность соединения к конкретному классу и одновременно его типичные химические свойства. В приведенной ниже таблице 1 указаны некоторые из наиболее распространенных функциональных групп с названиями соответствующих классов органических соединений. Буквой «R» обозначен углеводородный радикал — остаток углеводорода без атома водорода. Атом водорода не является функциональной группой, он выделен в таблице для возможного включения в эту классификацию углеводородов, в структуре которых нет функциональных групп.
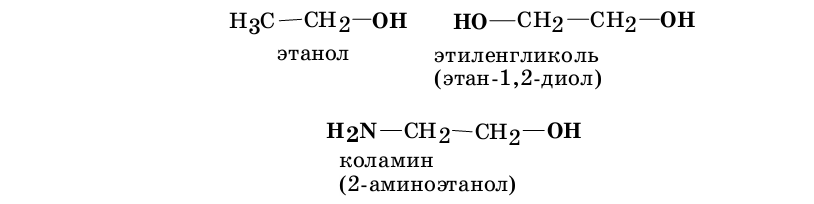
Если в соединении присутствует только одна функциональная группа, например, гидроксильная в молекуле этанола, его называют монофункциональным; если несколько одинаковых функциональных групп, например, две гидроксильные группы в молекуле этиленгликоля (этан 1,2диола) — полифункциональным; если же различные функциональные группы, например, аминная и гидроксильная в молекуле коламина, — гетерофункциональным.
Функциональные группы в составе органических соединений могут быть подвергнуты химической модификации и в результате трансформированы в какие-либо другие. За счет этого процесса оказываются возможными взаимные переходы между различными классами органических соединений, что часто происходит в процессе тканевого метаболизма у живых организмов и широко применяется при проведении искусственного органического синтеза. Например, окисление гидроксиметильной группы СН2ОН в молекуле этанола позволяет последовательно получить из него ацетальдегид и уксусную кислоту:
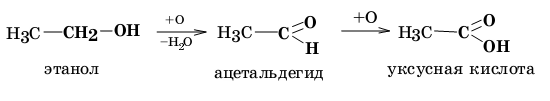
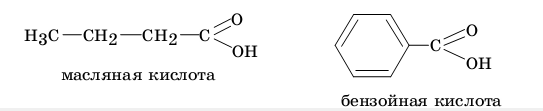
Нередко применительно к конкретному органическому соединению оба рассмотренных классификационных принципа сочетают. Например, масляную кислоту относят к монокарбоновым алифатическим насыщенным кислотам, бензойную кислоту — к ароматическим карбоновым кислотам.
Радикало-функциональная (рациональная) номенклатура. Примеры составления названий.
В соответствии с правилами этой номенклатуры органические соединения рассматриваются как результат замещения в соответствующих углеводородах атома водорода на соответствующую функциональную группу. То есть их представляют, как бы состоящим из углеводородного радикала и функциональной группы: К -Х.
Тривиальное название углеводородного радикала, связанного с функциональной группой, приводится в приставке, а название класса соединения в соответствии с природой функциональной группы — в корне:
Если функциональная группа двухвалентна и связана с двумя углеводородными радикалами, то названия углеводородных радикалов перечисляются в алфавитном по рядке:
При наличии двух функциональных групп их ранжируют по старшинству (см. табл. 2) и рассматривают соединение как результат замещения атома водорода в радикале «старшего» соединения на неглавную функциональную группу. При этом место замещения обычно обозначают буквами греческого алфавита для алифатических радикалов или приставками орто-, мета-, пара- для фенильных:
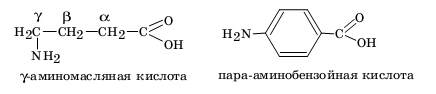
Аминогруппа:
связана с ароматическим кольцом. Имеется неподеленная электронная пара, поэтому амины проявляют свойства оснований.
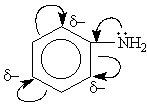
Нитрогруппа:
Плоская конфигурация, атомы N и O в sp2-гибридизации

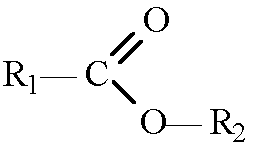
Сложно-эфирная:
При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры.
Галогенангидридная:
Производные кислот, в которых гидроксильные группы замещены атомами галогенов.
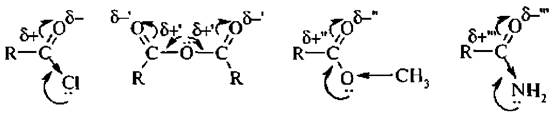
Амидная:
Производные кислот, в которых гидроксильные группы замещены на амино-группу.

Цианогруппа:
Цианиды-соли цианистоводородной кислоты
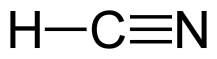
7.Делокализованная химическая связь. Сопряжение (π,π - р,π).
Если молекулярные электронные орбитали охватывают ядра более чем двух атомов, то это делокализованные связи. Такие связи присутствуют в сопряженных системах — молекулах, в которых имеет место чередование одинарных и двойных связей.
В сопряженных системах с открытой (незамкнутой) цепью всегда можно определить начало и конец цепи сопряжения.
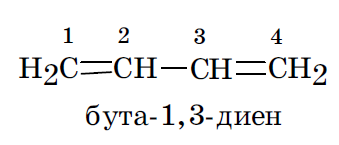
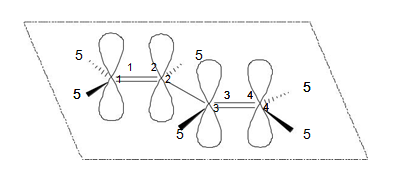
Перекрывание орбиталей происходит не только в положениях С1–С2 и С3–С4, как это следует из структурной формулы, но также и в положении С2–С3. В результате образуется единая делокализованная молекулярная орбиталь, охватывающая все 4 атома углерода молекулы. В этом и заключается суть явления сопряжения, т. е. сопряжение — это перекрывание негибридизованных электронов нескольких локализованных связей с образованием единой делокализованной многоцентровой молекулярной орбитали. Данный процесс выгоден в термодинамическом плане, поскольку он сопровождается уменьшением энергии молекулы и, следовательно, ее термодинамической стабилизацией. Степень снижения энергии молекулы в результате сопряжения называется энергией сопряжения. Величина этой энергии при прочих равных условиях тем больше, чем длиннее цепь сопряжения. Сопряжение сопровождается также и выравниванием межатомных расстояний: одинарные связи при этом укорачиваются, а двойные удлиняются по сравнению с их длиной в изолированном виде.
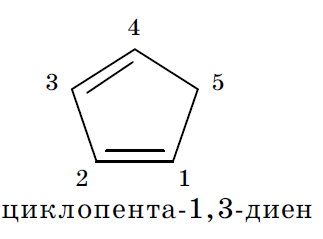
В рассмотренных молекулах бута 1,3 диена и цикло пента 1,3 диена имеет место, сопряжение, поскольку в процесс объединения вовлекаются электроны связей. Существует также и р, π сопряжение, при котором с электронами связей в сопряжение вовлекается электронная пара гетероатома, находящаяся на его негибридизованной pz орбитали.
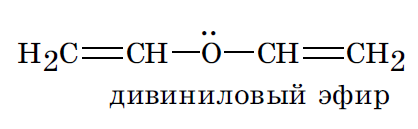
Возможно вовлечение в процесс сопряжения негибридизованных орбиталей заряженных атомов углерода в карбоанионах и карбокатионах, атомов углерода с неспаренным электроном в карборадикалах, что делает эти обычно нестабильные частицы относительно устойчивыми.
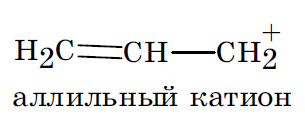
В сопряженных системах с замкнутой цепью сопряжения невозможно определить ни начало, ни конец цепи сопряжения. Круговая делокализация электронов по сравнению c таковой в рассмотренных ранее сопряженных системах с открытой цепью более выражена. Поэтому для замкнутых сопряженных систем характерны большая величина энергии сопряжения и, как следствие, более высокая термодинамическая стабильность по сравнению с таковыми у незамкнутых систем.
Их взаимное боковое перекрывание приводит к образованию единого делокализованного электронного облака, максимальная концентрация плотности которого оказывется сосредоточенной над и под плоскостью скелета молекулы (π, π сопряжение):
В ароматических гетероциклах может встречаться и р, π сопряжение, при котором с электронами π связей в объединение вовлекаются p электроны гетероатомов или p орбитали заряженных атомов углерода.
8. Ароматичность, ее критерии. Энергия резонанса (сопряжения) на примерах бензола, нафталина, гетероциклических соединений.
Ароматичность – это скопление максимальной концентрации плотности над и под плоскостью скелета молекулы, хоть и имеет ненасыщенный характер, чаще соединения вступают в реакции замещения, достаточно устойчивы к окислению. Критерии:
- плоский цикл (все атомы находятся в sp 2 гибридизованном состоянии);
-единая π электронная система
-количество электронов в сопряженной системе (N) соответствует формуле: N = 4 n + 2, где n — любое целое число (правило Хюккеля).
Степень снижения энергии молекулы в результате сопряжения называется энергией сопряжения. Величина этой энергии при прочих равных условиях тем больше, чем длиннее цепь сопряжения. Сопряжение сопровождается также и выравниванием межатомных расстояний: одинарные связи при этом укорачиваются, а двойные удлиняются по сравнению с их длиной в изолированном виде.

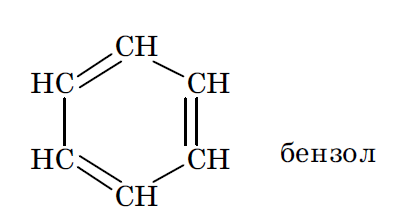
 N=6
N=6
Все атомы углерода циклогексатриенового цикла находятся в sp 2 гибридизованном состоянии, что обусловливает плоское строение скелета его молекулы. Негибридизованные pz орбитали всех шести атомов углерода расположены параллельно друг другу и перпендикулярно плоскости скелета. Их взаимное боковое перекрывание приводит к образованию единого делокализованного электронного облака, максимальная концентрация плотности которого оказывется сосредоточенной над и под плоскостью скелета молекулы (π,π сопряжение).
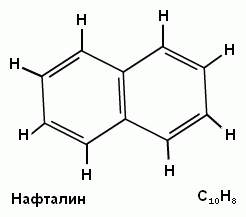 N=10
N=10 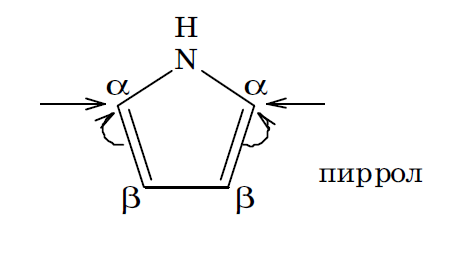
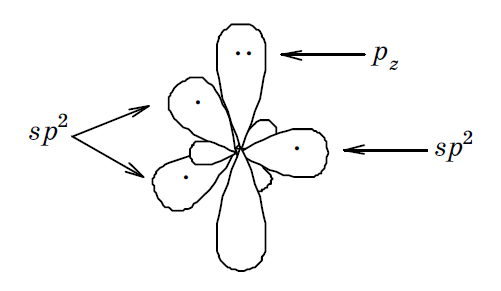
Атом азота этого пятичленного гетероцикла находится в sp 2 гибридизованном состоянии (sp 2 І): 1 s 2,2(sp 2) 3 2 pz 2.
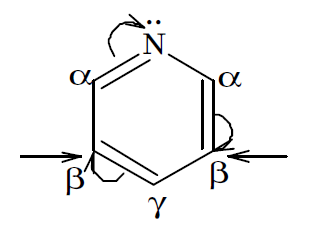
 пиридин
пиридин
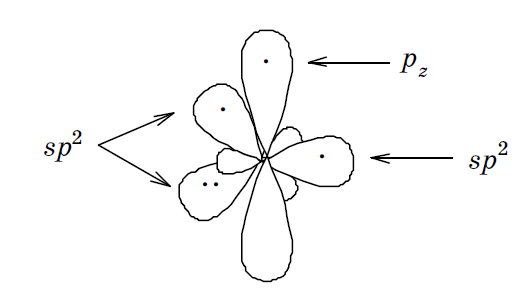
Находится в sp 2 гибридизованном состоянии, распределением электронов на орбиталях: (sp 2 ІІ): 1 s 2,2(sp 2) 4 2 pz 1. Поэтому по сравнению с молекулой бензола ароматическая шести электронная система пиридина является электронодефицитной. Вследствие этого реакции S Е с пиридином протекают труднее, чем с бензолом, требуют более жестких условий, присутствия катализаторов.
Взаимное влияние атомов в молекулах органических соединений и способы его передачи. Индуктивный и мезомерный эффекты. Примеры.
Все атомы, из которых построены молекулы любых органических соединений, оказывают друг на друга взаимное влияние. Например, этанол можно представить, как продукт замещения в этане одного из водородных атомов на гидроксильную группу –ОН.
Полученный в результате такой замены этанол обладает весьма разнообразной реакционной способностью и существенно отличается по своим химическим свойствам от инертного в химическом отношении этана. В то же время гидроксильная группа в этаноле по своим свойствам заметно отличается от фенольного гидроксила в молекуле фенола
Различия реакционной способности может быть реализовано электронным и стерическим путями. Электронный путь зависит от перераспределения электронной плотности в молекуле.
Электронная плотность в молекуле может располагаться в межъядерном пространстве на линии, соединяющей центры атомов (электроны σ связей) и вне этой линии (электроны π связей).
Электронные влияния заместителей в молекулах органических соединений могут быть реализованы посредством индуктивного и мезомерного эффектов.
Индуктивным (индукционным) эффектом называют перераспределение под действием заместителя электронной плотности в исходной молекуле вдоль оси σ связей.
Если связь образована атомами с одинаковой или очень близкой электроотрицательностью, то электроны ее ковалентной пары располагаются посередине между центрами этих атомов. В этом случае связь является неполярной. Таковыми являются, например, связи С–С и С–Н. Если же в образовании связи участвуют атомы с разной электроотрицательностью, то электронная плотность связи оказывается смещенной в сторону атома с большей электроотрицательностью. Такие связи называются полярными, поскольку на образующих их атомах возникают частичные заряды: + и – Качественно индуктивный эффект заместителей оценивают в сравнении с таковым у атома водорода.
Если заместитель притягивает к себе электроны слабее, чем это делает атом водорода, то считается, что он оказывает положительный индуктивный эффект (+I). В этом случае на замещенном атоме углерода возникает частичный отрицательный заряд –.
Если же заместитель по сравнению с атомом водорода притягивает к себе электроны сильнее, то считается, что он оказывает отрицательный индуктивный эффект (–I).
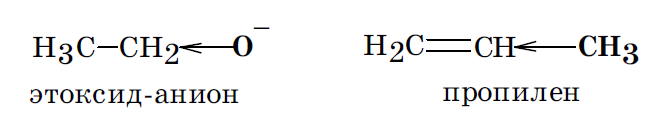
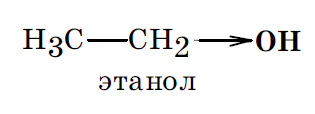
Мезомерный эффект (эффект сопряжения (С) или эффект резонанса (R)) — это перераспределение под действием заместителя электронной плотности в области π связей исходной молекулы.
Такой эффект могут оказывать лишь заместители, в структуре которых имеются либо р-, π- либо электроны на негибридизованных p орбиталях. Например, π-электроны присутствуют в заместителях, содержащих кратные связи (альдегидная, карбоксильные группы).
Неподеленную пару р электронов имеют в своем составе атомы галогенов (–Cl, –F, –Br, –I), гетероатомы в функциональных группах –ОН, –SH, –NH2.
После внедрения заместителя его р или π электроны должны быть вовлечены в сопряжение с π электронами исходной молекулы.
Если после внедрения заместителя электронная плотность связей исходной молекулы увеличивается, то считают, что заместитель оказывает положительный мезомерный эффект (+М). Такой эффект характерен для ОН, SH, NH2 группы, галогены.
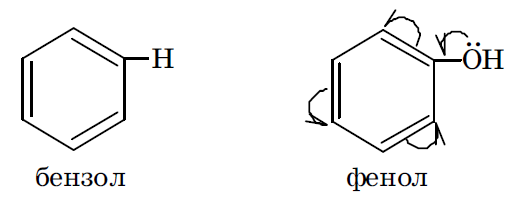

Если же электронная плотность π связей исходной молекулы под действием введенного в нее заместителя снижается, то считается, что заместитель оказывает отрицательный мезомерный эффект (–М). Такой эффект характерен для заместителей, имеющих в своем составе кратные связи, в образовании которых участвуют гетеро атомы с электроотрицательностью большей, чем у атома углерода. Например, это имеет место в карбоксильной, альдегидной, нитрильной группах.
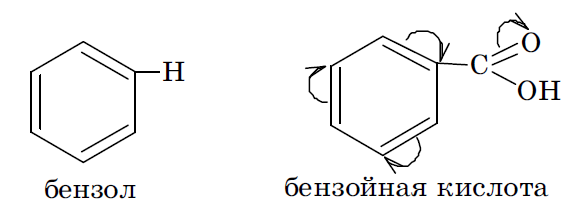
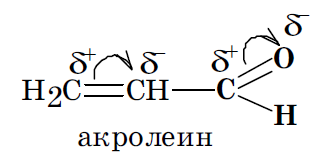
10. Электронодонорные и электроноакцепторные заместители.
В зависимости от интегрального изменения электронной плотности в молекуле, вызываемого введением заместителя, заместители принято делить на электронодонорные (ЭД) и электроноакцепторные (ЭА). Один и тот же заместитель в молекулах различных соединений может быть и электронодонорным, и электроноакцепторным. Это определяется характером оказываемых им электронных эффектов, соотношением их величины и возможностью их реализации в данной молекуле. Заместители, содержащие кратные связи и гетероатомы с большей, чем у водорода, электроотрицательностью (карбоксильная, карбонильная, нитрильная группы, сульфогруппа, нитрогруппа, у которых –I и –М), а также галогены, у которых –I > +M, во всех случаях являются электроноакцепторными заместителями. Гидроксильная же группа –ОН и аминогруппа –NН2 могут оказывать +М и –I эффекты, при этом +М > –I. Поэтому в зависимости от возможности реализации только индуктивного или же совместно индуктивного и мезомерного эффектов эти группы могут быть как электроноакцепторными, так и электронодонорными заместителями. Это определяется как строением исходной молекулы, так и местом внедрения такого заместителя.
Например, в феноле гидроксильная группа, оказывая оба эти эффекта, является электронодонорным заместителем, увеличивающим суммарную электронную плотность в ароматическом кольце. В молекуле же этанола гидроксильная группа может оказать только –I эффект (проявление мезомерного эффекта невозможно) и, следовательно, является электроноакцепторным заместителем.
Замещая в молекуле толуола различные атомы водорода на гидроксильную группу, можно получить бензиловый спирт и о- крезол:
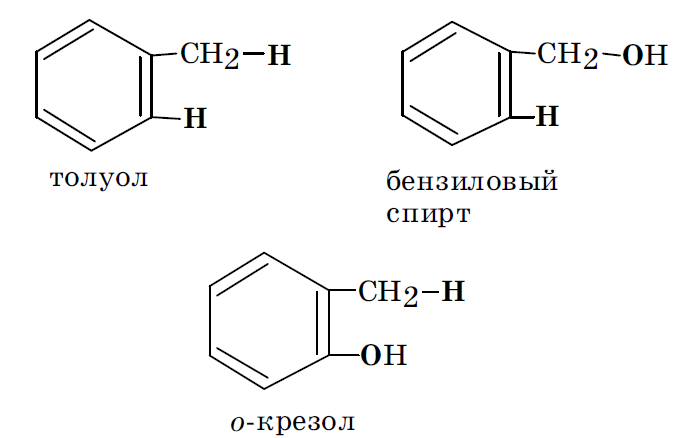
В бензиловом спирте ОН группа может реализовать только –I эффект и, следовательно, является электроноакцепторным заместителем. В о-крезоле эта же группа реализует и –I и +М эффекты. Поскольку у гидроксила +М > –I, он в данном случае будет являться электронодонорным заместителем
Пространственное строение органических соединений: конфигурация, конформация, способы их графического изображения. Примеры.
Пространственное расположение заместителей у атома углерода называется его конфигурацией. Например, у метана СН4 в одной плоскости могут быть расположены только 2 из 4 имеющихся в молекуле сигма связей.
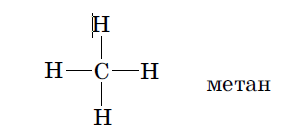
Такие связи при графическом изображении конфигурации принято обозначать валентными штрихами «—». Те связи, которые не лежат в плоскости чертежа и как бы уходят за нее от наблюдателя, изображаются заштрихованным треугольником: « », а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: «
», а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: «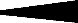 ». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом:
». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом: 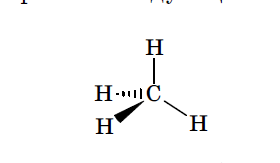
Вокруг одинарных сигма связей, обладающих цилиндрической (осевой) симметрией, возможно вращение атомов углерода. В результате этого заместители, имеющиеся у этих атомов, в пространстве могут занимать относительно друг друга различное положение, и молекула может приобретать различные варианты пространственного строения, которые в органической химии принято называть конформациями (конформерами, поворотными стереоизомерами). Для графического изображения конформаций какого-либо соединения обычно пользуются проекциями Ньюмена. При этом в соединении выбирают С–С связь, по оси которой происходит вращение остальных частей молекулы. Мысленно ось этой связи располагают перпендикулярно плоскости чертежа (наблюдатель смотрит как бы в торец этой связи). Ближний к наблюдателю атом углерода изображают точкой с отходящими от нее под равными углами 120 град. тремя лучами (связями):
Дальний атом изображается в виде окружности, от которой также отходят три луча под углом 120 град. друг к другу:
Изображения двух этих атомов углерода накладываются друг на друга, в результате чего и получается проекция Ньюмена:
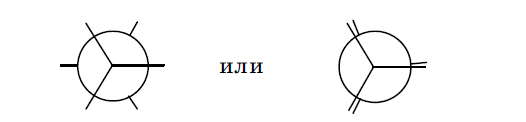
При наличии объемных заместителей у каждого из вращающихся атомов углерода возможно существование ряда скошенных конформаций (Гош-конформаций) и частично заслоненных конформаций, например, в молекулах 1-бромпропана (вращение атомов С1 и С2) и н -бутана (вращение атомов С2 и С3):
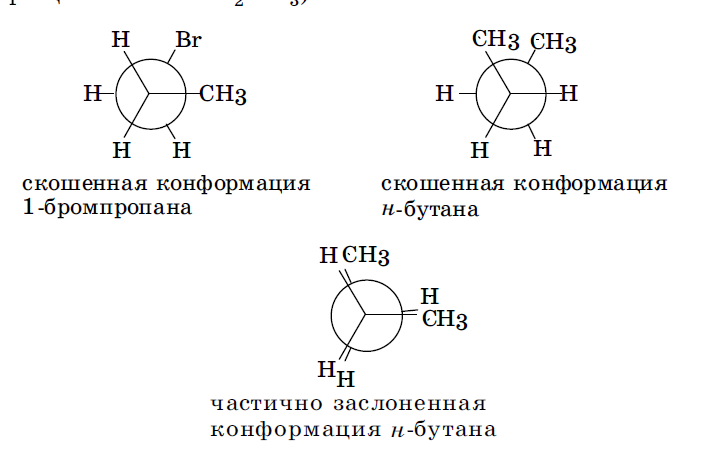
Заслоненная конформация обладает наибольшей потенциальной энергией и поэтому наименьшей термодинамической устойчивостью. Причина заключается во взаимном отталкивании электронов противолежащих ковалентных связей и возникновении вследствие этого в молекуле торсионного (вращательного) напряжения. Это напряжение может быть обусловлено также и взаимным отталкиванием близко расположенных объемных заместителей у соседних атомов углерода. В заторможенной конформации электроны противолежащих связей и объемные заместители (если имеются) максимально удалены друг от друга, молекула обладает наименьшей свободной энергией и, как следствие, наибольшей термодинамической устойчивостью. Скошенные и частично заслоненные конформации обладают промежуточными значениями свободной энергии и термодиначеской устойчивости. В результате подобного вращения соседних атомов углерода длинные незамкнутые цепи углеродных атомов могут приобретать различные пространственные формы. Среди множества возможных конформаций таких цепей наиболее стабильной является зигзагообразная. В этой конформации у всех соседних атомов углерода заместите ли (или атомы водорода) располагаются так же, как и в заторможенной конформации этана. 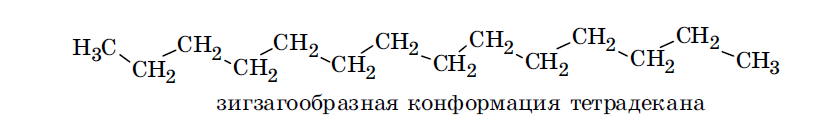
Выделяют также нерегулярную и клешневидную (термодинамически наименее выгодную) конформации. Для некоторых гетерофункциональных соединений в результате клешневидной конформации их углеродного скелета возможно пространственное сближение и взаимодействие этих групп с образованием новой связи и замыканием цикла, что в конечном итоге приводит к термодинамической стабилизации молекулы.
Конформации циклогексана.
Из разных конформаций, принимаемых молекулой циклогексана, наиболее устойчивой является конформация кресла. Конформация кресла наиболее симметрична, каждый атом углерода имеет по две неэквивалентные связи С—Н. Связи, расположенные параллельно вертикальной оси симметрии третьего порядка, называют аксиальными (а), а связи, ориентированные под утлом 109,5° относительно упомянутой оси, называют экваториальными (е). В процессе конформационных превращений аксиальные заместители становятся экваториальными и соответственно экваториальные — аксиальными. С этой точки зрения конформационные переходы циклогексана называются инверсией.
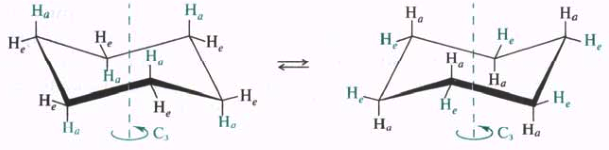
Молекулы монозамещеиных циклогексанов в процессе конформационных превращений могут принимать две неэквивалентные конформации кресла с аксиальным (аксиальный конформер) или экваториальным (экваториальный конформер) положением заместителя. Термодинамически более выгоден экваториальный конформер. Причина относительной неустойчивости аксиальной конформации метил циклогексана заключается в 1,3-диаксиальном взаимодействии (разновидность ван-дер-ваальсова напряжения) метильной группы и аксиальных атомов водорода в положениях 3 и 5 циклогексанового кольца, при этом происходит взаимное отталкивание метильной группы и атомов водорода.
Еще одной причиной, обусловливающей предпочтительное нахождение объемных заместителей в экваториальном положении, является то, что аксиальная метильная группа находится в скошенном положении относительно группы СН2 алицикла, и в этом случае также возникает ван-дер-ваальсово напряжение:
Торсионное напряжение (напряжение Питцера) вызвано электростатическим взаимодействием противостоящих связей.
Напряжение Ван-дер-Ваальса, возникающее при расположении заместителей на расстоянии, приблизительно равном сумме их ван-дер-ваальсовых радиусов.
Угловое напряжение (напряжение Байера),вызванное отклонением валентного угла в цикле от нормального угла для данного валентного состояния.
17. Кислотные и основные свойства органических соединений. Теории Бренстеда-Лоури и Льюиса. Примеры.
в 1923 г. датчанин Й. Бренстед и англичанин Т. Лоури независимо друг от друга для описания кислотно-основных свойств соединений предложили более общую протонную теорию, согласно которой кислотно-основные взаимодействия рассматривались как результат межмолекулярного переноса протона. При этом кислотами А (Acid) были названы соединения, способные при таком взаимодействии отщеплять протон: 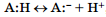 , а основаниями — В: (Base) — соединения, способные присоединять протон:
, а основаниями — В: (Base) — соединения, способные присоединять протон: 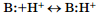 Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию:
Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию: 
При этом кислота, отдав протон, приобретает способность к его присоединению и превращается в сопряженное с ней основание А:–, а основание, присоединив протон, становится способным его отдавать и превращается в сопряженную с ним кислоту В:Н+. Таким образом, кислотные свойства вещество может проявить только в присутствии оснований, и наоборот, т. е. эти понятия являются относительными.
Этот равновесный процесс может быть количественно охарактеризован с помощью константы равновесия Kр: 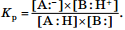 Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:
Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:  Для данного взаимодействия константа равновесия рассчитывается по формуле
Для данного взаимодействия константа равновесия рассчитывается по формуле
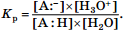
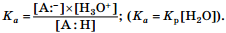
Для органических соединений эта константа оказалась очень маленькой величиной, и на практике было предложено пользоваться ее отрицательным десятичным логарифмом: рKа = –lgKа. Чем меньше значение рKа, тем сильнее кислота, и наоборот. Как правило, при прочих равных условиях (температура, природа растворителя) кислотность органического соединения определяется стабильностью аниона, образующегося из него после отщепления протона (стабильностью сопряженного основания): чем стабильнее анион, тем сильнее кислота.
Американский химик Г. Н. Льюис для описания подобных взаимодействий предложил апротонную теорию, в соответствии с которой кислотно-основные свойства соединений определяются их способностью принимать или отдавать электронную пару при образовании новой ковалентной связи. В соответствии с этой теорией кислотами (А) называют соединения, способные присоединять электронную пару (акцепторы электронной пары), основаниями (В) — соединения, способные отдавать электронную пару (доноры электронной пары). 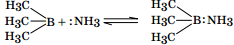
Триметилбор в приведенной выше реакции является кислотой Льюиса, аммиак — основанием. Поэтому все химические реакции, сопровождающиеся переносом протона, также являются кислотно-основными взаимодействиями в соответствии с теорией Льюиса. Недостатком теории Льюиса является невозможность точной количественной оценки выраженности кислотно-основных свойств соединений. В определенной мере этот недостаток был устранен американским химиком Р. Пирсоном, который предложил все кислоты и основания Льюиса разделить на «мягкие» и «жесткие». Принцип Пирсона оценивает лишь конкретные кислотно-основные взаимодействия с образованием донорно-акцепторной связи. Жесткие кислоты более энергично, с образованием более прочных связей реагируют с жесткими основаниями, мягкие кислоты — с мягкими основаниями. Степень жесткости или же мягкости органических оснований определяют по реакции СН3Hg+ + BH CH3HgB + H+ Если ее константа равновесия > 1, то основание В мягкое, если < 1, то жесткое. Донорные атомы жестких оснований имеют высокую электроотрицательность и низкую поляризуемость, вследствие чего с трудом отдают свои электроны для образования донорно-акцепторных связей (вследствие этого они трудно окисляются, легко образуют водородные связи). К жестким основаниям относятся Н2О, ОН–, ROH, RO–, R2O, NH3, RNH2, F–, Cl–. Наиболее жестким основанием является гидроксильный анион ОН–. В мягких основаниях донорные атомы, напротив, характеризуются низкой электроотрицательностью и легко поляризуются (они также легко окисляются). Мягкими основаниями являются I–, R2S, RSH, CN–, H–, R–. В жестких кислотах акцепторные атомы имеют высокую электроотрицательность, трудно поляризуются, часто несут положительный заряд. Например, Н+, Li+, Na+, K+, BF3, AlCl3, HHal. Наиболее жесткой кислотой Льюиса является протон Н+. В мягких кислотах акцепторные атомы имеют низкую электроотрицательность и легко поляризуются, обычно имеют большой объем. Примером могут являться I2, Br2, CH3Hg+. Значение теории Льюиса состоит в том, что она позволяет предположить наиболее вероятный исход взаимодействия двух соединений при возможности альтернативного течения реакции.
Принцип масс-спектрометрического исследования. Основные типы фрагментации молекулы; виды ионов (молекулярные, осколочные, перегруппировочные), возникающих при фрагментации; устойчивость ионов; масс-спектральные серии. Примеры.
Масс-спектрометрия - метод исследования вещества путём определения отношения массы к заряду (качества) и количества заряженных частиц, образующихся при том или ином процессе воздействия на вещество. Идея метода проста: 1. Превратить нейтральные частицы – атомы или молекулы в частицы заряженные – ионы. 2. Разделить образовавшиеся ионы в пространстве в соответствии с их массой посредством электрического или магнитного поля. 3. Измеряя электрический ток, образуемый направленно движущимися ионами, можно судить об изотопном, атомарном и молекулярном составе анализируемого вещества, как на качественном, так и на количественном уровне.
Молекулярные ионы – ионы, масса которых равна массе ионизируемой молекулы. Вероятность образования молекулярного иона больше для простых, малых молекул. Повышение температуры образца перед ионизацией может изменить масс-спектр в связи с повышением внутренней энергии молекулярного иона, способного к фрагментации. Например, ионизация алифатических соединений при разных температурах дает разные масс-спектры. С повышением температуры образца уменьшается интенсивность пика молекулярного иона. Однако для ароматических соединений этот эффект мал.
Осколочные ионы. Молекулярные ионы в зависимости от избытка внутренней энергии находятся в различных возбужденных состояниях, что обуславливает различное время их фрагментации или диссоциации. При этом молекулярные ионы превращаются в осколочные (фрагментные) ионы с более низкой электронной энергией. Нетрудно представить, что энергия появления молекулярного иона есть не что иное, как энергия ионизации молекулы. При распаде молекулярного иона, который является нечетно-электронной частицей, образуется фрагментный ион и нейтральная частица, которая может быть как четно-электронной, так и нечетно-электронной, т.е. радикалом типа H•, •CH3, и т.д. При отщеплении нейтральной частицы возникает новый нечетно-электронный ион-радикал: М+• → [Ф1]+• + N, а при выбросе радикала - четно-электронный ион: М+• → [Ф2]+ + N•. Дальнейшие направления распада этих ионов различны.
Перегруппировочные ионы обычно представляют собой ионы-радикалы или нечетно-электронные ионы. Их массовое число часто численно равно молекулярной массе нейтральной молекулы, поэтому их иногда называют псевдомолекулярными ионами. Они получаются в результате внутримолекулярной атомной перегруппировки в процессе фрагментации. Особенно широко распространены перегруппировки, включающие миграцию атомов водорода в молекулах, содержащих гетероатом. Эти ионы возникают в результате изменения расположения связей между атомами перед диссоциацией иона.
Функциональная группа и строение углеродного скелета как классификационные признаки органических соединений.
Функциональной группой называют заместитель не углеводородной природы (следовательно, в его составе обязательно должен присутствовать гетероатом), определяющий принадлежность соединения к конкретному классу и одновременно его типичные химические свойства. В приведенной ниже таблице 1 указаны некоторые из наиболее распространенных функциональных групп с названиями соответствующих классов органических соединений. Буквой «R» обозначен углеводородный радикал — остаток углеводорода без атома водорода. Атом водорода не является функциональной группой, он выделен в таблице для возможного включения в эту классификацию углеводородов, в структуре которых нет функциональных групп.
Если в соединении присутствует только одна функциональная группа, например, гидроксильная в молекуле этанола, его называют монофункциональным; если несколько одинаковых функциональных групп, например, две гидроксильные группы в молекуле этиленгликоля (этан 1,2диола) — полифункциональным; если же различные функциональные группы, например, аминная и гидроксильная в молекуле коламина, — гетерофункциональным.

Функциональные группы в составе органических соединений могут быть подвергнуты химической модификации и в результате трансформированы в какие-либо другие. За счет этого процесса оказываются возможными взаимные переходы между различными классами органических соединений, что часто происходит в процессе тканевого метаболизма у живых организмов и широко применяется при проведении искусственного органического синтеза. Например, окисление гидроксиметильной группы СН2ОН в молекуле этанола позволяет последовательно получить из него ацетальдегид и уксусную кислоту:
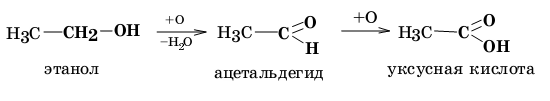
Нередко применительно к конкретному органическому соединению оба рассмотренных классификационных принципа сочетают. Например, масляную кислоту относят к монокарбоновым алифатическим насыщенным кислотам, бензойную кислоту — к ароматическим карбоновым кислотам.





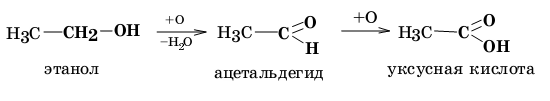

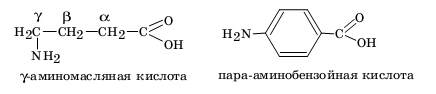
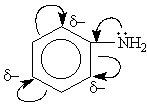



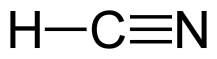
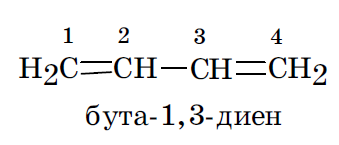


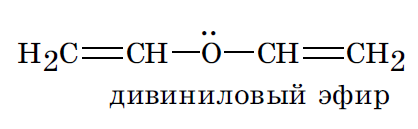
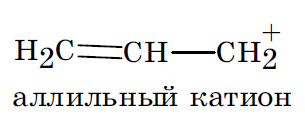

 N=6
N=6  N=10
N=10 


 пиридин
пиридин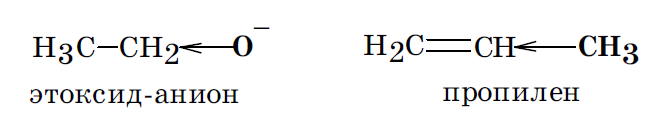



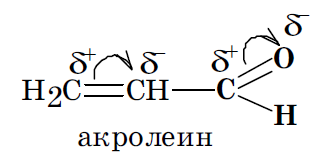


 », а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: «
», а связи, которые выходят из плоскости к наблюдателю, закрашенным треугольником: « ». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом:
». С учетом изложенных правил конфигурацию sp 3 гибридизованного атома углерода в молекуле метана можно изобразить следующим образом: 
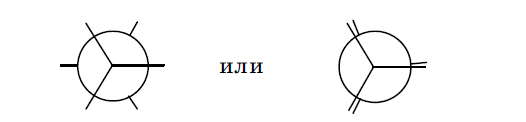

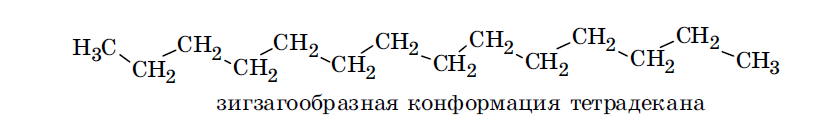

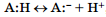 , а основаниями — В: (Base) — соединения, способные присоединять протон:
, а основаниями — В: (Base) — соединения, способные присоединять протон: 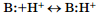 Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию:
Выраженность этих свойств были названы соответственно кислотностью и основностью. Такое определение оказалось применимо не только к водным, но и к неводным растворам. При взаимодействии кислоты и основания происходит перенос протона от кислоты к основанию: 
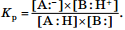 Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:
Очевидно, что по отношению к различным основаниям кислотные свойства одного и того же соединения будут проявляться по-разному. Поэтому для стандартизации условий оценки кислотных свойств соединений в качестве основания было предложено взять воду, т. е. количественно оценивать взаимодействие:  Для данного взаимодействия константа равновесия рассчитывается по формуле
Для данного взаимодействия константа равновесия рассчитывается по формуле