

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Их устранения
Осадок, образующийся в процессе гравиметрического определения, всегда содержит то или иное количество посторонних примесей. Примеси могут попадать в осадок по различным причинам. Вид примесей, загрязняющих осадок, и их количество зависят от условий выполнения анализа и характера образующегося осадка.
Загрязнение осадка веществами (посторонними примесями), которые в условиях осаждения должны полностью оставаться в растворе, называется соосаждением. К явлениям соосаждения относят также переход в осадок сравнительно малорастворимых веществ, находящихся в растворе в таких малых концентрациях, при которых ПК соответствующих соосаждающихся ионов значительно меньше ПР. Иными словами в отсутствии основного осадка эти вещества должны были бы оставаться в растворе. Например, малые количества Sr2+ в растворе при добавлении SO42- ионов могут не образовать твердой фазы вследствие того, что [Sr2+]·[ SO42-] ≤ ПР (SrSO4). Тем не менее они захватываются осадком BaSO4 и соосаждаются.
Соосаждение происходит в процессе образования осадка, но не после его образования. Так, осаждая BaSO4 из раствора, содержащие ионы MnO4-, получают осадок розового или фиолетового цвета из-за соосаждения этих ионов. Однако если взять готовый препарат BaSO4 и взбалтывать его с раствором KMnO4, то соосаждение не происходит, осадок остается неокрашенным.
Примеры соосаждения
1. При осаждении BaSO4 осадок захватывает некоторые количества Ba(NO3)2, хотя последнее соединение достаточно хорошо растворимо.
2. Ионы Fe3+ от ионов Cu2+ отделяют аммиаком. Cu2+ образуют хорошо растворимый аммиакат ([Cu(NH3)4]2+, тем не менее осадок Fe(OH)3 содержит значительные количества ионов Cu2+.
|
|
3. Малорастворимая кремневая кислота (H2SiO3 или SiO2·nH2O) захватывает из раствора HCl примеси полуторных оксидов Fe3+, Al3+, Ti4+. Между тем эти элементы в кислых растворах не должны были бы переходить в осадок.
Соосаждение следует отличить от совместного осаждения, когда оба вещества малорастворимы и при данных условиях должны образовывать твердую фазу независимо от того, находятся ли они в растворе вместе или порознь. Совместное осаждение сульфатов Sr2+ и Ba2+ не является соосаждением, если произведение концентраций (ПК) обоих ионов на концентрацию SO42- превосходит соответствующие значения ПР. То есть [Sr2+]·[ SO42-] > ПР (SrSO4) и [Ba2+]·[ SO42-] > ПР (BaSO4).
Различают следующие виды соосаждения:
I. А дсорбция ионов на поверхности осадка – это соосаждение примесей на поверхности осадка; особенно значительна для амфорных осадков, отличающихся сильно развитой общей поверхностью. Адсорбированные ионы удерживаются прочно и не отмываются водой, требуется переосаждение.
При соосаждении различают микрокомпонент – вещество, находящееся в растворе в очень незначительной концентрации и переходящее вследствие соосаждения в твердую фазу и макрокомпонент – вещество, из которого состоит твердая фаза и количество которого значительно превышает количество микрокомпонента. На поверхности макрокомпонента происходит соосаждение или адсорбция микрокомпонента. Поэтому адсорбция – соосаждение микрокомпонента на поверхности твердой фазы макрокомпонента.
Адсорбция вещества на поверхности осадка определяется многими факторами (или факторы, влияющие на адсорбционное равновесие, так как адсорбция – процесс обратимый):
1. Количество адсорбированного вещества зависит от общей поверхности осадка (от величины поверхности адсорбента): чем эта поверхность больше, тем больше адсорбция.
2. Количество адсорбированного вещества зависит от его концентрации в растворе, возрастая не прямо пропорционально этой концентрации. Зависимость описывается изотермой адсорбции (рис. 5):
|
|
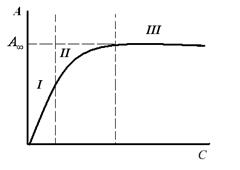

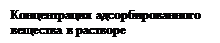
Рис. 5. Изотерма адсорбции.
3. Влияние температурного фактора. Адсорбция – процесс экзотермический. При увеличении температуры происходит уменьшение адсорбции, а при уменьшении температуры – увеличение адсорбции.
4. Адсорбция характеризуется ярко выраженной избирательностью
Вопрос номер 10
|
|
|

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!