Фосфолипи́ды — сложные липиды, сложные эфиры многоатомных спиртов и высших жирных кислот. Содержат остаток фосфорной кислоты и соединённую с ней добавочную группу атомов различной химической природы.
фосфолипиды на три группы:глицерофосфолипиды (глицерофосфатиды) — содержат остаток глицерина ( фосфатидилхолин (лецитин), фосфатидилэтаноламин (кефалин), фосфатидилсерин, кардиолипин, плазмалоген (этаноламиновый плазмологен).
фосфосфинголипиды — содержат остаток сфингозина ( сфингомиелины)
фосфоинозитиды — содержат остаток инозитола ( фосфатидилинозитол)
Фосфолипиды входят в состав всех клеточных мембран. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Наиболее распространённая группа фосфолипидов — фосфоглицериды. К фосфолипидам также относятся фосфосфинголипиды и фосфоинозитиды.Фосфолипиды — амфифильные вещества. Они состоят из полярной «головки», в состав которой входит глицерин или другой многоатомный спирт, отрицательно заряженный остаток фосфорной кислоты и часто несущая положительный заряд группа атомов, и двух неполярных «хвостов» из остатков жирных кислот. Главная особенность фосфолипидов состоит в том, что «головка» у них гидрофильна, а «хвосты» гидрофобны. Это позволяет при нахождении в толще водной среды образовывать бислой — двойной слой фосфолипидных молекул, где гидрофильные головы с обеих сторон соприкасаются с водой, а гидрофобные хвосты упрятаны внутрь бислоя и тем самым защищены от контакта с водой.Это определяет многие физические и химические свойства фосфолипидов, например, способность формировать липосомы и биологические мембраны (липидный бислой). Химическая структура полярной «головки» определяет суммарный электрический заряд и ионное состояние фосфолипида. «Хвосты» контактируют с липидным окружением, а «головки» — с водным, так как неполярные жирные хвосты не могут соприкасаться с водой.
Фосфолипиды являются важной частью клеточных мембран. Они обеспечивают текучие и пластические свойства мембран клеток и клеточных органеллами, в то время как холестерин обеспечивает жёсткость и стабильность мембран. Как фосфолипиды, так и холестерин часто входят в состав липопротеидов клеточных мембран, но имеются в мембранах и в свободном, не связанном с белками состоянии. Соотношение холестерин/фосфолипиды в основном и определяет текучесть либо жёсткость клеточной мембраны.
Фосфолипиды участвуют в транспорте жиров, жирных кислот и холестерина. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Будучи более гидрофильными, чем холестерин, благодаря наличию в молекуле остатков фосфорной кислоты, фосфолипиды являются своеобразными «растворителями» для холестерина и других высоко гидрофобных соединений. Соотношение холестерин/фосфолипиды в составе липопротеидов плазмы крови наряду с молекулярным весом липопротеидов (ЛПВП, ЛПНП или ЛПОНП) предопределяет степень растворимости холестерина и его атерогенные свойства. Соотношение холестерин/фосфолипиды в составе желчи предопределяет степень литогенности желчи — степень склонности к выпадению холестериновых желчных камней.Фосфолипиды замедляют синтез коллагена и повышают активность коллагеназы (фермента, разрушающего коллаген).Производные фосфолипидов инозитол 1,4,5-трифосфат и диацилглицерол — важнейшие внутриклеточные вторичные мессенджеры. Гликолипиды —сложные липиды, образующиеся в результате соединения липидов с углеводами. В молекулах гликолипидов есть полярные «головы» (углевод) и неполярные «хвосты» (остатки жирных кислот). Благодаря этому гликолипиды (вместе с фосфолипидами) входят в состав клеточных мембран.Гликолипиды широко представлены в тканях, особенно в нервной ткани, в частности в ткани мозга. Они локализованы преимущественно на наружной поверхности плазматической мембраны, где их углеводные компоненты входят в число других углеводов клеточной поверхности. Стерины, стеролы (от холестерин, -ол) — природные органические соединения, производные стероидов, содержащие гидроксильную группу в положении 3[1]. В основе структуры стеринов лежит насыщенный тетрациклический углеводород стеран.По источникам получения стерины можно разделить на:зоостерины (из животных), фитостерины (из растений), микостерины (из грибов)Большинство стеринов — кристаллические вещества, растворимые в органических растворителях и нерастворимые в воде.Для человека представляет большую диетическую опасность группа оксипроизводных стеринов, играющих одну из ключевых ролей в патогенезе атеросклероза. Критическим фактором в проявлении заболевания является развитие процесса накопления холестерина в интиме сосудов, который зависит от соотношения поступления стерола в сосудистую стенку и его обратного выхода в плазму крови. Холестери́н (др.-греч. χολή — жёлчь и στερεός — твёрдый) — органическое соединение, природный полициклический липофильный спирт, содержащийся в клеточных мембранах всех животных и человека, однако его нет в клеточных мембранах растений, грибов, а также у прокариотических организмов (археи, бактерии итд.).Холестерин нерастворим в воде, растворим в жирах и органических растворителях. Около 80 % холестерина вырабатывается самим организмом человека: (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20 % поступают с пищей[1].Холестерин обеспечивает устойчивость клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов (включая кортизол, альдостерон, половые гормоны: эстрогены, прогестерон, тестостерон), жёлчных кислот[2]. Жёлчные кисло́ты — монокарбоновые гидроксикислоты из класса стероидов. Синонимы: холевые кислоты, холиевые кислоты, холеновые кислоты. Жёлчные кислоты — производные холановой кислоты С23Н39СООН, отличающиеся тем, что к её кольцевой структуре присоединены гидроксильные группы.Основными типами жёлчных кислот, имеющимися в организме человека, являются так называемые первичные жёлчные кислоты (первично секретируемые печенью): холевая кислота (3α, 7α, 12α-триокси-5β-холановая кислота) и хенодезоксихолевая кислота (3α, 7α-диокси-5β-холановая кислота), а также вторичные (образуются из первичных жёлчных кислот в толстой кишке под действием кишечной микрофлоры): дезоксихолевая кислота (3α, 12α-диокси-5β-холановая кислота), литохолевая (3α-моноокси-5β-холановая кислота), аллохолевая и урсодезоксихолевая (3α, 7β-диокси-5β-холановая кислота) кислоты. Из вторичных в кишечно-печёночной циркуляции во влияющем на физиологию количестве участвует только дезоксихолевая кислота, всасываемая в кровь и секретируемая затем печенью в составе жёлчи.Аллохолевая и урсодезоксихолевая кислоты являются стереоизомерами холевой и дезоксихолевой кислот.Все жёлчные кислоты человека имеют в составе своих молекул 24 атома углерода.В жёлчи жёлчного пузыря человека жёлчные кислоты представлены так называемыми парными кислотами: гликохолевой, гликодезоксихолевой, гликохенодезоксихолевой, таурохолевой, тауродезоксихолевой и таурохенодезоксихолевой кислотой — соединениями (конъюгатами) холевой, дезоксихолевой и хенодезоксихолевой кислот с глицином и таурином.[1][2][3]Молекулы большинства жёлчных кислот включают 24 атома углерода. Однако встречаются жёлчные кислоты, молекулы которых имеют 27 или 28 атомов углерода. Структура доминирующих жёлчных кислот у различных видов животных отличается. В жёлчных кислотах млекопитающих характерно наличие в молекуле 24 атомов углерода, у некоторых земноводных — 27 атомов.Холевая кислота имеется в жёлчи козы и антилопы (и человека), β-фокохолевая — у тюленя и моржа, нутрихолевая — у бобра, аллохолевая — у леопарда, битохолевая — у змеи, α-мурихолевая и β-мурихолевая — у крысы, гиохолевая и β-гиодезоксихолевая — у свиньи, α-гиодезоксихолевая — у свиньи и кабана, дезоксихолевая — у быка, оленя, собаки, овцы, козы и кролика (и человека), хенодезоксихолевая — у гуся, быка, оленя, собаки, овц-ы, козы и кролика (и человека), буфодезокихолевая — у жабы, α-лагодезоксихолевая — у кролика, литохолевая — у кролика и быка (и человека).[4]
Классификация ферментов и ее принципы. Оксидоредуктазы, важнейшие представители. Трансферазы, важнейшие представители. Гидролазы, важнейшие представители, распространение в природе, значение в пищевой технологии. Лиазы, важнейшие представители. Изомеразы, важнейшие представители. Лигазы, важнейшие представители. Регуляция активности и синтез ферментов. Аллостерические ферменты. Изоферменты. Мультиферментные системы.
Современная номенклатура ферментов допускает старые тривиальные названия (папаин, пепсин, трипсин, цитохромы) и названия по рациональной номенклатуре, согласно которой название фермента составляется из названия субстрата и окончания –аза (амилаза, липаза, протеаза). По научной номенклатуре название фермента составляют из химического названия субстрата, акцептора и названия той реакции, которая осуществляется ферментом, например, L-аланин:2-оксоглутарат аминотрансфераза.Существует Международная классификация ферментов. Согласно ей все ферменты включены в «Каталог ферментов» под своим классификационным номером, состоящим из четырех цифр. Первая цифра указывает на принадлежность к одному из шести главных классов. Следующие две определяют подкласс и подподкласс, а последняя цифра – номер фермента в данном подподклассе. Например, лактатдегидрогеназа имеет номер КФ 1.1.1.27.
В основу классификации ферментов положен тип реакций, подвергающихся каталитическому воздействию. Классы ферментов:Оксидоредуктазы – катализируют окислительно-восстановительные реакции.Трансферазы – переносят ту или иную функциональную группу от одного субстрата на другой.Гидролазы – также участвуют в переносе групп, однако акцептором всегда является молекула воды.Лиазы (синтазы) – катализируют расщепление или образование химических соединений или образование химических связей, при этом образуются или исчезают двойные связи.Изомеразы – перемещают группы в пределах одной молекулы.Лигазы (синтетазы) – катализируют энергозависимые реакции присоединения и поэтому их действие сопряжено с гидролизом АТФ.
Оксидоредуктазы катализируют реакции, имеющие общий вид:BH2 + A ↔ B + AH2Характерной особенностью деятельности оксидоредуктаз в клетке является их способность образовывать системы окислительно-восстановительных ферментов, в которых осуществляется многоступенчатый перенос атомов водорода от первичного субстрата к конечному акцептору, обычно кислороду, с образованием воды.Оксидоредуктазы, которые переносят протоны и электроны непосредственно на кислород, называются аэробными дегидрогеназами или оксидазами. Оксидоредуктазы, переносящие протоны и электроны от одного компонента окислительной цепи к другому без передачи на кислород, называются анаэробными дегидрогеназами или редуктазами.Если фермент катализирует реакцию отнятия атомов водорода непосредственно от первичного субстрата, то его называют первичной дегидрогеназой.Если фермент ускоряет снятие атомов водорода со вторичного субстрата, который сам ранее получил атомы водорода при помощи первичной дегидрогеназы, то его называют вторичной дегидрогеназой.Другая особенность оксидоредуктаз состоит в том, что они ускоряют протекание химических процессов, связанных с высвобождением энергии.Третья особенность оксидоредуктаз заключается в том, что имея несколько коферментов, они способны ускорять большое количество разных окислительно-восстановительных реакций. Один и тот же кофермент способен соединяться со многими апоферментами, образуя каждый раз оксидоредуктазу, специфичную по отношению определенному субстрату.Самыми распространенными являются оксидоредуктазы, содержащие в качестве активной группы никотинамидадениндинуклеотид (НАД+) – производное никотинамида, витамина РР.
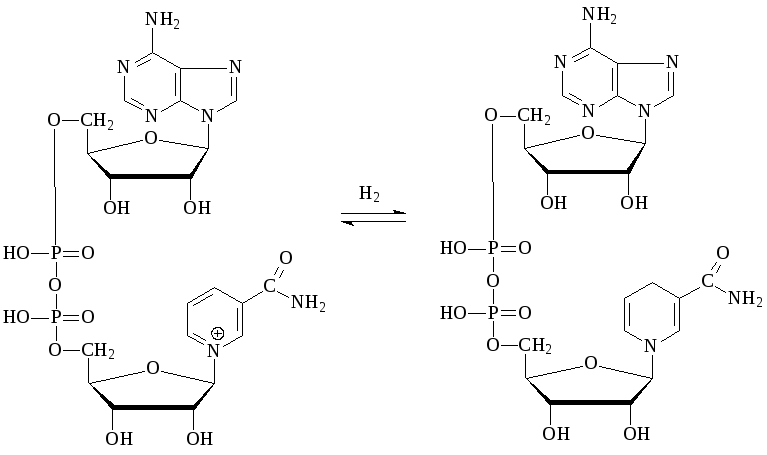 (окисленная форма НАД+восстановленная форма НАДН+Н)
(окисленная форма НАД+восстановленная форма НАДН+Н)
Субстратами НАД-зависимых дегидрогеназ являются спирты, альдегиды, амины, дикарбоновые и кетокислоты. Все НАД-зависимые дегидрогеназы являются анаэробными дегидрогеназами, то есть посылают атомы водорода на ближайший в окислительной цепи другой фермент.Примером НАД-зависимой дегидрогеназы является алкогольдегидрогеназа из печени животных. Фермент состоит из двух субъединиц, каждая из которых несет молекулу НАД+ и атом Zn. Он катализирует реакцию окисления спирта в альдегид:

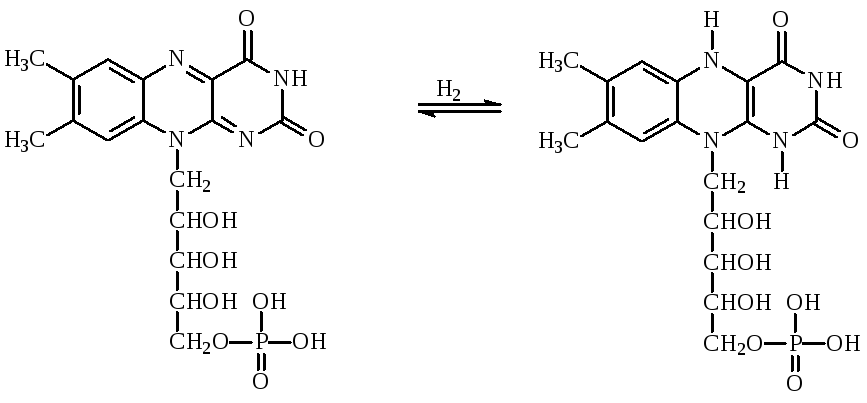 Кроме НАД+ оксидоредуктазы содержат в качестве кофермента НАДФ+, у которого водород ОН-группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты.Партнером НАД-зависимых дегидрогеназ выступают флавопротеиды, например флавинмононуклеотид ФМН, производное витамина В2. Окисленная форма ФМН окрашена, она способна принимать два протона и два электрона, переходя в лейкоформу:
Кроме НАД+ оксидоредуктазы содержат в качестве кофермента НАДФ+, у которого водород ОН-группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты.Партнером НАД-зависимых дегидрогеназ выступают флавопротеиды, например флавинмононуклеотид ФМН, производное витамина В2. Окисленная форма ФМН окрашена, она способна принимать два протона и два электрона, переходя в лейкоформу:
окисленная окрашенная форма ФМН восстановленная бесцветная форма ФМНН2
Другим коферментом во флавопротеинах является ФАД: флавинадениндинуклеотид
Флавопротеины в большинстве случаев являются вторичными дегидрогеназами, однако некоторые флавопротеины, особенно с ФАД, могут непосредственно снимать атомы водорода с субстрата. Примером реакции с участием ФАД является окисление глюкозы глюкозооксидазой в глюконо-лактон. Глюкозооксидаза синтезируется плесневелыми грибами при рН 5–7. Фермент содержит две молекулы ФАД, высоко специфичен и стабилен. Применяют для получения D-глюконата кальция и удаления О2 из продуктов.
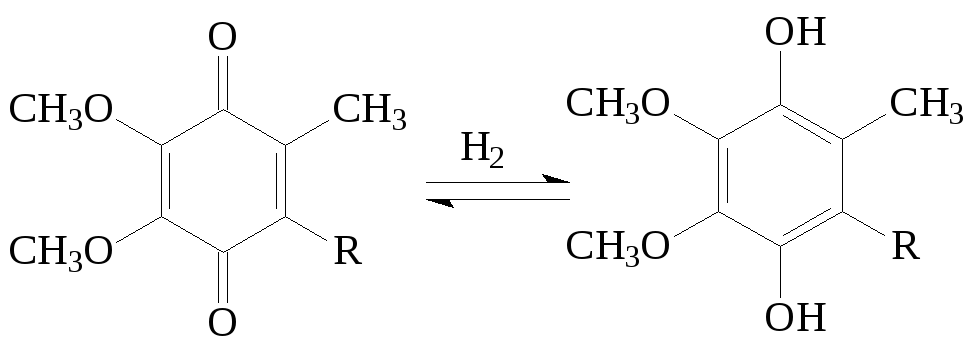 Коферментами оксидоредуктаз также являются хиноны – убихинон дыхательной цепи, пластохинон фотосинтезирующей системы хлоропластов. Они передают атомы водорода по окислительно-восстановительным цепям:
Коферментами оксидоредуктаз также являются хиноны – убихинон дыхательной цепи, пластохинон фотосинтезирующей системы хлоропластов. Они передают атомы водорода по окислительно-восстановительным цепям:
(хинон – гидроксихинон)
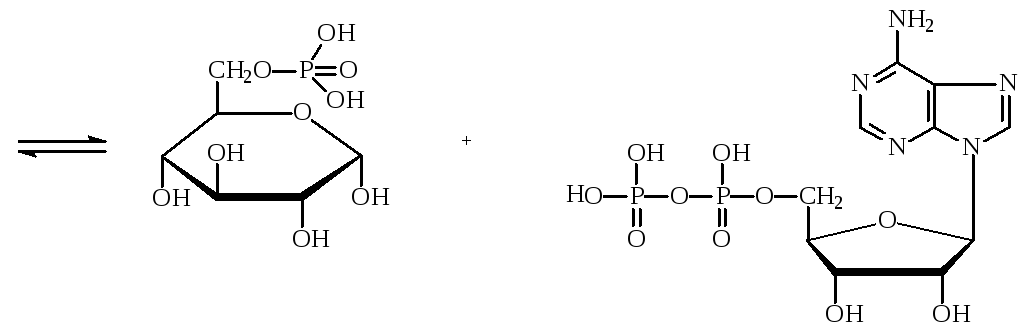
 Трансферазы – один из наиболее обширных классов, специализируются на переносе функциональных групп с одного субстрата к другому. Делятся на подклассы в зависимости от характера переносимых групп.Фосфотрансферазы – ускоряют реакцию переноса остатка фосфорной кислоты. Реакцией фосфорилирования обеспечивается превращение ряда органических соединений в фосфорные эфиры, обладающие повышенной химической активностью и более легко вступающие в последующие реакции. Перенос фосфатных групп идет на спиртовые, карбоксильные, азотсодержащие, фосфорсодержащие и другие группы. Донором фосфатных остатков является в большинстве случаев АТФ. Фосфотрансферазы, переносящие остаток фосфата с АТФ на белки, называются протеинкиназами. Они переносят фосфат на радикалы серина, треонина, тирозина, лизина и гистидина, в результате чего резко изменяется биологисческая активность ряда белков. Фосфотрансферазой является, например, гексокиназа – фермент, ускоряющий перенос остатка фосфорной кислоты от молекулы АТФ к глюкозе с образованием глюкозо-6-фосфата. Гексокиназа состоит из 4 субъединиц, каждая отдельная молекула лишена фосфотрансферазной активности. Обнаружено 5 изозимов гексокиназы:
Трансферазы – один из наиболее обширных классов, специализируются на переносе функциональных групп с одного субстрата к другому. Делятся на подклассы в зависимости от характера переносимых групп.Фосфотрансферазы – ускоряют реакцию переноса остатка фосфорной кислоты. Реакцией фосфорилирования обеспечивается превращение ряда органических соединений в фосфорные эфиры, обладающие повышенной химической активностью и более легко вступающие в последующие реакции. Перенос фосфатных групп идет на спиртовые, карбоксильные, азотсодержащие, фосфорсодержащие и другие группы. Донором фосфатных остатков является в большинстве случаев АТФ. Фосфотрансферазы, переносящие остаток фосфата с АТФ на белки, называются протеинкиназами. Они переносят фосфат на радикалы серина, треонина, тирозина, лизина и гистидина, в результате чего резко изменяется биологисческая активность ряда белков. Фосфотрансферазой является, например, гексокиназа – фермент, ускоряющий перенос остатка фосфорной кислоты от молекулы АТФ к глюкозе с образованием глюкозо-6-фосфата. Гексокиназа состоит из 4 субъединиц, каждая отдельная молекула лишена фосфотрансферазной активности. Обнаружено 5 изозимов гексокиназы:
глюкоза АТФ глюкозо-6-фосфат АДФ
Ацилтрансферазы – ускоряют перенос ацилов (остатков карбоновых кислот) на аминокислоты, амины, спирты и другие соединения. Универсальным источником ацильных групп во всех этих реакциях является ацилкоэнзим А (ацил-СоА), чаще всего переносу подвергается ацетил. Аминотрансферазы – ускоряют реакцию трансаминирования аминокислот с кетокислотами и очень важны для обеспечения биосинтеза аминокислот. Простетической группой аминотрансфераз является пиридоксальфосфат, производное витамина В6 (пиридоксина). Механизм реакции трансаминирования хорошо изучен.
Важное значение среди трансфераз имеют ферменты, ускоряющие перенос одноуглеродных фрагментов, содержащие в качестве коферментов фолиевую кислоту и цианокобаламин.
Гликозилтрансферазы – ускоряют реакции переноса гликозильных остатков из молекул фосфорных эфиров или других соединений к молекулам моносахаридов, полисахаридов или других веществ.
Гидролазы – самая распространенная группа ферментов, не содержат коферментов, то есть являются по химической структуре простыми белками. В зависимости от характера гидролизуемого субстрата гидролазы делятся на ряд подклассов. Эстеразы – катализируют реакции гидролиза сложных эфиров спиртов с органическими и неорганическими кислотами. Примером эстераз является липаза, которая ускоряет гидролиз сложноэфирных связей в молекулах жиров:
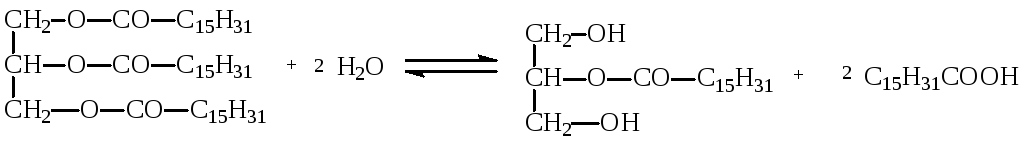 трипальмитилглицерин 2-монопальмитилглицерин пальмитат
трипальмитилглицерин 2-монопальмитилглицерин пальмитат
Гликозидазы – ускоряют реакцию гидролиза гликозидов. Обладают ярко выраженной пространственной специфичностью (α- и β-гликозидазы). Примером может служить сахараза, ускоряющая гидролиз сахарозы на глюкозу и фруктозу:
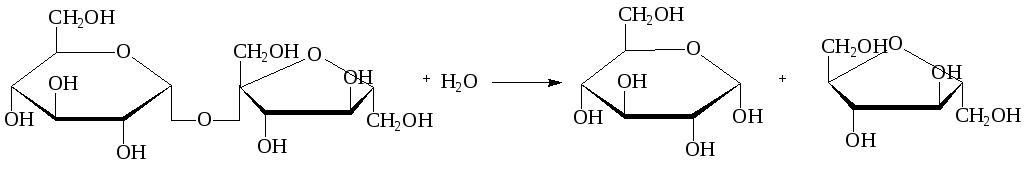
сахароза глюкоза фруктоза
Пептидазы – катализируют расщепление пептидных связей в белках и пептидах. Эндопептидазы катализируют гидролиз пептидных связей внутри молекулы, экзопептидазы – отщепление от полипептидной цепи концевых аминокислот (аминопептидазы и карбоксипептидазы). Существуют также дипептидазы, завершающие гидролиз белка
Лиазы – ускоряют негидролитические реакции распада органических соединений по связям C-C, C-N, C-O, C-S. При этом замыкаются двойные связи и выделяются такие простейшие продукты, как CO2, H2O, NH3. Некоторые из этих реакций являются обратимыми, и соответствующие ферменты в подходящих условиях катализируют реакции не только распада, но и синтеза.
Изомеразы – немногочисленный класс ферментов, осуществляют внутримолекулярный перенос водорода, фосфатных и ацильных групп, перемещение двойных связей, изменение пространственного расположения атомных группировок.
Лигазы – ферменты, катализирующие синтез органических веществ в клетке. Главная их особенность – сопряженность синтеза с распадом АТФ. При отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ. Далее лигазы ускоряют соединение этих активированных субстратов.
К группе лигаз, образующих С-С-связи, относятся карбоксилазы. Например, пируваткарбоксилаза ускоряет реакцию образования оксалоацетата из пирувата и СО2:
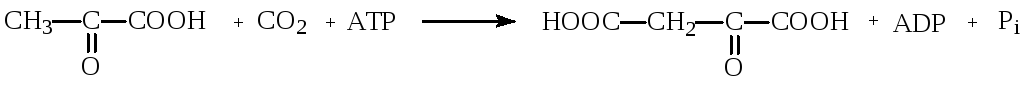
пируват оксалоацетат
В качестве кофермента карбоксилазы используют активированную форму витамина Н (биотина) – карбоксибиотин:
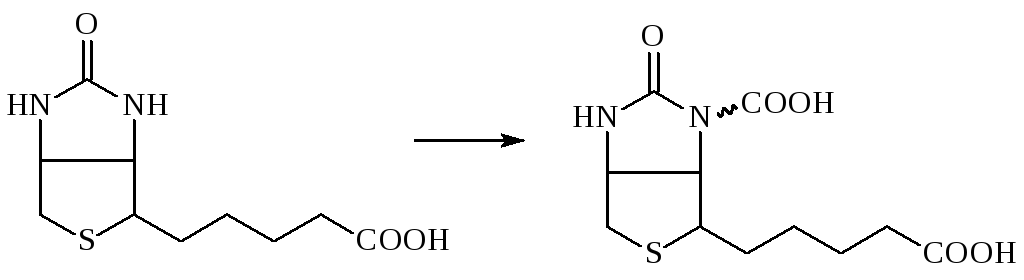
биотин карбоксибиотин
Способность к регуляции делает ферменты важными участниками и своеобразными организаторами клеточных процессов в организме. Регуляция скорости ферментативных реакций в клетке — основной механизм не только контроля и координации метаболических путей, но и роста и развития клетки, а также ее ответа на изменение окружающей среды.
Существует два основных способа контроля скорости ферментативных реакций:
— Контроль количества фермента. Количество фермента в клетке определяется соотношением скоростей его синтеза и распада. Этот способ регуляция скорости ферментативной реакции является более медленным процессом (проявляется спустя несколько часов), чем регуляция активности фермента (практически мгновенный ответ).
— Контроль активности фермента. Активность фермента может регулироваться путем взаимодействия с определенными веществами, изменяющими конформацию активного центра.
Регуляция субстратом реакции Регуляция ферментативной активности, осуществляемая в центре присоединения субстрата, носит название изостерической. Одним из относительно простых способов регуляции активности ферментов является регуляция с помощью изменения концентрации субстратов реакции. Чем больше в распоряжении фермента имеется молекул веществ, превращения которых он осуществляет, тем выше (до определенных пределов) скорость процесса. При насыщении всех молекул фермента субстратом скорость реакции достигает максимального уровня. В дальнейшем скорость реакции может понизиться по мере исчерпания запасов субстрата и вновь возрасти при их восстановлении. Слишком большая концентрация субстрата также может понижать скорость ферментативной реакции. Этот феномен носит название субстратного торможения. В качестве примера субстратного торможения можно привести фермент, расщепляющий биологически активное вещество ацетилхолин - ацетилхолинэстеразу (АХЭ). К активному центру АХЭ субстрат (ацетилхолин) присоединяется двумя концами молекулы одновременно. При увеличении концентрации ацетилхолина с одной молекулой фермента могут одновременно реагировать две молекулы субстрата, но разными концами. В этом случае реакция, суть которой заключается в разрыве сложноэфирной связи в середине молекулы ацетилхолина (с образованием холина и уксусной кислоты), оказывается невозможной, и молекулы ацетилхолинэстеразы, нагруженные субстратом, оказываются тем не менее лишенными активности. Уменьшение концентрации ацетилхолина в среде приведет к диссоциации неактивного комплекса и снимет торможение. Этот механизм имеет важное физиологическое значение для регуляции концентрации ацетилхолина, который выполняет в нервной системе и мышцах роль медиатора, передающего возбуждение с одной клетки на другую. Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра (allos - иной). Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование. «Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей.
Метаболические цепи Обычно ферментативные реакции в клетке организованы в метаболические цепи или циклы, где самая медленная стадия лимитирует скорость всей цепи, то есть последовательности реакций, объединяемых общими субстратами. В таких цепях нередко наблюдается так называемая регуляция по типу обратной связи. Она служит для того, чтобы скорректировать работу цепи с потребностями клетки в конечном продукте. Принцип регуляции заключается в том, что ферменты, стоящие в начале цепи, ингибируются отдаленными метаболитами или конечными продуктами. Такая регуляция чаще всего происходит по аллостерическому типу, когда молекула регулятора связывается с ферментом в специальном регуляторном центре. Аллостерические ферменты часто выполняют ключевую роль в регуляции обмена веществ, поскольку обладают способностью определять количество важных метаболитов и изменять в соответствии с этим свою активность. В каждой метаболической цепи есть фермент, который задает скорость всей цепочке реакций. Он называется регуляторным ферментом.
Ферменты, регулирующие скорость метаболических путей: - обычно действуют на ранних стадиях метаболических путей, в местах ключевых разветвлений метаболических путей; - катализируют в условиях клетки практически необратимые реакции, протекающие наиболее медленно (ключевые).
Химическая модификация белков осуществляется за счет присоединения к аминокислотным остаткам в молекуле белка определенных групп: фосфатной группы (при участии протеинкиназ), остатка жирной кислоты (с помощью ацилтрансфераз), углеводных компонентов (гликозил-трансферазы, гликозидазы).
Белки, как правило, имеют лабильную структуру, упаковка которой сильно зависит от свойств химических групп, входящих в состав молекулы. Поэтому присоединение к молекуле белка дополнительных группировок существенно влияет на структуру, а следовательно, и на ферментативную активность молекулы. Такая регуляция носит приспособительный (адаптационный) характер.
Пример. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации.
В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы.
Фосфорилирование - распространенный способ изменить свойства некоторых клеточных белков. Так, при фосфорилировании компонентов цитоскелета (комплекса структурных белков, обеспечивающих поддержание прочности и функционирования клетки) изменяются прочность его взаимодействия с мембраной и форма клеток. Фосфорилирование белков - регуляторов сокращения активирует сократительную реакцию мышцы.
Регуляция с помощью химической модификации белка приводит к долговременным последствиям: модифицированные молекулы сохраняют свои функции измененными до тех пор, пока специальные ферменты не отщепят модифицирующую белок химическую группу и не вернут его в исходное состояние.
Регуляция путем белок-белковых взаимодействий (ассоциации-диссоциации субъединиц в олигомерном ферменте). Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии цAMP, который способен присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2+ 2cАМР 2С + 2(R -цАМР)
Протеинкиназа фосфорилирует соответствующие ферменты, изменяет их активность и, следовательно, скорость метаболизма в клетке.
Активация ферментов путем частичного протеолиза. Чачтичный протеолиз-разрушение белковой структкры до аминокислотных остатков,для того.чтобы слизистая пожелудочной не разрушилась от трипсина. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца гексапептида. Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа.
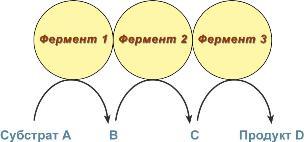 В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
Например: пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий пируват в ацетил-КоА, (в клетках человека состоит из ~ 330 полипептидных цепей); α-кетоглутаратдегидрогеназный комплекс(вцикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-КоА; комплекс под названием "синтаза жирных кислот" (илипальмитатсинтаза), обеспечивающий синтез жирных кислот.
Наряду с обычными ферментами существуют ферменты, способные не только выполнять каталитическую функцию, но и способные повышать или понижать свою каталитическую активность в ответ на определённые сигналы. Благодаря действию подобных ферментов, скорость каждой последовательности метаболических реакций изменяется почти мгновенно, приспосабливаясь к изменению потребности клетки либо в энергии, либо в каких-то строительных блоках (молекулах), необходимых для роста и обновления клеток. По строению такие ферменты отличаются от обычных ферментов. Аллостерические ферменты, как правило, построены из двух или большего числа субъединиц. Наряду с активным и субстратным центрами, они имеют аллостерический центр. Этот центр может обратимо связывать определённые метаболиты, ингибирующие или активирующие фермент. Такие метаболиты называются эффекторами. При присоединении эффектора к аллостерическому центру изменяется конформация белка в целом, а следовательно, и конформация активного центра. В результате активность фермента изменяется. Эффекторы имеют важное значение, т. к. с их помощью осуществляется один из главных механизмов регуляции каталитической активности. Продукты в живом организме обычно образуются в результате цепочки биохимических превращений. Если этот продукт оказывается в недостатке, необходимо усиление работы системы ферментов, приводящих к его образованию. В случае накопления достаточного количества этого продукта целесообразно выключение всей системы этих реакций. Поэтому в такие цепи включены аллостерические ферменты (это, как правило, фермент, катализирующий первую реакцию цепи), которые ингибируются конечным продуктом. Этот тип ингибирования получил название ингибирования по типу обратной связи – ретроингибирования
Существуют и другие механизмы регуляции активности ферментов. Изоферменты – это ферменты, катализирующие одну и ту же реакцию, но с различной эффективностью. По ряду свойств изоферменты могут различаться, например, по молекулярной активности, по способам регуляции, по температурному оптимуму, оптимуму pH, электрофоретической подвижности. Все эти отличия связаны с особенностями их строения. Изоферменты – это олигомерные белки, построенные из неидентичных протомеров в результате их различной компоновки. Например, фермент лактатдегидрогеназа представляет собой тетрамер, в котором могут быть протомеры двух типов – HиZ, различающиеся по аминокислотному составу и прежде всего по содержанию кислых аминокислот и по электрофоретической подвижности. Возможны пять комбинаций этих протомеров в тетрамерной молекуле: H4,H3Z1,H2Z2,HZ3, Z4их легко разделить методом электрофореза.
Наличие изоферментов даёт возможность осуществлять обменные процессы в организме при изменении условий среды. Например, если резко изменяются температурные условия, которые становятся неблагоприятными для проявления каталитической активности некоторых изоферментов, то их активность подавляется. Однако данный ферментативный процесс не прекращается полностью, так как начинают проявлять каталитическую активность другие изоферменты, для которых данная температура является благоприятной.
Если в силу каких-либо причин изменяется pHреакционной среды, то также ослабляется активность одних изоферментов, но вместо них начинают проявлять каталитическую активность изоферменты, имеющие иной оптимумpH. Таким образом, наличие изоферментов, наряду с другими механизмами регуляции, способствует согласованности процессов обмена веществ в клетке и быстрой приспособляемости живых организмов к изменяющимся условиям жизнедеятельности.
Формы ферментов, образующиеся в результате модификации их молекул уже после синтеза, не называются изоферментами. Например, не являются изоферментами фосфорилированная и дефосфорилированная липаза жировой ткани.
БИЛЕТ № 6
Формы обучения в вузе. Перспективы развития лекции как формы и метода в системе вузовского обучения. Роль лабораторных и практических занятий в высшей школе. Особенности семинара при реализации концепции педагогики сотрудничества.
Обучение в вузе предусматривает следующие формы учебных занятий: лекция, семинарское практическое занятие, лабораторное занятие, консультация, контрольная работа, коллоквиум. Кроме того, в обучении применяются также различные виды практик и учебная научно-исследовательская работа (выполнение курсовых и дипломных работ). Лекция (от лат. lectio − чтение) − ведущий метод сообщения новых знаний в вузе. Лекции предназначены для устного систематического изложения преподавателем материала по новой теме изучаемой дисциплины. Лекция проводится для всех групп курса, или, если число групп велико, для отдельного потока. В лекциях дается целостное представление об учебном предмете, его методологических и концептуальных основах. Содержание и план лекции определяются ведущим преподавателем. Они соответствуют Государственному образовательному стандарту и учебной программе по преподаваемой дисциплине. Преподаватель может рассматривать на лекции наиболее сложные разделы курса, вынося определенные темы на самостоятельное изучение. Кроме того, чтение курса может иметь авторский характер, когда на лекциях излагаются лишь наиболее важные проблемы и вопросы какого-либо учебного предмета, а значительная часть времени отводится авторским разработкам, освещению авторских исследований в данной области. В некоторых случаях дается авторская интерпретация излагаемого предмета, слушатели знакомятся с новыми подходами в понимании изучаемой дисциплины. Иногда лекция служит основным источником информации по какому-либо новому разрабатываемому курсу, посвященному новейшим исследованиям в какой-либо области. Поэтому студентам необходимо освоить умения слушания и конспектирования лекций, выработать систему рациональной записи лекций, использования сокращений. Для лучшего усвоения содержания лекционного курса студенту необходимо познакомиться с программой курса, с требованиями Госстандарта по данной дисциплине, рекомендуемой по курсу литературой. Все эти документы имеются в деканатах, на ведущих кафедрах, в библиотеках вуза и факультетов. Обычно к лекции не требуется специальной подготовки студентов, но в некоторых случаях преподаватель дает задание повторить ранее пройденные темы, иногда практикуется предварительное конспектирование какого-либо раздела учебного пособия, определенного источника по теме, которая будет изучаться. Семинарское практическое занятие (от лат. seminarium − рассадник) − форма вузовской учебной работы, предполагающая обсуждение наибол



 (окисленная форма НАД+восстановленная форма НАДН+Н)
(окисленная форма НАД+восстановленная форма НАДН+Н)
 Кроме НАД+ оксидоредуктазы содержат в качестве кофермента НАДФ+, у которого водород ОН-группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты.Партнером НАД-зависимых дегидрогеназ выступают флавопротеиды, например флавинмононуклеотид ФМН, производное витамина В2. Окисленная форма ФМН окрашена, она способна принимать два протона и два электрона, переходя в лейкоформу:
Кроме НАД+ оксидоредуктазы содержат в качестве кофермента НАДФ+, у которого водород ОН-группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты.Партнером НАД-зависимых дегидрогеназ выступают флавопротеиды, например флавинмононуклеотид ФМН, производное витамина В2. Окисленная форма ФМН окрашена, она способна принимать два протона и два электрона, переходя в лейкоформу: Коферментами оксидоредуктаз также являются хиноны – убихинон дыхательной цепи, пластохинон фотосинтезирующей системы хлоропластов. Они передают атомы водорода по окислительно-восстановительным цепям:
Коферментами оксидоредуктаз также являются хиноны – убихинон дыхательной цепи, пластохинон фотосинтезирующей системы хлоропластов. Они передают атомы водорода по окислительно-восстановительным цепям:
 Трансферазы – один из наиболее обширных классов, специализируются на переносе функциональных групп с одного субстрата к другому. Делятся на подклассы в зависимости от характера переносимых групп.Фосфотрансферазы – ускоряют реакцию переноса остатка фосфорной кислоты. Реакцией фосфорилирования обеспечивается превращение ряда органических соединений в фосфорные эфиры, обладающие повышенной химической активностью и более легко вступающие в последующие реакции. Перенос фосфатных групп идет на спиртовые, карбоксильные, азотсодержащие, фосфорсодержащие и другие группы. Донором фосфатных остатков является в большинстве случаев АТФ. Фосфотрансферазы, переносящие остаток фосфата с АТФ на белки, называются протеинкиназами. Они переносят фосфат на радикалы серина, треонина, тирозина, лизина и гистидина, в результате чего резко изменяется биологисческая активность ряда белков. Фосфотрансферазой является, например, гексокиназа – фермент, ускоряющий перенос остатка фосфорной кислоты от молекулы АТФ к глюкозе с образованием глюкозо-6-фосфата. Гексокиназа состоит из 4 субъединиц, каждая отдельная молекула лишена фосфотрансферазной активности. Обнаружено 5 изозимов гексокиназы:
Трансферазы – один из наиболее обширных классов, специализируются на переносе функциональных групп с одного субстрата к другому. Делятся на подклассы в зависимости от характера переносимых групп.Фосфотрансферазы – ускоряют реакцию переноса остатка фосфорной кислоты. Реакцией фосфорилирования обеспечивается превращение ряда органических соединений в фосфорные эфиры, обладающие повышенной химической активностью и более легко вступающие в последующие реакции. Перенос фосфатных групп идет на спиртовые, карбоксильные, азотсодержащие, фосфорсодержащие и другие группы. Донором фосфатных остатков является в большинстве случаев АТФ. Фосфотрансферазы, переносящие остаток фосфата с АТФ на белки, называются протеинкиназами. Они переносят фосфат на радикалы серина, треонина, тирозина, лизина и гистидина, в результате чего резко изменяется биологисческая активность ряда белков. Фосфотрансферазой является, например, гексокиназа – фермент, ускоряющий перенос остатка фосфорной кислоты от молекулы АТФ к глюкозе с образованием глюкозо-6-фосфата. Гексокиназа состоит из 4 субъединиц, каждая отдельная молекула лишена фосфотрансферазной активности. Обнаружено 5 изозимов гексокиназы: трипальмитилглицерин 2-монопальмитилглицерин пальмитат
трипальмитилглицерин 2-монопальмитилглицерин пальмитат
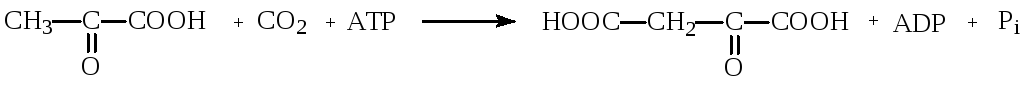

 В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.

