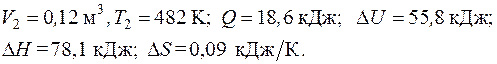При взаимодействии термодинамической системы с окружающей средой происходит обмен энергией. Способ передачи энергии, связанный с изменением внешних параметров, называют работой, а без изменения внешних параметров – теплотой.
Работа характеризует упорядоченную форму обмена энергией с окружающей средой, связанную с макроскопическими перемещениями в системе (сжатие, расширение, перемещение в поле сил тяжести и др.).
Работа изменения объема L, Дж, определяется как:
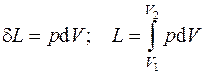 . (4.1)
. (4.1)
Работа, отнесенная к единице массы системы, называется удельной работой 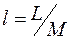 , Дж/кг. Для нее выражения (4.1) принимают вид:
, Дж/кг. Для нее выражения (4.1) принимают вид:
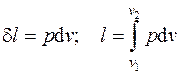 . (4.2)
. (4.2)
Работа является функцией процесса и графически изображается площадью под кривой процесса (1–2) в диаграмме p – v (рис. 4.1). Работа считается положительной, если она производится системой над внешними телами, и отрицательной, если она совершается над системой.
Теплота характеризует микроскопическую неупорядоченную форму обмена энергией, имеющую место при тепловом контакте тел с различной температурой, и самопроизвольно передается от более нагретого тела к менее нагретому на молекулярном уровне.
Количество теплоты Q, Дж, полученное или отданное системой, равно:
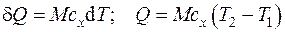 , (4.3)
, (4.3)
где 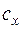 – теплоемкость вещества, определяемая по молекулярно-кинетической теории или как средняя теплоемкость в интервале температур
– теплоемкость вещества, определяемая по молекулярно-кинетической теории или как средняя теплоемкость в интервале температур 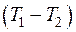 , индекс x – определяет характер процесса (
, индекс x – определяет характер процесса (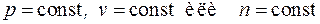 ) (см. разд. 3).
) (см. разд. 3).
Количество теплоты также можно найти, воспользовавшись вторым законом термодинамики (см. разд. 5):
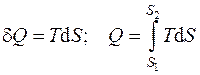 , (4.4)
, (4.4)
где S, Дж/К – энтропия системы.
Количество теплоты, отнесенное к единице массы системы, называется удельным количеством теплоты 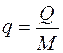 , Дж/кг и определяется как:
, Дж/кг и определяется как:
 , (4.5)
, (4.5)
или
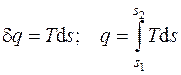 . (4.6)
. (4.6)
Графически теплота изображается площадью под кривой процесса (1–2) в диаграмме T – s (рис. 4.1). Теплота считается положительной, если она подводится к системе (энтропия в процессе подвода тепла увеличивается, 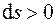 ), и отрицательной, если она отводится от системы (энтропия в процессе отвода тепла уменьшается,
), и отрицательной, если она отводится от системы (энтропия в процессе отвода тепла уменьшается, 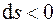 ).
).
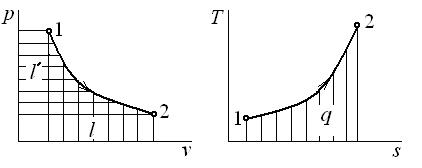
Рис. 4.1. Графическое изображение работы l,
полезной внешней работы l ' и теплоты q
Первый закон термодинамики является законом сохранения и превращения энергии применительно к термодинамическим системам. В соответствии с ним теплота, подведенная к системе, идет на изменение ее внутренней энергии (см. разд. 3) и на совершение ею работы:
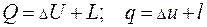 (4.7)
(4.7)
или в дифференциальной форме:
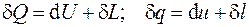 . (4.8)
. (4.8)
Первый закон термодинамики может быть записан также в терминах энтальпии (см. разд. 3):
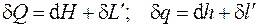 . (4.9)
. (4.9)
Здесь 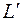 – полезная внешняя (располагаемая) работа, определяемая как
– полезная внешняя (располагаемая) работа, определяемая как
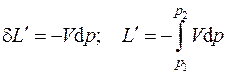 , (4.10)
, (4.10)
а 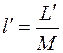 – удельная внешняя работа,
– удельная внешняя работа,
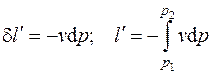 . (4.11)
. (4.11)
Графически полезная внешняя работа изображается площадью слева от кривой процесса в диаграмме p – v (рис. 4.1).
Задачи
4.1. Навстречу друг другу с одинаковой скоростью летят два одинаковых куска льда. При какой скорости они при неупругом ударе испарятся? Начальная температура кусков льда t 1= –30 оС. Теплоемкость льда с л = 2,1 кДж/(кг∙К), теплота плавления льда r пл = 333,7 кДж/кг, теплоемкость воды с в = 4,19 кДж/(кг∙К), теплота парообразования r = 2257 кДж/кг.
Решение
Возрастание внутренней энергии системы двух соударяющихся тел 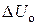 произойдет за счет уменьшения их кинетической энергии. Поскольку тела одинаковые и летят навстречу друг с другом с одинаковыми скоростями, то
произойдет за счет уменьшения их кинетической энергии. Поскольку тела одинаковые и летят навстречу друг с другом с одинаковыми скоростями, то
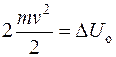 .
.
Теплота, выделяющаяся при ударе, пойдет на нагрев кусков льда до температуры плавления, на сам процесс плавления льда, далее на нагрев образующейся воды до температуры кипения и на испарение воды. Следовательно
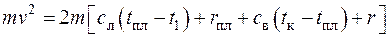 .
.
Отсюда начальная скорость кусков льда
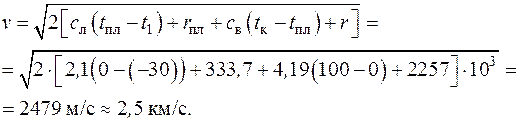
4.2. Сколько килограммов свинца можно нагреть от температуры t 1 = 15 оС до температуры его плавления t пл = 327 оС посредством удара молотом массой 200 кг при падении его с высоты 2 м. Вся энергия падения молота превращается в теплоту, целиком поглощаемую свинцом. Теплоемкость свинца с св = 0,1256 кДж/(кг∙К).
Решение
Поскольку энергия падения молота превращается в теплоту, целиком поглощаемую свинцом, то
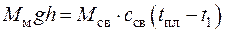 ,
,
откуда масса свинца
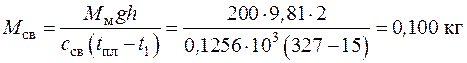 .
.
4.3. Стальной шарик падает с высоты h 1 = 8,16 м на идеально гладкую горизонтальную плоскость и отскакивает от нее на высоту h 2 = 1 м. На сколько градусов повысится температура шарика после удара, если на его нагревание расходуется 70 % энергии удара? Теплоемкость стали c ст = 0,46 кДж/(кг×К).
Ответ: Δt = 10,7 оС.
4.4. Свинцовая пуля пробивает доску, при этом ее скорость падает с 400 м/с до 200 м/с. Какая часть пули расплавится? Нагреванием доски пренебречь. Начальная температура 30 оС. Теплота плавления свинца r пл = 20,934 кДж/кг.
Ответ: 89 %.
4.5. Свинцовый шар массой 200 г, двигающийся без вращения со скоростью 2 м/с, ударил в такой же неподвижный шар, после чего оба шара стали двигаться в одном направлении с одинаковыми скоростями. Насколько возросла их внутренняя энергия при ударе?
Ответ: 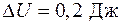 .
.
4.6. 1 литр воды нагревается с помощью электрического кипятильника мощностью 300 Вт. За какое время вода нагреется до температуры кипения, если теплообмен с окружающей средой отсутствует, а начальная температура воды равна 20 оС.
Ответ: τ = 18,6 мин.
4.7. Какая доля теплоты, подведенной к 1 кг кислорода в изобарном процессе, затрачивается на изменение внутренней энергии?
Ответ: Δ u = 0,714 q.
4.8. Работа расширения 0,1 кмоля воздуха равна 17 кДж. Определить изменение удельной внутренней энергии системы, если в процессе расширения от воздуха отводится 63 кДж теплоты.
Решение
Согласно первому закону термодинамики 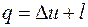 , отсюда
, отсюда
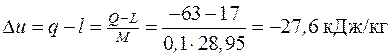 .
.
Примечание: количество теплоты подставляется со знаком «минус», так как теплота от воздуха отводится.
4.9. К газу, заключенному в цилиндре с поршнем, подводится извне 100 кДж теплоты. Величина произведенной при этом работы составляет 115 кДж. Определить изменение удельной внутренней энергии газа, если его количество составляет 0,8 кг.
Ответ: Δ u = – 18,75 кДж/кг.
4.10. К 2 кг кислорода подведено 300 кДж тепла. Определить, какое количество теплоты пошло на изменение внутренней энергии и на совершение работы, если в результате термодинамического процесса температура газа возросла от 10 оС до 166 оС.
Ответ: 67 % – на изменение внутренней энергии, 33 % – на совершение работы.
4.11. Работа расширения 0,5 кг газа составляет 10 кДж. При этом от газа отнимается 10 ккал тепла. Как изменится удельная внутренняя энергия в результате совершения процесса?
Ответ: Δ u = – 103,8 кДж/кг.
4.12. При торможении двигателя работа, произведенная двигателем, расходуется на преодоление сил трения и превращается в теплоту, 20 % которой рассеивается в окружающей среде, а остальная часть отводится с охлаждающей водой в тормозной системе. Сколько воды надо подвести к тормозу за 1 час, если крутящий момент на валу 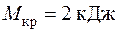 , частота вращения n = 1500 об/мин, а допустимое повышение температуры воды
, частота вращения n = 1500 об/мин, а допустимое повышение температуры воды 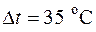 .
.
Теплоемкость воды 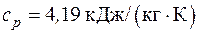 .
.
Решение
Так как мощность двигателя целиком переходит в теплоту трения, 80 % которой поглощается водой, то энергетический баланс можно записать в следующем виде:
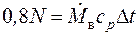 ,
,
где мощность двигателя
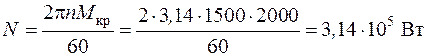 .
.
Тогда
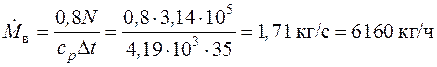 .
.
4.13. Какое количество охлаждающей воды следует подавать в час на колодки испытательного тормоза, если мощность двигателя 60 кВт, температура охлаждающей воды 20 оС, а предельно допустимая температура воды на выходе 80 оС?
25 % теплоты трения рассеивается в окружающей среде. Теплоемкость воды 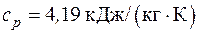 .
.
Ответ:  .
.
4.14. Газ, состояние которого определяется на p - v диаграмме точкой 1 (рис. 4.2), переходит в состояние 2 по пути 1 а 2. При этом к газу подводится 80 кДж теплоты, а работа, совершенная газом, составляет 30 кДж. Затем газ возвращается в исходное состояние по пути 2 b 1.
Какое количество теплоты необходимо подвести или отвести в процессе 2 b 1, если работа, затраченная на сжатие газа в этом процессе, составляет 50 кДж?
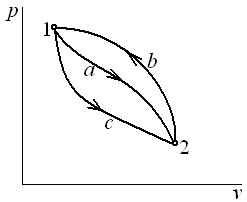
Рис. 4.2. К задачам 4.14, 4.15
Решение
Запишем уравнения первого закон термодинамики для процессов 1 а 2 и 2 b 1:
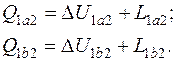
Так как изменение внутренней энергии не зависит от характера процесса, а определяется только параметрами состояния, то
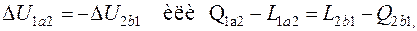
откуда 
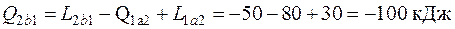 , причем теплота в процессе 2 b 1отводится (так как
, причем теплота в процессе 2 b 1отводится (так как  ).
).
4.15. Для условий задачи 4.14 определить, сколько теплоты необходимо подвести к газу в процесс 1 с 2, чтобы от газа получить работу, равную 10 кДж?
Ответ: 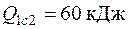 .
.
4.16. Газ может переходить из состояния 1 в состояние 2 по пути 1 а 2 или по пути 1 b 2 (рис. 4.3). Насколько будут отличаться количества подведенной и отведенной теплоты в этих процессах, если давления в точках 1 и 2 равны 0,1 МПа и 0,5 МПа соответственно, а изменение объема 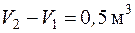 ?
?
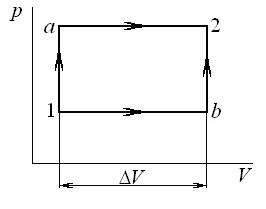
Рис. 4.3. К задаче 4.15
Ответ: 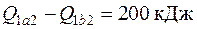 .
.
4.17. Пассажирский пароход идет со скоростью 20 км/ч. Какова мощность силовой установки парохода, если на 1 км пути расходуется 50 кг каменного угля с теплотой сгорания 5000 ккал/кг? КПД силовой установки 12 %.
Ответ: 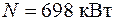 .
.
4.18. Какое количество тепла может быть получено от 1 г урана U235 в атомном реакторе, если для силовой установки мощностью 75000 л.с. требуется 140 г урана в сутки при КПД реактора 40 %? Сколько бы потребовалось в сутки угля с теплотой сгорания 7000 ккал/кг для этой же силовой установки? (1 л.с. = 0,735 кВт).
Ответ: 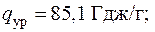
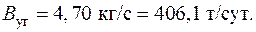
4.19. Определить КПД двигателя мощностью 50 л.с., если расход бензина на 1 км пути составляет 320 г при скорости 40 км/ч. Теплота сгорания бензина 10500 ккал/кг.
Ответ: 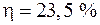 .
.
Второй закон термодинамики.
Эксергия
Второй закон термодинамики определяет направление, в котором протекают процессы, устанавливает условия преобразования тепловой энергии в механическую, а также определяет максимальное значение работы, которая может быть произведена тепловым двигателем.
Математически второй закон термодинамики может быть выражен следующим образом:
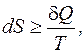 (5.1)
(5.1)
где 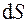 – бесконечно малое приращение энтропии системы;
– бесконечно малое приращение энтропии системы;
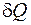 – бесконечно малое количество теплоты, полученное системой от источника теплоты.
– бесконечно малое количество теплоты, полученное системой от источника теплоты.
Знак равенства соответствует обратимым процессам, знак неравенства – необратимым. Чем выше степень необратимости процессов, тем сильнее возрастание энтропии.
Первый и второй законы термодинамики для обратимых процессов могут быть записаны совместно в виде термодинамических тождеств:
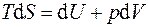 ; (5.2)
; (5.2)
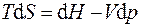 . (5.3)
. (5.3)
Эксергия системы – это максимальная работа, которую может совершить система при переходе в состояние равновесия с окружающей средой. Эксергетический анализ работы теплоэнергетических и технологических установок учитывает не только количественные, но и качественные характеристики энергоресурсов в различных элементах установок, а также необратимость протекающих в них процессов.
Эксергия тепла термодинамического процесса 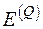 , Дж находится как
, Дж находится как
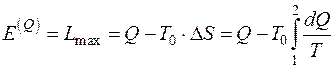 , (5.4)
, (5.4)
где Q – теплота термодинамического процесса, Дж;
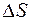 – изменение энтропии рабочего тела, Дж/К;
– изменение энтропии рабочего тела, Дж/К;
Т 0 – температура окружающей среды, К.
Эксергия является экстенсивной функцией состояния, поэтому удельная эксергия тепла 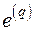 , Дж/К определяется как
, Дж/К определяется как
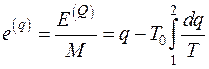 . (5.5)
. (5.5)
Графически удельная эксергия тепла представлена на рис 5.1. Общая площадь под кривой процесса 1–2 соответствует количеству удельной теплоты процесса q. Она состоит из эксергии тепла процесса (площади, заштрихованной вертикальными линиями) и неработоспособной части тепла 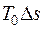 (площади, заштрихованной горизонтальными линиями).
(площади, заштрихованной горизонтальными линиями).
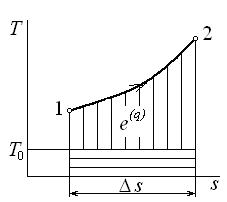
Рис. 5.1. Эксергия тепла термодинамического процесса
Потери работоспособности 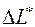 (эксергетические потери) за счет необратимости процессов, протекающих в системе, определяются по формуле Гюи-Стодолы
(эксергетические потери) за счет необратимости процессов, протекающих в системе, определяются по формуле Гюи-Стодолы
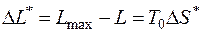 , (5.6)
, (5.6)
где 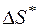 – полное приращение энтропии всех подсистем, входящих в данную систему.
– полное приращение энтропии всех подсистем, входящих в данную систему.
Если в исходном состоянии термодинамическая система имеет параметры U, S, V, а в конечном – находится в равновесии с окружающей средой и имеет параметры 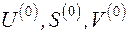 , то эксергия неподвижной термодинамической системы E определяется как
, то эксергия неподвижной термодинамической системы E определяется как
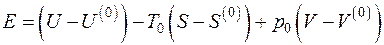 , (5.7)
, (5.7)
а удельная эксергия e неподвижной системы как
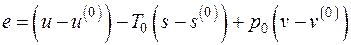 , (5.8)
, (5.8)
где 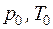 – параметры окружающей среды.
– параметры окружающей среды.
Для неподвижной системы, совершающей некоторый обратимый процесс 1–2, максимальная работа равна убыли эксергии:
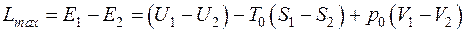 . (5.9)
. (5.9)
Тогда для необратимого процесса уравнение баланса эксергии примет вид
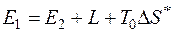 , (5.10)
, (5.10)
то есть при переходе из состояния 1 в состояние 2 эксергия системы расходуется на совершение работы L, а часть работоспособности теряется из-за необратимости процессов.
При нахождении эксергии потока вещества в форме Лагранжа система координат движется вместе с потоком. Если начальные параметры потока H, S, а конечные соответствуют состоянию равновесия потока с окружающей средой 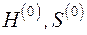 , то выражение для эксергии потока в форме Лагранжа
, то выражение для эксергии потока в форме Лагранжа 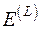 имеет вид
имеет вид
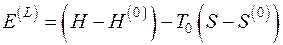 , (5.11)
, (5.11)
а для удельной эксергии потока 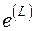 :
:
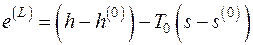 . (5.12)
. (5.12)
Максимальная внешняя работа совершается за счет убыли эксергии потока
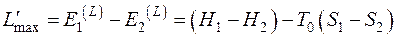 . (5.13)
. (5.13)
Эксергетические потери находятся также по формуле Гюи-Стодолы
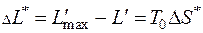 , (5.14)
, (5.14)
тогда уравнение баланса эксергии потока имеет вид
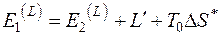 . (5.15)
. (5.15)
Задачи
5.1. Вычислить эксергию тепла изобарного процесса нагрева воздуха от температуры 20 оС до температуры 900 оС, если теплоемкость воздуха ср = 1 кДж/кг, а температура окружающей среды 15 оС.
Решение
Эксергия тепла термодинамического процесса определяется в соответствии с (5.5) как
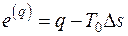 .
.
Подставив в это уравнение выражения для количества теплоты и изменения энтропии в изобарном процессе:
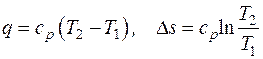 ,
,
получим
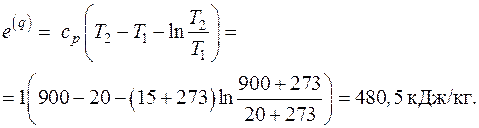
5.2. Вычислить эксергию потока водяного пара в форме Лагранжа, если водяной пар находится при давлении 50 бар и температуре 500 оС. Давление окружающей среды 1 бар, температура 27 оС.
Решение
Эксергия потока в форме Лагранжа находится в соответствии с (5.12):
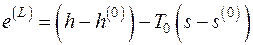 .
.
Энтальпия и энтропия водяного пара находятся по табл. П.2.2.
– при давлении 50 бар и температуре 500 оС:
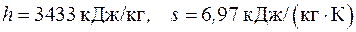 ;
;
– при параметрах окружающей среды (давлении 1 бар и температуре 27 оС):
 .
.
Тогда эксергия потока водяного пара
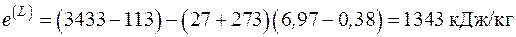 .
.
5.3. В регенеративном теплообменнике воздух с начальной температурой 50 оС изобарно нагревается дымовыми газами, поступающими в теплообменник с температурой 700 оС и изобарно охлаждающимися до температуры 200 оС. Расход воздуха 200 кг/с, расход дымовых газов 100 кг/c. Теплоемкости воздуха и дымовых газов 1,0 кДж/(кг∙К) и 1,2 кДж/(кг∙К) соответственно. Температура окружающей среды 27 оС. Вычислить эксергии тепла горячего и холодного теплоносителей в теплообменном аппарате, эксергетические потери и эксергетический КПД теплообменного аппарата. Тепловыми потерями пренебречь.
Ответ:
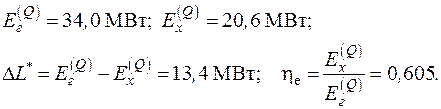
5.4. Вычислить эксергию углекислого газа CO2, имеющего параметры p = 10 бар, T = 600 К, по отношению к окружающей среде с параметрами p 0 = 1 бар, T 0 = 293 К.
Ответ: е = 98,9 кДж/кг.
5.5. Определить потерю работоспособности воздуха при его дросселировании от давления p 1 = 100 бар до давления p 2 = 50 бар. Температура окружающей среды T 0 = 300 К.
Решение
Потери работоспособности термодинамической системы определяются формулой Гюи–Стодолы (5.6):
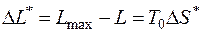 .
.
Поскольку при дросселировании воздуха (идеального газа) температура его не изменяется, то будем иметь в расчете на 1 кг воздуха
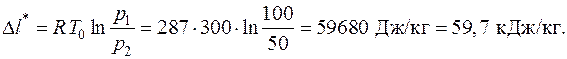
5.6. Определить изменение работоспособности при переходе 1 кг азота N2 из состояния, определяемого давлением p 1 = 10 бар и температурой T 1 = 770 К, в состояние с параметрами p 2 = 2 бар, T 2 = 300 К. Параметры окружающей среды T 0 = 283 К, p o= 1 бар.
Ответ: 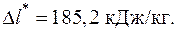
5.7. Определить увеличение энтропии и уменьшение работоспособности при смешении 4 кг водорода H2 и 1 кг углекислого газа CO2, находившихся при одинаковых температурах и давлениях, причем полный объем смеси становится равным суммарному объему смешиваемых газов. Температура окружающей среды T 0 = 293 К.
Решение
Формула для энтропии смешения двух различных идеальных газов при одинаковых температурах и давлениях приводится к виду
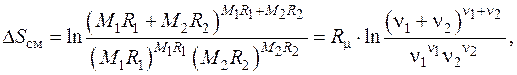
где 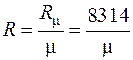 – газовая постоянная,
– газовая постоянная, 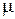 – молекулярная масса,
– молекулярная масса, 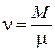 – число киломолей.
– число киломолей.
Подставляя численные данные, получаем
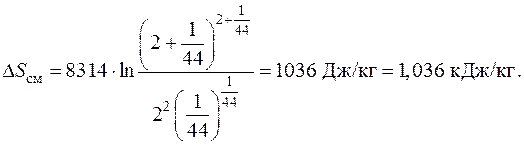
Потери работоспособности
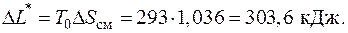
5.8. Как изменится максимальная работоспособность Δ L max углекислого газа CO2, содержащегося в жестком теплоизолированном баллоне объемом V = 100 л при давлении p = 150 бар и температуре t = 27 оС, при его транспортировке с поверхности Земли на поверхность Венеры?
Параметры атмосферы на поверхности Земли: p З = 1 бар, t З = 27 оС. Параметры атмосферы на поверхности Венеры: p В = 90 бар, t В = 500 оС.
Ответ: увеличится на 520,2 кДж.
5.10. Определить максимальную работоспособность (эксергию) Е 1, которую имеют 500 кДж тепла при температуре пламени в котельном агрегате t 1 = 1500 оС. Определить, чему будет равна максимальная работоспособность Е 2 того же количества теплоты, когда она будет передана влажному водяному пару в барабане котла при давлении p 2 = 130 бар. Температура окружающей среды t 0 = 20 оС.
Ответ: Е 1 = 417,4 кДж, Е 2 = 257,5 кДж.
5.11. В регенеративный теплообменник газотурбинной установки поступает воздух после компрессора с температурой t в1 = 140 оС, где он изобарно нагревается за счет продуктов сгорания, поступающих из турбины с температурой t г1 = 340 оС. В теплообменнике продукты сгорания изобарно охлаждаются до температуры t г2 = 210 оС. Определить потерю работоспособности тепла в регенеративном теплообменнике в результате необратимого теплообмена в расчете на 1 кг рабочего тела. Продукты сгорания обладают свойствами воздуха с постоянной теплоемкостью. Температура окружающей среды t 0 = 20 оС. Тепловыми потерями пренебречь.
Ответ: 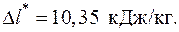
Термодинамические процессы
Идеального газа
Под термодинамическим процессом понимается любое изменение состояния термодинамической системы. На практике чаще всего имеют дело с процессами, в которых меняются все термодинамические параметры, а теплоемкость остается постоянной. Такие процессы называются политропными. Уравнение политропного процесса в координатах p – v имеет вид

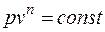 , (6.1)
, (6.1)
где 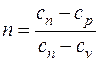 – показатель политропы;
– показатель политропы;
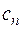 – теплоемкость политропного процесса.
– теплоемкость политропного процесса.
Зная показатель политропы, можно определить теплоемкость политропного процесса как
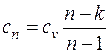 , (6.2)
, (6.2)
где 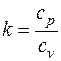 – показатель адиабаты (см. разд. 3).
– показатель адиабаты (см. разд. 3).
Среди политропных процессов большое значение имеют такие, в которых один из параметров состояния остается неизменным. Такими процессами являются: изохорный (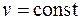 ), изобарный (
), изобарный (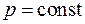 ), изотермический (
), изотермический (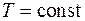 ), а также адиабатный – процесс без теплообмена с окружающей средой (
), а также адиабатный – процесс без теплообмена с окружающей средой (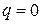 или, для обратимых процессов,
или, для обратимых процессов, 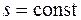 ). Основные формулы для расчетов работы, полезной внешней работы, теплоты процессов, а также изменения термодинамических функций состояния – внутренней энергии, энтальпии и энтропии – для идеального газа приведены в табл. 6.1.
). Основные формулы для расчетов работы, полезной внешней работы, теплоты процессов, а также изменения термодинамических функций состояния – внутренней энергии, энтальпии и энтропии – для идеального газа приведены в табл. 6.1.
Графическое изображение процессов в координатах p – v и T – s показано на рис. 6.1–6.4.
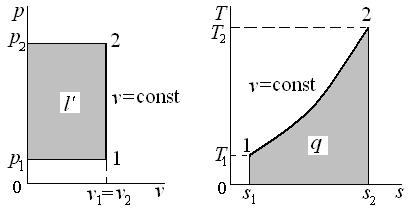
Рис. 6.1 Изохорный процесс идеального газа
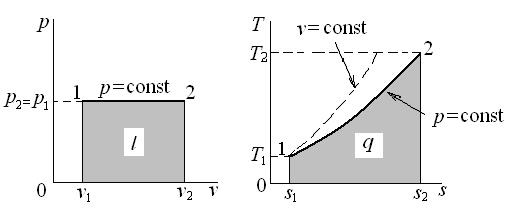
Рис. 6.2. Изобарный процесс идеального газа
Рис. 6.3. Изотермический процесс идеального газа
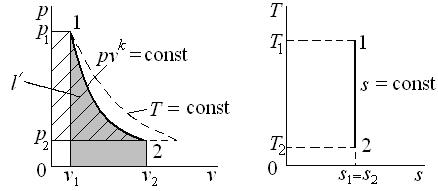
Рис. 6.4. Адиабатный процесс идеального газа
На рис. 6.5 изображены рассмотренные выше четыре частных случая политропного процесса, проходящих через какое-либо одно состояние, с учетом их конкретного показателя n (см. табл. 6.1, 6.2). Пользуясь этим рисунком, можно по величине показателя политропы определить ее относительное расположение и выяснить характер процесса.
Рис. 6.5. Обобщающее значение политропного процесса
Задачи
6.1. 1 кг воздуха сжимается по политропе с показателем  от давления 1 бар до давления 5 бар. Начальная температура воздуха 227 оС.
от давления 1 бар до давления 5 бар. Начальная температура воздуха 227 оС.
Найти параметры воздуха (p, v, T) в начале и в конце процесса, удельные теплоту, работу изменения объема и внешнюю полезную работу, удельное изменение термодинамических функций состояния – внутренней энергии, энтальпии, энтропии. Изобразить процесс в диаграммах p – v и T – s. Теплоемкости воздуха 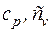 считать постоянными.
считать постоянными.
Решение
Начальный удельный объем воздуха находим из уравнения состояния, записанного для 1 кг газа (1.5) 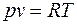 :
:
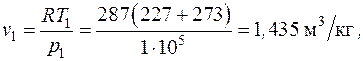
здесь газовая постоянная воздуха находится как
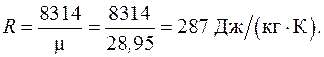
Таблица 6.1
Термодинамические процессы идеального газа
|
Величина
| Процессы
|
|
Политропный
| Адиабатный (изоэнтропный)

|
| Уравнение процесса
| 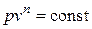
| 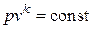
|
| Показатель политропы
|
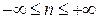
|
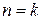
|
|
Связь начальных и конечных параметров
| 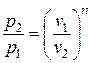 ; ; 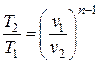 ; ;
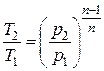
| 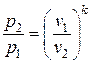 ; ; 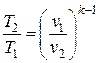 ; ;
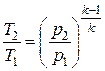
|
| Теплоемкость с
| 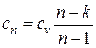
|
0
|
|
Удельная
работа
l
| 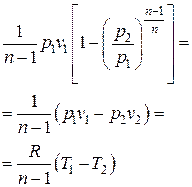
| 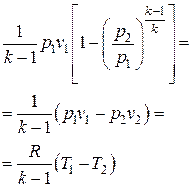
|
| Удельная внешняя работа l ¢
|
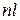
|
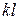
|
| Удельная теплота q
| 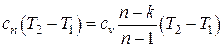
|
0
|
| Изменение удельной внутренней энергии D u
|

|
| Изменение удельной энтальпии D h
|
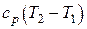
|
| Изменение удельной энтропии D s
|

|
0
|
| | | | |
Таблица 6.2
Термодинамические процессы идеального газа
Удельный объем воздуха в конце процесса находится из уравнения политропного процесса в p – v координатах:
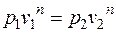 ;
;
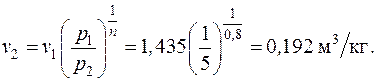
Температура воздуха в конце процесса находится из уравнения политропного процесса в p – T координатах:
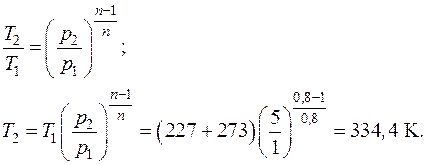
или из уравнения состояния идеального газа (1.5):
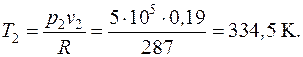
Теплоемкости 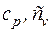 находятся по молекулярно-кинетической теории с использованием табл. 3.1 (воздух – двухатомный газ):
находятся по молекулярно-кинетической теории с использованием табл. 3.1 (воздух – двухатомный газ):
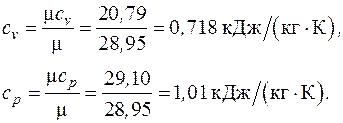
Формулы для расчета удельных количеств теплоты, работы изменения объема и внешней полезной работы, удельного изменения термодинамических функций состояния – внутренней энергии, энтальпии, энтропии берем из табл. 6.1. Показатель адиабаты для двухатомного газа 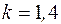 :
:
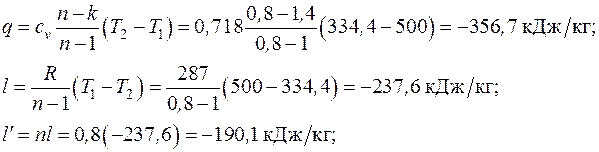
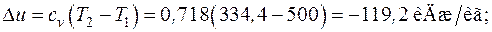
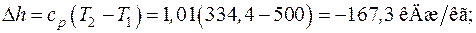
 Рассчитанный политропный процесс изобразим в диаграммах p – v и T – s (рис. 6.6)
Рассчитанный политропный процесс изобразим в диаграммах p – v и T – s (рис. 6.6)
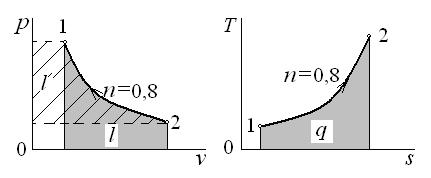
Рис. 6.6. К задаче 5.1
6.2. В закрытом сосуде объемом 0,6 м3 содержится воздух при давлении 5 бар и температуре 20 оС. В результате охлаждения сосуда от воздуха отводится 100 кДж теплоты. Принимая теплоемкость постоянной, определить конечное давление и температуру воздуха.
Ответ: 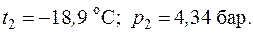
6.3. 1 кг воздуха сжимается адиабатически так, что его объем уменьшается в 6 раз, а затем в изохорном процессе давление воздуха увеличивается в 1,5 раза. Найти суммарное изменение энтропии газа.
Ответ: 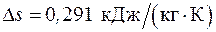 .
.
6.4. Воздух с абсолютным давлением 1,2 ат и температурой 60 оС сжимается политропно до абсолютного давления 6 ат. Показатель политропы n = 1,3. Начальный объем воздуха 0,4 м3. Определить конечные объем и температуру воздуха, полные работу и теплоту процесса, а также полное изменение термодинамических функций состояния – внутренней энергии, энтальпии, энтропии.
Ответ:
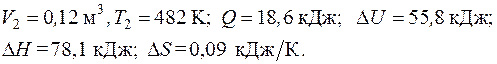
6.5. К 1 кг идеального двухатомного газа подведена теплота, численно равная



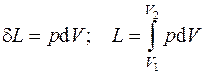 . (4.1)
. (4.1)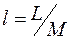 , Дж/кг. Для нее выражения (4.1) принимают вид:
, Дж/кг. Для нее выражения (4.1) принимают вид: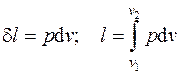 . (4.2)
. (4.2)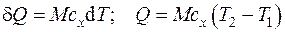 , (4.3)
, (4.3)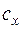 – теплоемкость вещества, определяемая по молекулярно-кинетической теории или как средняя теплоемкость в интервале температур
– теплоемкость вещества, определяемая по молекулярно-кинетической теории или как средняя теплоемкость в интервале температур 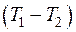 , индекс x – определяет характер процесса (
, индекс x – определяет характер процесса (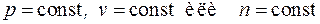 ) (см. разд. 3).
) (см. разд. 3).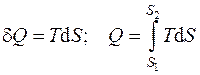 , (4.4)
, (4.4)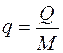 , Дж/кг и определяется как:
, Дж/кг и определяется как: , (4.5)
, (4.5)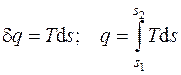 . (4.6)
. (4.6) ), и отрицательной, если она отводится от системы (энтропия в процессе отвода тепла уменьшается,
), и отрицательной, если она отводится от системы (энтропия в процессе отвода тепла уменьшается, 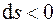 ).
).
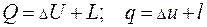 (4.7)
(4.7)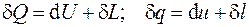 . (4.8)
. (4.8)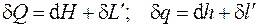 . (4.9)
. (4.9)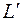 – полезная внешняя (располагаемая) работа, определяемая как
– полезная внешняя (располагаемая) работа, определяемая как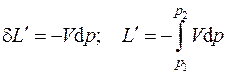 , (4.10)
, (4.10)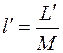 – удельная внешняя работа,
– удельная внешняя работа,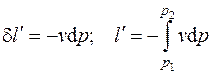 . (4.11)
. (4.11)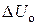 произойдет за счет уменьшения их кинетической энергии. Поскольку тела одинаковые и летят навстречу друг с другом с одинаковыми скоростями, то
произойдет за счет уменьшения их кинетической энергии. Поскольку тела одинаковые и летят навстречу друг с другом с одинаковыми скоростями, то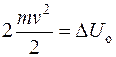 .
.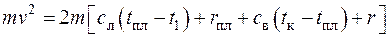 .
.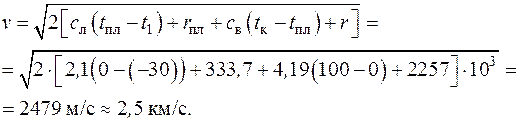
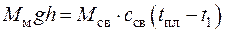 ,
,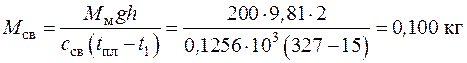 .
.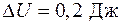 .
.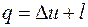 , отсюда
, отсюда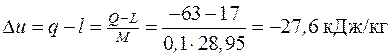 .
.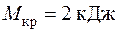 , частота вращения n = 1500 об/мин, а допустимое повышение температуры воды
, частота вращения n = 1500 об/мин, а допустимое повышение температуры воды 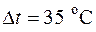 .
.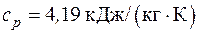 .
.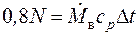 ,
,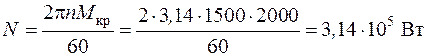 .
.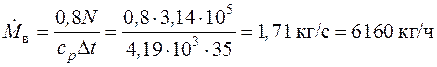 .
. .
.
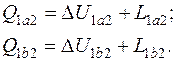
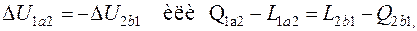

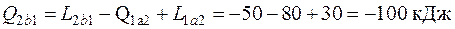 , причем теплота в процессе 2 b 1отводится (так как
, причем теплота в процессе 2 b 1отводится (так как  ).
).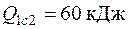 .
.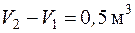 ?
?
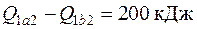 .
.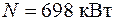 .
.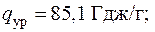
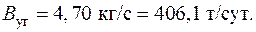
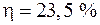 .
.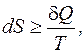 (5.1)
(5.1)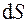 – бесконечно малое приращение энтропии системы;
– бесконечно малое приращение энтропии системы;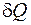 – бесконечно малое количество теплоты, полученное системой от источника теплоты.
– бесконечно малое количество теплоты, полученное системой от источника теплоты.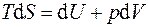 ; (5.2)
; (5.2)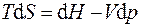 . (5.3)
. (5.3)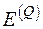 , Дж находится как
, Дж находится как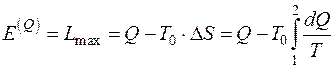 , (5.4)
, (5.4)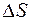 – изменение энтропии рабочего тела, Дж/К;
– изменение энтропии рабочего тела, Дж/К;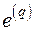 , Дж/К определяется как
, Дж/К определяется как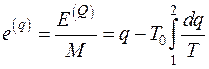 . (5.5)
. (5.5)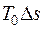 (площади, заштрихованной горизонтальными линиями).
(площади, заштрихованной горизонтальными линиями).
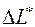 (эксергетические потери) за счет необратимости процессов, протекающих в системе, определяются по формуле Гюи-Стодолы
(эксергетические потери) за счет необратимости процессов, протекающих в системе, определяются по формуле Гюи-Стодолы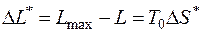 , (5.6)
, (5.6)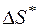 – полное приращение энтропии всех подсистем, входящих в данную систему.
– полное приращение энтропии всех подсистем, входящих в данную систему.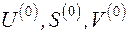 , то эксергия неподвижной термодинамической системы E определяется как
, то эксергия неподвижной термодинамической системы E определяется как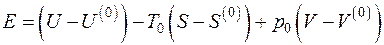 , (5.7)
, (5.7)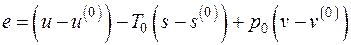 , (5.8)
, (5.8)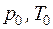 – параметры окружающей среды.
– параметры окружающей среды.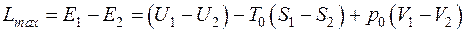 . (5.9)
. (5.9)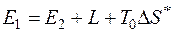 , (5.10)
, (5.10)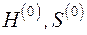 , то выражение для эксергии потока в форме Лагранжа
, то выражение для эксергии потока в форме Лагранжа 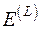 имеет вид
имеет вид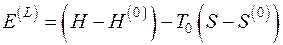 , (5.11)
, (5.11)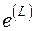 :
: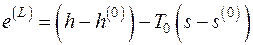 . (5.12)
. (5.12)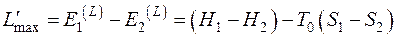 . (5.13)
. (5.13)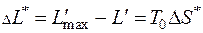 , (5.14)
, (5.14)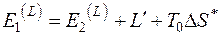 . (5.15)
. (5.15)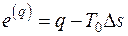 .
.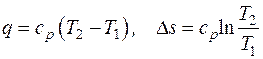 ,
,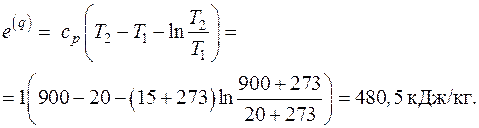
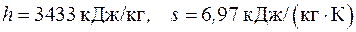 ;
; .
.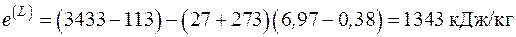 .
.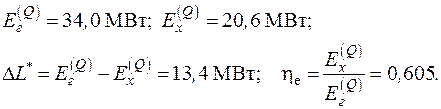
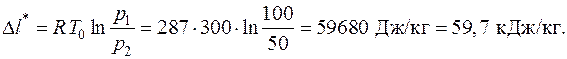
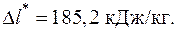
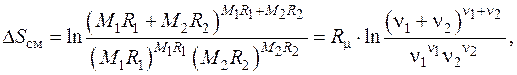
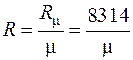 – газовая постоянная,
– газовая постоянная, 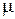 – молекулярная масса,
– молекулярная масса, 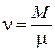 – число киломолей.
– число киломолей.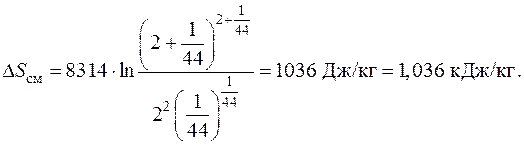
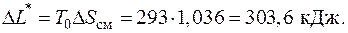
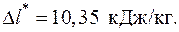
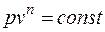 , (6.1)
, (6.1)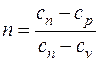 – показатель политропы;
– показатель политропы;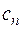 – теплоемкость политропного процесса.
– теплоемкость политропного процесса.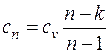 , (6.2)
, (6.2)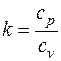 – показатель адиабаты (см. разд. 3).
– показатель адиабаты (см. разд. 3).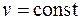 ), изобарный (
), изобарный (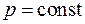 ), изотермический (
), изотермический (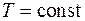 ), а также адиабатный – процесс без теплообмена с окружающей средой (
), а также адиабатный – процесс без теплообмена с окружающей средой (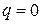 или, для обратимых процессов,
или, для обратимых процессов, 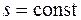 ). Основные формулы для расчетов работы, полезной внешней работы, теплоты процессов, а также изменения термодинамических функций состояния – внутренней энергии, энтальпии и энтропии – для идеального газа приведены в табл. 6.1.
). Основные формулы для расчетов работы, полезной внешней работы, теплоты процессов, а также изменения термодинамических функций состояния – внутренней энергии, энтальпии и энтропии – для идеального газа приведены в табл. 6.1.




 от давления 1 бар до давления 5 бар. Начальная температура воздуха 227 оС.
от давления 1 бар до давления 5 бар. Начальная температура воздуха 227 оС.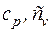 считать постоянными.
считать постоянными.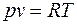 :
: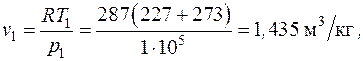
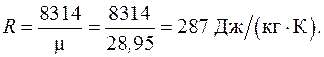

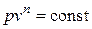
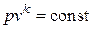
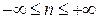
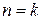
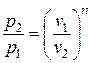 ;
; 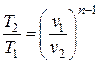 ;
;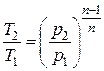
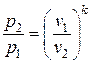 ;
; 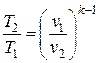 ;
;
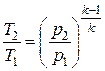
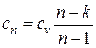
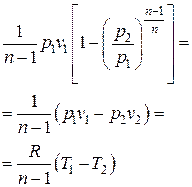
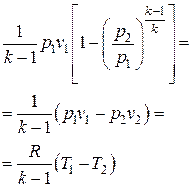
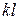
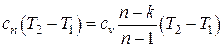

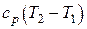

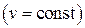
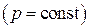
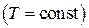
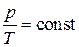
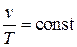
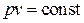
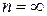
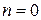
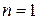
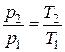
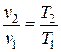
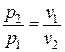
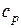
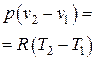
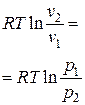

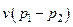
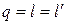
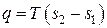
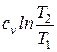
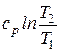
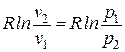
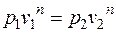 ;
;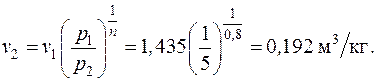
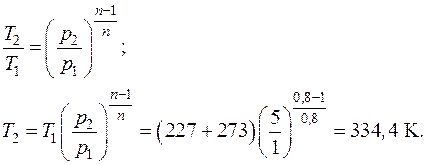
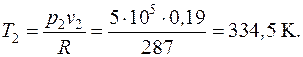
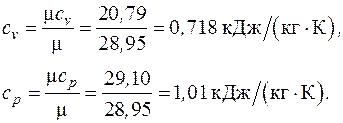
 :
: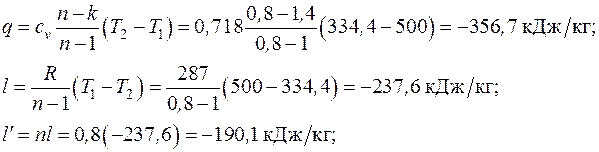
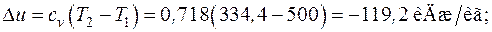
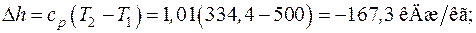
 Рассчитанный политропный процесс изобразим в диаграммах p – v и T – s (рис. 6.6)
Рассчитанный политропный процесс изобразим в диаграммах p – v и T – s (рис. 6.6)
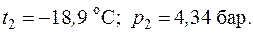
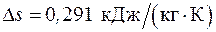 .
.