План занятия
1. Устный опрос и коррекция знаний студентов
2. Тестовый контроль
3. Лабораторная работа № 1
4. Подведение итогов занятия
Учебные элементы темы
Способность вещества вступать в химическую реакцию и реагировать с определенной скоростью называется реакционной способностью. Вещество, которое подвергается воздействию и в котором у атома углерода происходит разрыв старой и образование новой связи, является субстратом. Воздействующее соединение – реагентом.
Различают:
1. радикальные реагенты (радикалы) – это электронейтральные частицы (атомы или группы атомов) с не спаренным электроном.
2. электрофильные реагенты – это частицы с не полностью заполненным валентным электронным уровнем.
3. нуклеофильные реагенты – это частицы, имеющие электронную пару на внешнем электронном уровне.
I. В соответствии с природой реагента и характером разрыва связи в субстрате различают:
а) радикальные, гомолитические реакции, в которых действуют радикальные реагенты и происходит гомолитический разрыв связи в субстрате:

c убстрат реагент
б) ионные, гетеролитические реакции, в которых действуют ионные реагенты (нуклеофильные или электрофильные) и происходит гетеролитический разрыв связи в субстрате:
а)
электрофильные (Е):

субстрат реагент
б)
нуклеофильные (N):

субстрат реагент
В таких реакциях промежуточными частицами являются карбокатионы и карбанионы. При этом, если электронная пара переходит к атому углерода, то образуется карбанион – отрицательно заряженная частица с избытком электронов. Если же электронная пара переходит к атому Х (функциональная группа), то образуется карбокатион – положительно заряженная частица с недостатком электронов:

субстрат карбанион

субстрат карбокатион
в) синхронные или согласованные реакции, в которых разрыв старых связей и образование новых происходит одновременно и без участия радикальных или ионных (заряженных) частиц.
Такие реакции протекают при облучении или нагревании; для них теряют смысл понятия «субстрат» и «реагент»:
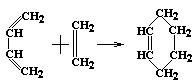
бутадиен-1,3 этилен циклогексен
II. По направлению с учетом конечного результата органические реакции делятся на:
а) реакции замещения (S): 1. радикального SR
2. ионного:
а) электрофильного SE
б) нуклеофильного SN
б) реакции присоединения (А): 1. радикального AR
2. ионного:
а) электрофильного AE
б) нуклеофильного AN
c) реакции отщепления или элиминирования (Е)
д) реакции перегруппировки, при которых происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому. Например, в результате перегруппировки изменяется углеродный скелет молекулы, и пентан превращается в изопентан.
е) реакции окисления и восстановления, при которых меняется степень окисления атома углерода, являющегося реакционным центром.
III. По числу молекул, участвующих в лимитирующей стадии, т.е. стадии, определяющей скорость всего суммарного процесса, различают: мономолекулярные, бимолекулярные и тримолекулярные реакции. Последние встречаются крайне редко.
Для веществ этого класса характерны реакции идущие по следующему механизму:
1. Реакции радикального замещения у насыщенного атома углерода (SR).
В насыщенных углеводородах (алканах и циклоалканах) имеются только SP3-гибридизованные атомы углерода. Для них характерны прочные неполярные С−С и почти неполярные С−Н δ-связи. Эти связи не склонны к гетеролитическому разрыву под действием электрофильных или нуклеофильных реагентов. Поэтому для насыщенных углеводородов характерны реакции радикального замещения (SR). Они протекают по свободно-радикальному механизму при участии высокоэнергетических радикалных частиц. Так идет галогенирование насыщенных углеводородов при облучении. Рассмотрим реакцию монохлорирования метана, которая идет по механизму радикального замещения (SR):
CH4 + Cl2 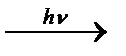 CH3Cl + HCl
CH3Cl + HCl
Приведенное уравнение отражает суммарный процесс, который включает несколько стадий:
1. Инициирование – гомолитический разрыв связи в реагенте под действием облучения, образование радикалов:
Cl 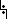 Cl → Cl• + Cl•
Cl → Cl• + Cl•
2. Рост цепи – атака радикалом молекулы субстрата; гомолитический разрыв связи С−Н в субстрате; образование новой молекулы и нового радикала:
CH3 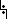 H + •Cl à CH3• + HCl
H + •Cl à CH3• + HCl
CH3• + Cl 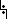 Cl à CH3Cl + Cl• и т.д.
Cl à CH3Cl + Cl• и т.д.
На каждой стадии роста цепи образуется продукт реакции и свободный радикал, который атакует новые молекулы, т.е. происходит цепная реакция.
3. Обрыв цепи возможен при взаимодействии двух любых радикалов:
Cl• + Cl• = Cl2; CH3• + Cl• = CH3Cl; CH3• + CH3• = C2H6
Галогенирование алканов, содержащих неэквивалентные количества атомов Н, происходит в соответствии с правилом региоселективности:









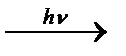 CH3Cl + HCl
CH3Cl + HCl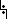 Cl → Cl• + Cl•
Cl → Cl• + Cl•


