Кафедра химии
ХИМИЯ
Учебно-методическое пособие
для подготовки к лабораторно-практическим занятиям
для студентов, обучающихся по специальностям
«Лечебное дело» (31.05.01); «Педиатрия» (31.05.02)
ТВЕРЬ
2018
УДК 54
ББК 24
Авторы-составители: Зубарева Г.М., Бордина Г. Е., Лопина Н.П., Волкова Л.Р.
Под общей редакцией профессора, док.биол.наук. Зубаревой Г.М.
Рецензенты:
Е.А. Харитонова – канд. биол. наук, доцент кафедры биологии ГБОУ ВПО Тверская ГМУ Минздрава России
Н.Ю. Колгина – канд. мед. наук, доцент кафедры фундаментальной фармакологии ГБОУ ВПО Тверская ГМУ Минздрава России
Учебно-методическое пособие утверждено ЦКМС ТГМУ
Химия. [Текст]: учебно-методическое пособие для подготовки к лабораторно-практическим занятиям и зачету для студентов, обучающихся по специальностям «Лечебное дело» (31.05.01); «Педиатрия» (31.05.02)./Зубарева Г.М., Лопина Н.П., Бордина Г.Е., Волкова Л.Р.// Под общей редакцией: Зубаревой Г.М. – Тверь: Ред.-издат. центр Твер. гос. мед. унив., 2018. – 72 с.
Учебно-методическое пособие составлено коллективом кафедры химии Тверского государственного медицинского университета и предназначено в помощь студентам, обучающихся по специальностям «Лечебное дело» (31.05.01); «Педиатрия» (31.05.02) для подготовки к лабораторно-практическим занятиям и зачету.
Авторы-составители – сотрудники кафедры химии Тверского государственного медицинского университета:
Галина Мефодьевна Зубарева – док. биол. наук, профессор кафедры химии
Надежда Петровна Лопина –канд. хим. наук, доцент кафедры химии
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
Лариса Рафаэльевна Волкова – ассистент кафедры химии
Модуль 1. Теоретические основы строения органических соединений и факторы, определяющие их реакционную способность.
Тема
Классификация, номенклатура органических соединений.
План занятия.
1. Регламентированная беседа
2. Подведение итогов занятия
Учебные элементы темы
1.Классификация органических соединений по строению углеродного скелета (углеродной цепи):
| ациклические
(алифатические)
|
| насыщенные
(предельные) алк ан ы
|
| ненасыщенные
(непредельные)
алк ен ы
алк ин ы
|
| цикл состоит из атома углерода
|
| цикл состоит из атомов углерода и атомов других элементов
|
2. Классификация по строению функциональной группы. Функциональные группы – это заместители неуглеводородного характера, определяющие принадлежность вещества к определенному классу и одновременно его типичные химические свойства.
В зависимости от природы функциональных групп производные углеводородов делят на классы, общие формулы и названия которых приведены в таблице (1):
Таблица 1. Функциональные группы и соответствующие классы соединений
| Функциональная группа
| Название класса
| Общая формула класса
|
| -F, -Cl, -Br, -I
(Hal) Галогены
|
Галогенпроизводные
| R-Hal
|
| - OH Гидроксильная
|
Спирты, фенолы
| R-OH
|
| - OR Алкоксильная
|
Простые эфиры
| R-OR
|
| - SH Тиольная
|
Тиолы (тиоспирты, меркаптаны)
| R-SH
|
| - SO 3 H Сульфоновая
|
Сульфокислоты
| R-SO 3
|
| - NH 2
>NH Амино
>N-
| Амины
| R-NH2
R2NH
R3N
|
| -NO 2 Нитро
|
Нитросоединения
| R-NO2
|
| >C=O
| Альдегиды, кетоны
| 

|
 Карбоксильная
Карбоксильная
| Карбоновые кислоты
| 
|
 Алкоксикарбонильная Алкоксикарбонильная
| Сложные эфиры
| 
|
 Карбоксамидная
Карбоксамидная
| Амиды
| 
|
Соединения с одной функциональной группой называют монофункциональными, соединения с несколькими одинаковыми функциональными группами – полифункциональными, соединения с несколькими разными функциональными группами – гетерефункциональными. Например,
Префиксы
Окончание
| | Корень
| Суффикс
|
| Младшие характеристические группы, неуглеродные характеристические группы и углеводородные радикалы в едином алфавитном порядке
| Главная цепь, основная циклическая или гетеро-циклическая структура
| Степень насыщенности –ан, –ен, –ин
| Только старшая характеристическая группа
|
Положение каждого заместителя и каждой кратной связи указывают цифрoй, соответствующей номеру aтомa углерода, c которым связан заместитель.
Таблица 2 Неуглеродные характеристические группы, указываемые только в приставках
| Группа
| Префикс
|
| -Br, -I, -F, -Cl
| Бром, йод, фтор, хлор
|
| -OR
| Алкокси
|
| -SR
| Алкилтио
|
| -NO2
| Нитро
|
Таблица 3. Порядок старшинства характеристических групп, указываемых и в приставке и в окончании
| Функциональная группа
| Префикс
| Окончание
|
| - COOH
| Карбокси
| овая кислота
|
| - SO3H
| Сульфо
| сульфоновая кислота
|
| - (C)=N
| -
| нитрил
|

|
Оксо
|
аль
|
| (C) = O
| Оксо
| он
|
| - OH
| Гидрокси
| ол
|
| - SH
| Меркапто
| тиол
|
| - NH2
| Амино
| амин
|
Некоторые примеры названий по заместительной
номенклатуре ИЮПАК:

3-гидроксибутановая кислота –
участник обменных процессов в организме

3,7-Диметилоктадиен-2,6-аль (цитраль)
– входит в состав препаратов, применяемых
для лечения заболеваний глаз
И З О М Е Р И Я ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Вещества, имеющие одинаковый состав молекул (одну и ту же молекулярную формулу), но различное химическое строение и обладающие, поэтому разными свойствами называются изомерами, а явление называется изомерией.
В и д ы и з о м е р и и
1. Изомерия углеродного скелета (для многих классов органических соединений).
Примеры:
С5Н12
 пентан
пентан
|

2,2 - диметилпропан
|
 2-метилбутан
2-метилбутан
|
С5Н11 – ОН
 пентанол – 1
пентанол – 1
| 
2,2 - диметилпропанол-1
|
 2 - метилбутанол-1
2 - метилбутанол-1
|
С5Н10
 пентен - 1
пентен - 1
|  2 - метилбутен - 1
2 - метилбутен - 1
|
2. Положение кратких связей (для алкенов, алкинов и диеновых)
| СН2 = СН – СН2 – СН3
| бутен - 1
|
| СН3 – СН = СН – СН3
| бутен - 2
|

| бутин - 1
|

| бутин – 2
|
3. Положение функциональной группы.
 пропанол-1
пропанол-1
|  пропанол – 2
пропанол – 2
|
 a- аминопропановая кислота
a- аминопропановая кислота
|  b- аминопропановая кислота
b- аминопропановая кислота
|
Тема
План занятия
1. Устный опрос и коррекция знаний студентов
2. Подведение итогов занятия
Учебные элементы темы
В органических молекулах двойная связь, являющаяся сочетанием одной σ и π связей, может располагаться локализовано между двумя углеродными атомами, а также между атомом углерода и гетероатомом /О, N, S/. Так как электронная плотность π-связи охватывает только два ядра связываемых атомов, связь называется локализованной, двухцентровой. Такие связи часто встречаются в природных соединениях, например, в ненасыщенных высших карбоновых кислотах.
Однако, особо большое значение в биологических процессах имеют сопряженные системы – соединения с чередующими двойными и одинарными связями. Образование сопряженной многоцентровой системы сопровождается:
1. частичным выравниванием длин связей (нет «чистых» одинарных и «чистых» двойных);
2. обобществлением p-электронов и делокализацией электронного облака. При этом происходит выделение энергии: система переходит на более низкий энергетический уровень, становясь более устойчивой и стабильной.
Мерой термодинамической устойчивости такой системы является энергия сопряжения, которая, выражается разностью полной π-электронной энергии несопряженной системы (с локализованными связями) и π-электронной энергии всей сопряженной системы. Чем длиннее цеп сопряжения, тем больше выигрыш энергии при её образовании. Различают сопряженные системы с открытой и замкнутой цепью; с π,π или p,π сопряжением; с углеродной цепью или цепью, содержащей гетероатом.
Тема
План занятия
1. Устный опрос и коррекция знаний студентов
2. Тестовый контроль
3. Лабораторная работа № 1
4. Подведение итогов занятия
Учебные элементы темы
Способность вещества вступать в химическую реакцию и реагировать с определенной скоростью называется реакционной способностью. Вещество, которое подвергается воздействию и в котором у атома углерода происходит разрыв старой и образование новой связи, является субстратом. Воздействующее соединение – реагентом.
Различают:
1. радикальные реагенты (радикалы) – это электронейтральные частицы (атомы или группы атомов) с не спаренным электроном.
2. электрофильные реагенты – это частицы с не полностью заполненным валентным электронным уровнем.
3. нуклеофильные реагенты – это частицы, имеющие электронную пару на внешнем электронном уровне.
I. В соответствии с природой реагента и характером разрыва связи в субстрате различают:
а) радикальные, гомолитические реакции, в которых действуют радикальные реагенты и происходит гомолитический разрыв связи в субстрате:

c убстрат реагент
б) ионные, гетеролитические реакции, в которых действуют ионные реагенты (нуклеофильные или электрофильные) и происходит гетеролитический разрыв связи в субстрате:
а)
электрофильные (Е):

субстрат реагент
б)
нуклеофильные (N):

субстрат реагент
В таких реакциях промежуточными частицами являются карбокатионы и карбанионы. При этом, если электронная пара переходит к атому углерода, то образуется карбанион – отрицательно заряженная частица с избытком электронов. Если же электронная пара переходит к атому Х (функциональная группа), то образуется карбокатион – положительно заряженная частица с недостатком электронов:

субстрат карбанион

субстрат карбокатион
в) синхронные или согласованные реакции, в которых разрыв старых связей и образование новых происходит одновременно и без участия радикальных или ионных (заряженных) частиц.
Такие реакции протекают при облучении или нагревании; для них теряют смысл понятия «субстрат» и «реагент»:
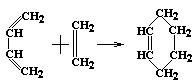
бутадиен-1,3 этилен циклогексен
II. По направлению с учетом конечного результата органические реакции делятся на:
а) реакции замещения (S): 1. радикального SR
2. ионного:
а) электрофильного SE
б) нуклеофильного SN
б) реакции присоединения (А): 1. радикального AR
2. ионного:
а) электрофильного AE
б) нуклеофильного AN
c) реакции отщепления или элиминирования (Е)
д) реакции перегруппировки, при которых происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому. Например, в результате перегруппировки изменяется углеродный скелет молекулы, и пентан превращается в изопентан.
е) реакции окисления и восстановления, при которых меняется степень окисления атома углерода, являющегося реакционным центром.
III. По числу молекул, участвующих в лимитирующей стадии, т.е. стадии, определяющей скорость всего суммарного процесса, различают: мономолекулярные, бимолекулярные и тримолекулярные реакции. Последние встречаются крайне редко.
Для веществ этого класса характерны реакции идущие по следующему механизму:
1. Реакции радикального замещения у насыщенного атома углерода (SR).
В насыщенных углеводородах (алканах и циклоалканах) имеются только SP3-гибридизованные атомы углерода. Для них характерны прочные неполярные С−С и почти неполярные С−Н δ-связи. Эти связи не склонны к гетеролитическому разрыву под действием электрофильных или нуклеофильных реагентов. Поэтому для насыщенных углеводородов характерны реакции радикального замещения (SR). Они протекают по свободно-радикальному механизму при участии высокоэнергетических радикалных частиц. Так идет галогенирование насыщенных углеводородов при облучении. Рассмотрим реакцию монохлорирования метана, которая идет по механизму радикального замещения (SR):
CH4 + Cl2 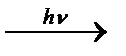 CH3Cl + HCl
CH3Cl + HCl
Приведенное уравнение отражает суммарный процесс, который включает несколько стадий:
1. Инициирование – гомолитический разрыв связи в реагенте под действием облучения, образование радикалов:
Cl 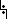 Cl → Cl• + Cl•
Cl → Cl• + Cl•
2. Рост цепи – атака радикалом молекулы субстрата; гомолитический разрыв связи С−Н в субстрате; образование новой молекулы и нового радикала:
CH3 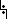 H + •Cl à CH3• + HCl
H + •Cl à CH3• + HCl
CH3• + Cl 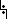 Cl à CH3Cl + Cl• и т.д.
Cl à CH3Cl + Cl• и т.д.
На каждой стадии роста цепи образуется продукт реакции и свободный радикал, который атакует новые молекулы, т.е. происходит цепная реакция.
3. Обрыв цепи возможен при взаимодействии двух любых радикалов:
Cl• + Cl• = Cl2; CH3• + Cl• = CH3Cl; CH3• + CH3• = C2H6
Галогенирование алканов, содержащих неэквивалентные количества атомов Н, происходит в соответствии с правилом региоселективности:
КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ
1. Что такое реакционная способность, субстрат, реагент?
2. Какие типы реагентов и способы разрыва ковалентной связи существуют?
3. Какие классификации органических реакций существуют?
4. Что называют реакциями радикального замещения: галогенирование алканов и циклоалканов?
5. Что называют цепными процессами? В чем заключается правило региоселективности?
6. Что называют реакциями электрофильного присоединения? В чем заключается правило Марковникова?
7. Что называют ароматическими углеводородами?
8. Как протекают реакции электрофильного замещения (галогенирование, нитрование, сульфирование, алкилирование, ацилирование аренов)?
9. В чем заключается влияние электронодонорных и электроноакцепторных заместителей на направление и скорость реакции электрофильного замещения?
10. Что называют ориентантами I и II рода?
11. Какие представители ароматических углеводородов вам известны (бензол, толуол, ксилол, стирол)?
Задания для самостоятельного решения
1. Приведите уравнение реакции бромирования пропана. Назовите и напишите механизм реакции.
2. Приведите уравнение реакции иодирования бутана. Назовите и напишите механизм реакции с получением дииодпроизводного бутана.
3. Приведите уравнение реакции фторирования изобутана. Назовите и напишите механизм реакции.
4. Приведите уравнение реакции хлорирования циклопропана. Назовите механизм реакции.
5. Приведите уравнение реакции нитрования гексана.
6. Приведите уравнение реакции бромирования пропана. Назовите и напишите механизм реакции с получением дибромпроизводного пропана.
7. Приведите уравнение реакции хлорирования изопропана. Назовите и напишите механизм реакции.
8. Запишите реакцию взаимодействия бензола с бромом. Опишите механизм реакции.
9. Проведите сульфирование бензола. Опишите механизм реакции.
10. Запишите реакцию нитрования толуола. Опишите механизм.
11. Проведите хлорирование толуола по механизму. Опишите механизм данной реакции.
12. Запишите реакцию взаимодействия нитробензола с Cl2. Опишите механизм реакции.
Тема.
Спирты и фенолы.
План занятия
1. Устный опрос и коррекция знаний студентов
2. Лабораторная работа №2
3. Подведение итогов занятия
Учебные элементы темы
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
Общая формула R - OH
Биологически активные представители спиртов:
Одноатомные:
СН3ОН — метанол — обладает наркотическим действием; крайне токсичен, т.к. в организме преобразуется в яды — формальдегид и муравьиную кислоту. Уже в небольших дозах (10 мл) может вызывать слепоту.
С2Н5ОН — этанол — естественный метаболит. В больших дозах оказывает опьяняющее и наркотическое действие. При этом воздействует на ЦНС вначале возбуждающе, а затем угнетающе, притупляя чувствительность, ослабляя функцию мозга и мышечной системы, ухудшая реакцию. Его длительное употребление приводит к алкоголизму. В медицине используется как антисептик и растворитель лекарственных средств.

| — ментол — относится к терпенам. Входит в состав сердечно—со-судистых средств, зубных порошков и паст.
|
В природе также встречаются первичные спирты с числом углеродных атомов от 6 до 30. Они входят в состав бактерий.
Многоатомные:
| глицерин — важнейший биогенный спирт. В виде сложных эфиров высших жирных кислот входит в состав жиров, а также фосфатидной кислоты — родоначальника большинства липидов биологических мембран. В медицине применяется как увлажнитель фармацевтических препаратов.
|
Н2С — СН — СН2 —
| | |
OH OH OH
| — миоинозит — шестиатомный спирт циклогексанового ряда. Содержится в почках, печени, мышцах, мозгу. Это—витаминоподобное соединение; является фактором роста, а также структурным компонентом ряда биорегуляторов биохимических процессов.
|

Наличие гидроксильных групп в молекуле повышает растворимость вещества в воде и увеличивает его токсичность и наркотическое действие. Эти свойства усиливаются с удлинением углеродной цепи, проходя через максимум при С6—С8; с разветвлением цепи, а также при переходе от первичных спиртов к вторичным и третичным. Присутствие галогенов или кратных связей в молекуле спирта тоже усиливает его наркотическое действие. Кроме того, причиной токсичности спиртов в организме могут служить продукты их метаболических превращений.
Фенол - производные ароматических углеводородов, содержащие одну или более гидроксильных групп.
Биологически активные представители фенолов:
ОН
|
одноатомный фенол — карболовая кислота — антисептик,
используется в производстве лекарственных средств.
Антисептические свойства фенола и этанола объясняются их склонностью к образованию водородных связей. Данные соединения способны разрушать гидратную оболочку вокруг белков за счет разрыва существующих и образования новых водородных связей с протоно- и электродонорными группами белков, что и приводит к их денатурации. Однако, пары фенола ядовиты, а его раствор может вызвать ожоги тканей, поэтому карболовая кислота используется для дезинфекции помещений, мебели, посуды и т.д.
Двухатомные фенолы:
ОН
ОН — пирокатехин (ортодигидроксибензол) — структурный
компонент катехоламинов (норадреналина и адреналина).
ОН
— резорцин (метадигидроксибензол) в составе примочек и
мазей используется для лечения кожных заболеваний.
ОН
ОН
— гидрохинон (парадигидроксибензол) — участник
дыхательной цепи переноса электронов:
ОН
Фенолы образуются в организме в результате метаболизма ароматических аминокислот. Присутствие ОН-группы в ароматическом ядре обуславливает антисептические свойства, поэтому многие фенолы оказывают бактерицидное действие; применяются как дезинфицирующие средства.
Контрольные вопросы по теме
1. Что называют спиртами и фенолами?
2. Какими кислотными свойства обладают спирты и фенолы?
3. По какому механизму протекают реакции в ряду гидроксисоединений?
4. Как записать уравнения внутри – и межмолекулярной дегидротации спиртов?
5.Какие продукты реакции образуются при окисление спиртов? Приведите примеры.
6. Какие фенолы называются одно-, двух- и трехатомные? Приведите примеры и их медико-биологическое значение.
ЗАДАНИЯ для I этапа зачёта
( Напишите структурные формулы следующих соединений )
Спирты
Одноатомные: метанол, этанол, пропанол-2, бутанол-2,пентанол-2,
пентанол-3.
Многоатомные: этандиол-1,2 (этиленгликоль), инозит (миоинозит), пропантриол-1,2,3 (глицерин).
Фенолы
Фенол (карболовая кислота), ортодигидроксибензол (пирокатехин), метадигидроксибензол (резорцин), парадигидроксибензол (гидрохинон), хинон.
Задания для самостоятельного решения
1. Окисление первичных и вторичных спиртов. Назвать продукты реакций по М.Н.
2. Качественная реакция на многоатомные спирты на примере пропантриола-1,2,3.
3. Уравнение реакции, подтверждающей наличие кислотных свойств у спиртов.
4. Уравнения реакций, подтверждающих наличие кислотных свойств у фенолов.
5. Образование простых и сложных эфиров.
6. Элиминирование (внутримолекулярная дегидратация) спиртов.
7. Реакция, конкурирующая с реакцией элиминирования спиртов. Назвать механизм, по которому она протекает.
Тема
Альдегиды. Кетоны
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Лабораторная работа №3
4. Подведение итогов занятия
Учебные элементы темы
Альдегиды и кетоны — это производные углеводородов, содержащие карбонильную группу > С=О, называемую также оксогруппой или карбонилом.
Общая формула альдегидов  и кетонов
и кетонов  .
.
Биологически активные представители альдегидов и кетонов:
Альдегиднаягруппа обуславливает наркотические и дезинфицирующие свойства соединений.
О
Н−С
Н - муравьиный альдегид или формальдегид свертывает белки. Используется в виде формалина для дезинфекции и консервирования анатомических препаратов. Производные формальдегида, например, уротропин, также обладают дезинфицирующими свойствами.
О
СН3−С
Н - уксусный альдегид – естественный метаболит в организме человека.
Cl OH
Cl− C − C − OH
Cl
H - хлоральгидрат – успокаивающее и снотворное средство. Наличие галогена усиливает специфическое действие альдегидной группы на организм, а гидратация карбонильной группы снижает токсичность вещества в целом.
СН3−С − СН3
O - ацетон – недоокисленный продукт обмена. Образуется в организме при некоторых заболеваниях, например, диабете. Используется в синтезах рзличных лекарственных препаратов.
α-галогензамещенные альдегиды и кетоны сильно раздражают слизистые оболочки носа и глаз. Они являются лакриматорами, входят в состав слезоточивых газов.
КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ
1 Что называют альдегидами и кетонами? Каково электронное строение оксогруппы?
2. Какой тип реакции характерен для альдегидов и кетонов? Приведите примеры и запишите механизм реакции в ряду альдегидов и кетонов.
4. Как образуются открытые полуацетали и ацетали? Напишите уравнения химических реакций.
5. Как протекают реакции восстановления и окисления альдегидов?
6. Какая реакция у альдегидов и кетонов идет одновременно по механизму присоединение-отщепления?
7. Что называется кето-енольной таутомерией? Приведите примеры.
8. Какой механизм реакции альдольной и кротоновой конденсации?
9. Как протекают галоформные реакции?
ЗАДАНИЯ для I ЭТАПА зачёта
( Напишите структурные формулы следующих соединений )
Альдегиды
Метаналь (муравьиный альдегид, формальдегид), этаналь (уксусный альдегид, ацетальдегид), пропаналь, бутаналь, 3-метил-бутаналь, 2,2-диметилбутаналь,
2-метилпентаналь.
Кетоны
Пропанон-2 (ацетон), бутанон-2, пентанон-3.
Задания для самостоятельного решения
1. Взаимодействие альдегидов и кетонов с водой. Назвать механизм реакции.
2. Взаимодействие альдегидов и кетонов с цианводородной кислотой. Назвать механизм реакции.
3. Взаимодействие альдегидов и кетонов с первичными аминами (метиламином). Назвать механизм реакции.
4. Образование полуацеталей и ацеталей.
5. Альдольная конденсация.
6. Кето-енольная таутомерия на примере альдегида.
7. Галоформная реакция на примере этаналя.
8. Окисление альдегидов. Назвать продукт реакции по М.Н.
9. Восстановление альдегидов и кетонов. Назвать продукт реакции по Международной номенклатуре.
Тема
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Лабораторная работа 4
4. Подведение итогов занятия
УЧЕБНЫЕ ЭЛЕМЕНТЫ ТЕМЫ
Карбоновые кислоты - это производные углеводородов, в которых один или более атомов замещены карбоксильной группой  :
:
Общая формула карбоновых кислот: 
Представители монокарбоновых кислот:
насыщенные:
O
H−C
OH - метановая /муравьиная/ кислота. Содержится в крапиве и выделениях муравьёв. При попадании на кожу вызывает ожоги.
O
H3C−C
OH - этановая /уксусная/ кислота - естественный метаболит, продукт уксуснокислого брожения сахаров. В медицине используется в виде солей.
O
H3C−CH2−CH2−C
OH -бутановая /масляная/ кислота. Имеет неприятный запах, содержится в поте.
ненасыщенные:
-простейшим представителем ненасыщенных монокарбоновых кислот является пропеновая /акриловая/ кислота. Её эфиры используются в производстве пластмасс для медицинского приборостроения.
Оксокислоты- это соединения, содержащие одновременно карбоксильную и карбонильную группы. Различают:
альдегидокислоты:
 - глиоксиловая кислота, содержится в недозрелых фруктах
- глиоксиловая кислота, содержится в недозрелых фруктах
кетонокислоты:
 - пировиногдадная кислота
- пировиногдадная кислота
 - ацетоуксуснаая кислота
- ацетоуксуснаая кислота
 - щавелевоуксусная кислота
- щавелевоуксусная кислота
 - α-кетоглутаровая кислота
- α-кетоглутаровая кислота
Кетонокислоты играют важную роль в биохимических процессах.
Пировиноградная, щавелевоуксусная, α-кетоглутаровая кислоты участвуют в цикле трикарбоновых кислот. При их переаминировании образуются соответствующие α- аминокислоты. Пировиноградная кислота – промежуточный продукт молочнокислого и спиртового брожения углеводов. Ацетоуксусная кислота образуется в организме в процессе метаболизма высших жирных кислот и при окислении β- гидроксимасляной кислоты. Вместе с продуктами превращений она накапливается в организме у больных сахарным диабетом / ацетоновые или кетоновые тела/.
Гидрокикислоты – соединения, содержащие одновременно карбоксильную и гидроксильную группы.
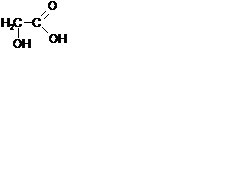 - 2-гидроксиэтановая /гликолевая/ кислота. Содержится во многих растениях, свекле, винограде.
- 2-гидроксиэтановая /гликолевая/ кислота. Содержится во многих растениях, свекле, винограде.
 - 2-гидроксипропановая кислота /молочная/. Продукт молочнокислого брожения в организме. При интенсивной работе накапливается мышцах, вызывая характерную боль.
- 2-гидроксипропановая кислота /молочная/. Продукт молочнокислого брожения в организме. При интенсивной работе накапливается мышцах, вызывая характерную боль.
 -β-гидроксимасляная кислота или 3-гидроксибутановая. Промежуточный продукт окисления жирных кислот; предшественник ацетоуксусной кислоты. Накапливается в организме у больных сахарным диабетом.
-β-гидроксимасляная кислота или 3-гидроксибутановая. Промежуточный продукт окисления жирных кислот; предшественник ацетоуксусной кислоты. Накапливается в организме у больных сахарным диабетом.
 - γ-гидроксимасляная кислота /ГОМК/ или 4-гидроксибутановая. Оказывает наркотическое действие. Применяется в виде натриевой соли как снотворное, а также в качестве неингаляционного наркотического средства в анестезиологии.
- γ-гидроксимасляная кислота /ГОМК/ или 4-гидроксибутановая. Оказывает наркотическое действие. Применяется в виде натриевой соли как снотворное, а также в качестве неингаляционного наркотического средства в анестезиологии.
Контрольные вопросы по теме
1.Что называют карбоновыми кислотами? Каково электронное строение карбоксильной группы?
2. По какому механизму протекают реакции в карбоновых кислотах (образование хлорангидридов, ангидридов, амидов, сложных эфиров, ацилглицеринов (глицеридов))?
3. Какие специфические реакций характерны для дикарбоновых кислот: декарбоксилирование и образование циклических ангидридов?
4. Что называют оксокислотми? Приведите примеры.
5. Что называют гидроксикислотми? Приведите примеры. Каково их медикобиологическое значение? Какие специфические реакции характерны для гидроксикислот?
6. Каковы основные понятия стереоизомерии (асимметрический атом углерода, энантиомеры, диастереомеры, рацемат)? Проекционные формулы Фишера; относительная и абсолютная конфигурации. Нарисуйте энантиомеры молочной кислоты, изомеры L и Д-ряда.
ЗАДАНИЯ для I ЭТАПА зачёта
( Напишите структурные формулы следующих соединений )
Карбоновые кислоты
Монокарбоновые: метановая (муравьиная), этановая (уксусная), пропеновая, бутановая (масляная), пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая, арахидоновая.
Дикарбоновые: этандиовая (щавелевая), пропандиовая (мало-новая), бутандиовая (янтарная), пентандиовая (глутаровая), бутендиовая (фумаровая, малеиновая).
Трикарбоновые: лимонная.
Оксокислоты
Альдегидокислоты: глиоксиловая.
Кетонокислоты: 2-оксопропановая (пировиноградная), 3-оксо-бутановая (ацетоуксусная), 2-оксобутандиовая (щавелевоуксусная), 2-оксопентандиовая (a-кетоглутаровая).
Гидроксикислоты
2-гидроксиэтановая (гликолевая), 2-гидроксипропановая (молочная), 3-гидроксибутановая (b-гидроксимасляная), 4-гидроксибутано-вая (g-гидроксимасляная, ГОМК).





 Карбоксильная
Карбоксильная

 Алкоксикарбонильная
Алкоксикарбонильная

 Карбоксамидная
Карбоксамидная




 пентан
пентан

 2-метилбутан
2-метилбутан
 пентанол – 1
пентанол – 1

 2 - метилбутанол-1
2 - метилбутанол-1
 пентен - 1
пентен - 1
 2 - метилбутен - 1
2 - метилбутен - 1


 пропанол-1
пропанол-1
 пропанол – 2
пропанол – 2
 a- аминопропановая кислота
a- аминопропановая кислота
 b- аминопропановая кислота
b- аминопропановая кислота






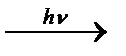 CH3Cl + HCl
CH3Cl + HCl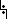 Cl → Cl• + Cl•
Cl → Cl• + Cl•

 и кетонов
и кетонов  .
. :
: 
 - глиоксиловая кислота, содержится в недозрелых фруктах
- глиоксиловая кислота, содержится в недозрелых фруктах - пировиногдадная кислота
- пировиногдадная кислота - ацетоуксуснаая кислота
- ацетоуксуснаая кислота  - щавелевоуксусная кислота
- щавелевоуксусная кислота  - α-кетоглутаровая кислота
- α-кетоглутаровая кислота - 2-гидроксиэтановая /гликолевая/ кислота. Содержится во многих растениях, свекле, винограде.
- 2-гидроксиэтановая /гликолевая/ кислота. Содержится во многих растениях, свекле, винограде. - 2-гидроксипропановая кислота /молочная/. Продукт молочнокислого брожения в организме. При интенсивной работе накапливается мышцах, вызывая характерную боль.
- 2-гидроксипропановая кислота /молочная/. Продукт молочнокислого брожения в организме. При интенсивной работе накапливается мышцах, вызывая характерную боль. -β-гидроксимасляная кислота или 3-гидроксибутановая. Промежуточный продукт окисления жирных кислот; предшественник ацетоуксусной кислоты. Накапливается в организме у больных сахарным диабетом.
-β-гидроксимасляная кислота или 3-гидроксибутановая. Промежуточный продукт окисления жирных кислот; предшественник ацетоуксусной кислоты. Накапливается в организме у больных сахарным диабетом. - γ-гидроксимасляная кислота /ГОМК/ или 4-гидроксибутановая. Оказывает наркотическое действие. Применяется в виде натриевой соли как снотворное, а также в качестве неингаляционного наркотического средства в анестезиологии.
- γ-гидроксимасляная кислота /ГОМК/ или 4-гидроксибутановая. Оказывает наркотическое действие. Применяется в виде натриевой соли как снотворное, а также в качестве неингаляционного наркотического средства в анестезиологии.


