Если в электрохимическом процессе на электродах выделяются газообразные вещества, то их объем для конкретных условий (давление и температура) можно рассчитать, пользуясь соотношением:
V =  ,
,
где ν – количество вещества, моль;
R – газовая постоянная (8.31 Дж/моль·К);
T – абсолютная температура (К);
р – давление (Па).
Поскольку 1 Дж = кг · м2/с2, а 1 Па = 1 кг/(м·с2), то при использовании формулы V =  объем газа будет выражен в м3.
объем газа будет выражен в м3.
Для выражения давления газа могут быть использованы разные единицы, соотношение между которыми составляет:
1 атм = 760 мм ртутного столба = 101 325 Па.
Упражнения и задачи
1. Рассчитайте массу меди и объем хлора, которые выделятся на электродах при прохождении через электролизер 2 Ф количества электричества. Выход по току считать равным 100%.
(Ответ: 63,5 г; 22,4 дм3).
2. При прохождении через электролизер 144750 Кл электричества на аноде выделилось 7,5 дм3 кислорода. Рассчитайте выход кислорода по току.
(Ответ89,3 %).
3. Электролиз 400 г 8,5%-го раствора нитрата серебра продолжали до тех пор, пока масса раствора не уменьшилась на 25 г. Вычислите массовые доли веществ, выделившихся на инертных электродах.
(Ответ: 21,6 г Ag и 0,2 г Н2; 3,2 г О2)
4. Выполните расчеты и заполните таблицу:
| Показатель
| Формула вещества, находящегося в растворе
|
| NaCl
| CuSO4
| AgNO3
| K2SO4
|
| Молярная масса эквивалентов, г/моль
|
|
|
|
|
| Сила тока, А
| 5
| 0,1
| 0,5
| 2
|
| Время электролиза, с
|
| 6000
|
|
|
| Количество электричества, Кл
| 48250
|
|
| 10000
|
| Масса, вещества, выделившегося на катоде, г
|
|
| 1,7
|
|
| Масса, вещества, выделившегося на аноде, г
|
|
|
|
|
| Уравнение катодной реакции
|
|
|
|
|
| Уравнение анодной реакции
|
|
|
|
|
| Электрохимический эквивалент, г/Кл
|
|
|
|
|
| Выход по току, %
| 100
| 95
| 100
| 85
|
5. Сколько молекул водорода выделится на катоде при электролизе раствора серной кислоты, если сила тока в цепи составляет 0,01 А, а время электролиза 20 минут. Выход по току считать равным 100%.
(Ответ: 3,76·1019).
6. При пропускании тока через 0,5 молярный раствор сульфата меди, содержание меди в растворе уменьшилась на 20 %. Какое количество электричества было затрачено на электролиз, если объем раствора в электролизере составлял 200 см3? Выход по току считать равным 100%.
(Ответ:3860 Кл).
7. При прохождении через электролизер 144750 Кл электричества на аноде выделилось 7,5 дм3 кислорода. Рассчитайте выход кислорода по току.
(Ответ89,3 %).
8. Рассчитайте электрохимические эквиваленты (мг/Кл) алюминия, кадмия, кислорода в следующих реакциях:
а) Al3+ + 3e = Al
б) Zn2+ + 2e = Zn
в) O2- – 2е = 1/2O2
(Ответ: а: 0,032; б: 0,329; в: 0,0829)
9. Какое количество электричества необходимо затратить для выделения 50 дм3 хлора из хлорида натрия (условия стандартные)?
(Ответ: 4,46 Ф)
10. Рассчитайте массу металлического никеля, выделяющегося на катоде при электролизе раствора NiSO4, если сила тока составляла 0,5 А, время электролиза – 30 минут, выход по току – 85%.
(Ответ: 233 мг)
11. Рассчитайте время, необходимое для выделения на катоде 10 г свинца из раствора нитрата свинца, если сила тока в цепи составляет 5 А, а выход по току – 68%.
(Ответ: 45,7 минут).
12. Сколько граммов PbO2 образуется на аноде при электролизе раствора нитрата свинца в кислой среде током силой 0,2 А в течение 60 мин?
(Ответ: 0,8924 г).
13. Сколько времени потребуется для полного выделения никеля из 50 мл 2%-го раствора NiSO4⋅7H2O (плотность раствора 1,01 г/см3) методом электролиза, если сила тока в цепи составляет 0,3 А, а выход по току 90 %? (Ответ: 42 мин 50 с).
14. Электролизу подвергли раствор, содержащий 19 г хлорида двухвалентного металла, при этом на аноде выделилось 8,96 л хлора, а на катоде выделялся водород. Хлорид какого металла находился в растворе? Вычислите объем водорода, выделившегося на катоде.
(Ответ: MgCl2, 8,96 дм3 Н2).
15. При электролизе водного раствора хлорида цинка на катоде выделилось 68,25 г цинка, а на аноде 28,22 дм3 хлора (н.у.). Определите выход по току цинка, если выход по току хлора составил 90%.
(Ответ: 75 %).
16. В электролизер налили 300 см3 раствора гидроксида калия (массовая доля КОН в растворе – 22,4%, плотность раствора – 1,2 г/см3). Электролиз закончили, когда на катоде выделилось 89,6 дм3 водорода (н.у.). Рассчитайте массовую долю КОН в растворе после завершения электролиза.
(Ответ: 28%).
4.5. Контрольные вопросы
1. Что такое электролиз?
2. Что такое сила тока?
3. Что такое количество электричества?
4. В каких единеицах измеряется электрический заряд?
5. Сформулируйте первый закон Фарадея.
6. Сформулируйте первый закон Фарадея.
7. Сформулируйте второй закон Фарадея.
8. Напишите формулу объединенного закона Фарадея.
9. Каков физический смысл постоянной Фарадея?
10. На чем основан метод кулонометрии?
11. Какие типы кулонометров нашли наибольшее практическое применение?
12. На чем основано кулонометрическое титрование?
13. Что такое выход по току?
14. Почему выход по току может быть ниже 100 %.
15. В каких случаях выход по току может оказаться выше 100 %?
16. Какие причины вызывают отклонения от законов Фарадея?
17. Чем определяется порядок разряда катионов при их совместном присутствии в растворе?
18. Какие металлы нельзя получить электролизом растворов их солей?
19. Какие продукты получаются на электродах при электролизе воды?
20. Какие электролиты можно использовать для электролиза воды?
21. Почему для разложения воды электрическим током используют не чистую воду, а соответствующий раствор электролита?
22. Какие электролиты нельзя использовать для электролиза воды?
23. Какие продукты получаются при электролизе растворов щелочей?
ВОПРОСЫ ПРИКЛАДНОЙ ЭЛЕКТРОХИМИИ
Содержание темы
Химические источники тока, аккумуляторы, топливные элементы. Принцип работы первичных ХИТ. ЭДС ХИТ и напряжение разомкнутой цепи. Поляризация элемента. Рабочее напряжение ХИТ. Вольтамперная характеристика. Разрядная характеристика. Емкость ХИТ. Параллельное и последовательное соединение ХИТ. Особенности ХИТ с водными электролитами. Общие требования к ХИТ. Марганцево-цинковые, воздушно-цинковые, медно-цинковые, ртутно-цинковые, серебряно-цинковые элементы. Первичные литиевые источники тока.
Вторичные ХИТ. Свинцовые, никель-кадмиевые, никель-железные, никель-металлогидридные, литиевые аккумуляторы. Марганцево-цинковые перезаряжаемые ХИТ. Перспективные разработки в области ХИТ.
Коррозия металлов. Общая классификация коррозионных процессов и видов коррозии металлов. Явления на границе раздела фаз металл-электролит. Характеристика электрохимического коррозионного процесса. Термодинамика и механизм электрохимической коррозии металлов. Кинетика электрохимической коррозии. Анодные и катодные реакции. Анодное растворение металлов. Коррозионный процесс с водородной деполяризацией. Коррозионный процесс с кислородной деполяризацией. Понятие о диаграмме Пурбэ. Зависимость скорости коррозии от состава раствора. Скорость коррозии металлов в нейтральных растворах, в кислотах, в промышленной атмосфере, в щелочах. Коррозия металлов в природных и технологических средах. Роль процессов и продуктов в защите металлов от коррозии. Пассивность металла. Пассиваторы и активаторы. Методы защиты металлов от электрохимической коррозии. Электрохимическая защита металлов и обработка коррозионной среды. Покрытия на металлах и методы их нанесения. Электрохимические методы противокоррозионной защиты металлов защитные среды. Катодная защита. Протекторная защита. Анодная защита. Изменение состава среды как метод противокоррозионной защиты. Ингибиторная защита.
Материал для повторения
Таблица 5.1
| Предмет
| Тема
| Вопросы для повторения
|
| Общая химия
| Прикладная электрохимия
| Электролиз в промышленности. Химические источники тока. Аккумуляторы. Коррозия металлов. Методы защиты от коррозии.
|
| Физика
| Электричество и магнетизм
| Источники тока. Эдс. Закон Ома для неоднородного (содержащего ЭДС)
участка цепи.
|
Основные понятия и соотношения по изучаемой теме, используемые при решении задач
Таблица 5.2
| Понятие
| Определение, примеры
|
| 1
| 2
|
| Водородная деполяризация
| Катодная реакция восстановления ионов водорода:
Н+ + е = ½Н2
|
| Коррозия металлов с водородной деполяризацией
| Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией.
Катодное выделение водорода может быть обусловлено протекание следующих реакций восстановления:
Н3O+ + 2e → 2H2O + H2
2H2O + 2e → 2OH− + H2
|
| Потенциал водородного электрода φ(Н+|Н2)
| Для температуры 298 К:
φ(Н+|Н2) = φо(Н+|Н2) + 0,059 lg  При парциальном давлении водорода Р(Н2) = 1 атм, потенциал водородного электрода равен:
φ(Н+|Н2) = – 0,059рН
При парциальном давлении водорода Р(Н2) = 1 атм, потенциал водородного электрода равен:
φ(Н+|Н2) = – 0,059рН
|
Продолжение таблицы 5.2
| 1
| 2
|
| Кислородная деполяризация
| Катодная реакция восстановления (ионизации) кислорода:
О2 + 4е = 2О2–
(О2– входит в состав ОН– или Н2О)
|
| Коррозия металлов с кислородной деполяризацией
| Коррозию металлов, при которой на катоде происходит восстановление кислорода, называют коррозией металлов с кислородной деполяризацией.
Катодное выделение кислорода может быть обусловлено протекание следующих реакций восстановления:
О2 + 2H2O + 4e → 4OH− (в нейтральной и щелочной среде)
O2 + 4H+ + 4e = H2O (в кислой среде)
|
| Потенциал кислородного электрода в кислой среде
| O2 + 4H+ + 4e = H2O
Для температуры 298 К:
φ(О2|Н2О) = φо(О2|Н2О) +  lg lg  ,
где Р(О2) – парциальное давление кислорода;
а(Н+) – активность ионов Н+ в электролите;
а(Н2О) – активность воды.
В ходе реакции а(Н2О) практически не изменяется, поэтому ее можно ввести в φо, тогда уравнение принимает вид:
φ(О2|Н2О) = 1,23 + 0,0147 lg Р(О2) + 0,059 lg а(Н+).
При Р(О2) = 1 атм, уравнение упрощается:
φ(О2|Н2О) = 1,23 – 0,059 рН
В атмосферном воздухе содержание кислорода составляет 21%, т.е. парциальное давление кислорода = 21000Па.
Тогда:
j (О2|ОН–) = jо(О2|ОН–) – 0,059рН + ,
где Р(О2) – парциальное давление кислорода;
а(Н+) – активность ионов Н+ в электролите;
а(Н2О) – активность воды.
В ходе реакции а(Н2О) практически не изменяется, поэтому ее можно ввести в φо, тогда уравнение принимает вид:
φ(О2|Н2О) = 1,23 + 0,0147 lg Р(О2) + 0,059 lg а(Н+).
При Р(О2) = 1 атм, уравнение упрощается:
φ(О2|Н2О) = 1,23 – 0,059 рН
В атмосферном воздухе содержание кислорода составляет 21%, т.е. парциальное давление кислорода = 21000Па.
Тогда:
j (О2|ОН–) = jо(О2|ОН–) – 0,059рН + 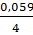 lg lg  =
= jо(О2|ОН–) – 0,059рН – 0,01 =
= jо(О2|ОН–) – 0,059рН – 0,01
|
Продолжение таблицы 5.2
| 1
| 2
|
| Потенциал кислородного электрода в нейтральной и щелочной среде
| Электродная реакция: О2 + 2H2O + 4e → 4OH−
Для температуры 298 К:
φ(О2|ОН–) = φо(О2|ОН–)  lg lg 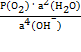 ,
где Р(О2) – парциальное давление кислорода;
а(ОН–) – активность ионов ОН– в электролите = ,
где Р(О2) – парциальное давление кислорода;
а(ОН–) – активность ионов ОН– в электролите =  Поскольку активность воды не изменяется, выражение можно записать следующим образом:
φ(О2|ОН–) = φо(О2|ОН–) + 0,0147 lg Р(О2) – 0,0147 lg а4(ОН–)
φ(О2|ОН–) = 1,23 + 0,0147 lg р(О2) – 0,059рН
При Р(О2) = 1 атм, уравнение упрощается: φ(О2|Н2О) = 1,23 – 0,059 рН
Поскольку активность воды не изменяется, выражение можно записать следующим образом:
φ(О2|ОН–) = φо(О2|ОН–) + 0,0147 lg Р(О2) – 0,0147 lg а4(ОН–)
φ(О2|ОН–) = 1,23 + 0,0147 lg р(О2) – 0,059рН
При Р(О2) = 1 атм, уравнение упрощается: φ(О2|Н2О) = 1,23 – 0,059 рН
|
| Потенциал разложения
| Наименьшая разность потенциалов, необходимая для проведения электролиза, называется потенциалом разложения (jр).
jр = jox|red + η, где
jox|red – равновесный электродный потенциал;
η – перенапряжение.
За счет перенапряжения потенциал катодного процесса смещается в область более отрицательных значений, а потенциал анодного – в область более положительных.
|
| Порядок реализации катодных реакций
| На катоде (при заданной плотности тока) в первую очередь будет протекать та реакция, которая имеет более положительное значение потенциала разложения.
|
| Потенциал разложения воды
| Теоретическое значение потенциала электролиза воды составляет 1,23 В, однако благодаря перенапряжению электролиз воды начинается при более положительных значениях потенциала (~1,8 В).
Потенциал, при котором начинается электролиз воды можно рассчитать по формуле:
jр = 1,23 + η,
где η – перенапряжение.
|
Окончание таблицы 5.3
| 1
| 2
|
| Расчет энергии Гиббса гальванических элементов
| ΔG = –nFE,
где ΔG – изменение энергии Гиббса;
n – число электронов, участвующих в реакции;
F – постоянная Фарадея;
E – ЭДС элемента
|
Примеры решения задач
Пример 1. Свинцовый катод погружен в подкисленный раствор соли свинца. Активности катионов Pb2+ и Н+ в растворе равны 1 моль(экв)/дм3, температура электролита = 298К. Выполните расчеты и определите, какая реакция будет проходить на катоде, если перенапряжение восстановления Pb2+ на свинцовом катоде равно нулю.
Решение
Для того, чтобы решить задачу, необходимо рассчитать потенциалы разложения для возможных катодных реакций: jр = jox|red + η
На катоде возможны реакции восстановление катионов Pb2+ или Н+:
2Н+ + 2е = Н2 (1)
Рb2+ + 2e = Pb (2)
По условию задачи, свинцовый катод находится в стандартных условиях, следовательно равновесные jox|red = jоox|red.
Рассчитываем jр для первой и второй реакции:
jр 1 = jон+|н2 + ηн+|н2
jр 2 = jоРb2+|Рb + ηРb2+|Рb
Значения jо и ηн+|н2 для свинцового электрода берем из таблиц 1 и 2 приложения и выполняем расчеты:
jр 1 = 0 В + (–1,05) В = –1,05 В
jр 2 = –0,126 В + 0 В = –0,126 В
Значение jр1 более положительно, чем jр2, значит на свинцовом электроде будут в первую очередь восстанавливаться катионы Рb2+.
Пример 2. Два контактирующих между собой металла (медь и кобальт) находятся в растворе, рН которого = 3, температура 287К. Какой из металлов в данных условиях будет катодом, а какой анодом? Напишите уравнения реакций, которые будут протекать на катоде и аноде. Рассчитайте ЭДС и энергию Гиббса этого элемента.
Решение:
1.Сравниваем значения стандартных электродных потенциалов кобальта и меди:
φо(Co2+|Co) = – 0,250 В
φо(Cu2+|Cu) = + 0,337 В.
Электродный потенциал кобальта имеет более отрицательное значение, значит кобальт, контактирующий с медью в присутствии электролита, будет являться анодом, а медь – катодом. В кислой среде на катоде будет протекать реакция восстановления катионов Н+ (водородная деполяризация).
2. Уравнения электродных реакций:
На аноде (–): Co – 2е = Co2+
На катоде (+): 2Н+ + 2е = Н2
3. Рассчитываем потенциал водородного электрода при рН = 2
φ(Н+|Н2) = – 0,059рН = – 0,059·2 = – 0,118 В.
4. Рассчитываем ЭДС (Е) элемента по формуле Е = φк – φа
Е = – 0,118 В – (– 0,250 В) = 0,132 В
4. Рассчитываем изменение энергии Гиббса (Δ G) элемента по формуле:
ΔG = –nFE
ΔG = –2·96500 · 0,132 = –25476 Дж/моль
Пример 3. Рассчитайте потенциал кислородного электрода при рН = 7 и парциальном давлении О2 соответствующем атмосферному воздуху.
Решение:
j (О2|ОН–) = jо(О2|ОН–) – 0,059рН +  lg
lg 
Выполняем расчеты:
+1,227 – 0,059 · 7 + 0,0147 lg(21000/101325) = 0,804 В
5.5. Задачи для самостоятельного решения
1. Составьте уравнения анодной и катодной реакций с кислородной и водородной деполяризацией при коррозии пары Mg / Pb.
2. Пользуясь данными таблицы, определите катод, анод и вид деполяризации при контакте металлов I и II. Напишите уравнения электродных реакций для указанных условий. Рассчитайте ЭДС и энергию Гиббса образовавшегося гальванического элемента.
| Металл I
| Металл II
| Условия
|
| Zn
| Cu
| Влажная среда, рН = 4
|
| Sn
| Fe
| Вода, рН = 7
|
| Pb
| Zn
| Кислая среда, рН = 5
|
| Zn
| Mg
| Влажная нейтральная атмосфера
|
| Zn
| Fe
| Влажная среда, рН = 5
|
3. Какие металлы можно применить для защиты железа от коррозии во влажной среде при рН = 5,5.
4. Как будет протекать коррозия железа, контактирующего с медью во влажной атмосфере?
5. Какие процессы будут протекать на железе, контактирующем с магнием в морской воде?
6. Рассчитайте потенциал кислородного электрода при рН = 3 и давлении кислорода = 2 атм.
7. Объясните, какое влияние на коррозию цинка, железа и меди может оказать присутствие в электролите растворенного сероводорода?
8. Кадмиевый катод погружен в подкисленный раствор соли кадмия. Активностm катионов Cd2+ в растворе = 1 моль(экв)/дм3, активность катионов Н+ = 0,5 моль/дм3, температура электролита = 298К.
9. Выполните расчеты и определите, какая реакция будет проходить на катоде, если перенапряжение восстановления Cd2+ на кадмиевом катоде равно нулю.
10. Какие факторы и почему могут привести к усилению электрохимической коррозии железа: 1) понижение рН среды; 2) повышение рН среды; 3) увеличение содержания кислорода в растворе? Приведите соответствующие уравнения реакций.
5.6. Контрольные вопросы
1. Что такое химические источники тока?
2. Какие ХИТ называются первичными?
3. Что такое напряжение разомкнутой цепи?
4. Что такое рабочее напряжение ХИТ?
5. Что такое вольтамперная характеристика, разрядная характеристика?
6. Что такое и чем определяется емкость ХИТ?
7. Для чего применяется параллельное и последовательное соединение ХИТ?
8. Каковы особенности ХИТ с водными электролитами?
9. Какие общие требования предъявляются к ХИТ?
10. Каково устройство марганцево-цинковых элементов?
11. Каковы особенности воздушно-цинковых элементов?
12. Каковы достоинства и недостатки литиевых ХИТ?
13. Что такое вторичные ХИТ?
14. Каково устройство и принцип работы свинцовых аккумуляторов?
15. Напишите уравнения электродных реакций, реализующихся при разряде и заряде свинцовых аккумуляторов.
16. В чем особенности электрохимической коррозии металлов?
17. Что такое коррозия металла с водородной деполяризаций?
18. Что такое кислородная деполяризация?
19. Какое уравнение можно применить для расчета потенциала кислородного электрода в кислой среде?
20. Какое влияние на коррозию оказывает рН раствора?эЧто такое потенциал разложения?
21. Как рассчитать энергию Гиббса гальванического элемента?
22. Что такое активаторы коррозии?
23. Что такое протекторная защита?
24. Что такое анодная защита?
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Учебники и учебные пособия
1. Березовчук А.В. Физическая химия [Электронный ресурс]: учебное пособие / Березовчук А.В.— Электрон. текстовые данные.— Саратов: Научная книга, 2012.— 159 c. - http://www.iprbookshop.ru/8191
2. Борисов И.М. Введение в электрохимию: учеб. пособие для вузов. – Уфа: БашГУ, 2007. – 106 с.
3. Семиохин, И.А. Физическая химия [Текст]/ И.А. Семиохин. – М.: МГУ, 2001.–270 с.
4. Сыркин А.М., Молявко М.А., Шевляков Ф.Б. Основы электрохимических процессов: учеб. пособие. Учебное пособие. - Уфа: Изд-во УГНТУ, 2009. – 127 с.
5. Электрохимия / Б.Б.Дамаскин, О.А.Петрий, Г.А.Цирлина. — М.: Химия, КолосС, 2006. – 672 с.
6. Физическая химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ/ под ред. Краснова К.С. – 3-е изд., испр. – М.: Высшая школа, 2001. – 319 с.
Учебно-методические пособия
1. Гилевич, М. П. Задачи по электрохимии. Для студентов хим. фак. БГУ спец. 1-31 05 01 «Химия» – Минск: БГУ, 2006. – 139 с.
2. Дмитревич И.Н., Пругло Г.Ф., Комиссаренков А.А. Электрохимические методы анализа (вопросы, тесты и ответы): учебное пособие / ВШТЭ СПбГУПТД. – СПб., 2016. – 84 с.
3. Методические указания к выполнению контрольной работы по курсу «Коррозия и защита металлов» (для студентов металлургических специальностей факультета заочного обучения) / Сост.: Авдеенко А.П., Поляков А.Е. – Краматорск: ДГМА, 2004. – 24 с.
4. Семиохин И. А. Сборник задач по электрохимии. М.: МГУ, 2006. – 99 с.



 ,
, При парциальном давлении водорода Р(Н2) = 1 атм, потенциал водородного электрода равен:
φ(Н+|Н2) = – 0,059рН
При парциальном давлении водорода Р(Н2) = 1 атм, потенциал водородного электрода равен:
φ(Н+|Н2) = – 0,059рН
 lg
lg  ,
где Р(О2) – парциальное давление кислорода;
а(Н+) – активность ионов Н+ в электролите;
а(Н2О) – активность воды.
В ходе реакции а(Н2О) практически не изменяется, поэтому ее можно ввести в φо, тогда уравнение принимает вид:
φ(О2|Н2О) = 1,23 + 0,0147 lg Р(О2) + 0,059 lg а(Н+).
При Р(О2) = 1 атм, уравнение упрощается:
φ(О2|Н2О) = 1,23 – 0,059 рН
В атмосферном воздухе содержание кислорода составляет 21%, т.е. парциальное давление кислорода = 21000Па.
Тогда:
j (О2|ОН–) = jо(О2|ОН–) – 0,059рН +
,
где Р(О2) – парциальное давление кислорода;
а(Н+) – активность ионов Н+ в электролите;
а(Н2О) – активность воды.
В ходе реакции а(Н2О) практически не изменяется, поэтому ее можно ввести в φо, тогда уравнение принимает вид:
φ(О2|Н2О) = 1,23 + 0,0147 lg Р(О2) + 0,059 lg а(Н+).
При Р(О2) = 1 атм, уравнение упрощается:
φ(О2|Н2О) = 1,23 – 0,059 рН
В атмосферном воздухе содержание кислорода составляет 21%, т.е. парциальное давление кислорода = 21000Па.
Тогда:
j (О2|ОН–) = jо(О2|ОН–) – 0,059рН + 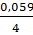 lg
lg  =
= jо(О2|ОН–) – 0,059рН – 0,01
=
= jо(О2|ОН–) – 0,059рН – 0,01
 lg
lg 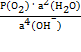 ,
где Р(О2) – парциальное давление кислорода;
а(ОН–) – активность ионов ОН– в электролите =
,
где Р(О2) – парциальное давление кислорода;
а(ОН–) – активность ионов ОН– в электролите =  Поскольку активность воды не изменяется, выражение можно записать следующим образом:
φ(О2|ОН–) = φо(О2|ОН–) + 0,0147 lg Р(О2) – 0,0147 lg а4(ОН–)
φ(О2|ОН–) = 1,23 + 0,0147 lg р(О2) – 0,059рН
При Р(О2) = 1 атм, уравнение упрощается: φ(О2|Н2О) = 1,23 – 0,059 рН
Поскольку активность воды не изменяется, выражение можно записать следующим образом:
φ(О2|ОН–) = φо(О2|ОН–) + 0,0147 lg Р(О2) – 0,0147 lg а4(ОН–)
φ(О2|ОН–) = 1,23 + 0,0147 lg р(О2) – 0,059рН
При Р(О2) = 1 атм, уравнение упрощается: φ(О2|Н2О) = 1,23 – 0,059 рН
 lg
lg 



