ДИДАКТИЧЕСКИЕ МАТРИАЛЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ПО ФИЗИЧЕСКОЙ ХИМИИ
РАЗДЕЛ «ЭЛЕКТРОХИМИЯ»
Учебно-методическое пособие
Киров
2017
УДК 544.6
С953
Допущено к изданию методическим советом института химии и эколгии ФГБО ВПО «ВятГУ» в качестве учебно-методического пособия для студентов направления 04.03.01 «Химия» всех профилей подготовки, всех форм обучения
Рецензент
доцент кафедры экологии и природопользования ВятГУ,
кандидат технических наук
А.С. Олькова
Сырчина, Н.В.
С953 Дидактические материалы для самостоятельной работы по физической химии. Раздел «Электрохимия»: учебно-методическое пособие / Н.В. Сырчина. – Киров: ВятГУ, 2017. – 85 с.
УДК 544.6
Учебно-методическое пособие предназначено для студентов направления 04.03.01 «Химия» всех профилей подготовки, всех форм обучения для организации самостоятельной работы по дисциплине «Физическая химия».
Тех. редактор Е.В. Кайгородцева
© ВятГУ, 2017
Учебное издание
Сырчина Надежда Викторовна
ДИДАКТИЧЕСКИЕ МАТЕРИАЛЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ПО ФИЗИЧЕСКОЙ ХИМИИ
РАЗДЕЛ «ЭЛЕКТРОХИМИЯ»
Учебно-методическое пособие
Подписано к использованию +++++. Заказ № +++
Федеральное государственное бюджетное образовательное учреждение высшего образования «Вятский государственный университет»
610000,г. Киров, ул. Московская, 36, тел.: (8332) 74-25-63, http://vyatsu.ru
Оглавление
ВВЕДЕНИЕ.. 3
1. РАСТВОРЫ ЭЛЕКТРОЛИТОВ.. 4
ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ ИОННЫХ ПРОВОДНИКОВ 26
3. ЭЛЕКТРОДЫ И ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ.. 42
4. ЭЛЕКТРОЛИЗ. ЗАКОНЫ ФАРАДЕЯ.. 63
5. ВОПРОСЫ ПРИКЛАДНОЙ ЭЛЕКТРОХИМИИ.. 71
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ... 81
ПРИЛОЖЕНИЯ.. 83
ВВЕДЕНИЕ
Важнейшим условием успешного освоения курса физической химии является четко спланированная и продуктивная самостоятельная работа обучающихся. Самостоятельная работа предполагает такие виды деятельности, как повторение и систематизация ранее изученного материала, осмысление и структурирование знаний, полученных в лекционном курсе, формирование навыков решения типовых задач, обобщение и закрепление знаний по каждой теме. Учебно-методическое пособие содержит комплекс дидактических материалов, необходимых для организации самостоятельной работы по соответствующим видам деятельности. В каждой теме раскрывается содержание теоретических вопросов (содержание темы), указывается перечень базовых вопросов, связывающих электрохимию с другими учебными дисциплинами (материал для повторения), приводятся основные понятия и соотношения по соответствующей теме, необходимые для решения задач, типовые упражнения и задачи для самостоятельного решения, а также контрольные вопросы для проверки полученных знаний.
Пособие содержит минимум теоретического текстового материала, представленного в соответствующих учебных пособиях и рассматриваемого в лекционном курсе. Дидактические материалы оформлены преимущественно в форме таблиц, позволяющих повысить плотность информации, акцентировать внимание на ключевых вопросах и сократить время на поиск необходимых данных.
В конце каждой темы приводится перечень контрольных вопросов, составленных в соответствии с программой курса физической химии (раздел «Электрохимия»). Для ответов на эти вопросы требуется работа с учебной литературой и конспектами лекций. Список рекомендуемой литературы приводится в конце учебно-методического пособия.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Содержание темы
Классическая теория электролитической диссоциации. Особенности растворов электролитов. Проводники второго рода. Доказательства диссоциации электролитов при растворении и расплавлении. Изотонический коэффициентВант-Гоффа i. Теория электролитической диссоциации С. Аррениуса. Сильные и слабые электролиты. Ионные равновесия в растворах электролитов. Применение закона действующих масс к растворам электролитов. Степень диссоциации. Константа диссоциации. Закон разведения Оствальда. Кислоты, основания и соли в рамках теории электролитической диссоциации. Диссоциация воды. Ионное произведение воды. Гидролиз солей. Степень гидролиза. Константа гидролиза. Буферные растворы. Буферная емкость системы. Произведение растворимости труднорастворимых соединений. Ионные равновесия в растворах амфолитов. Недостатки классической теории электролитической диссоциации. Развитие теории электролитической диссоциации.
Механизмы образования растворов электролитов. Причины электролитической диссоциации. Работы Каблукова и Кистяковского.Энергия ионной кристаллической решетки. Ионизирующее действие растворителя. Сольватирующая способность растворителя. Энергия сольватации. Влияние диэлектрической проницаемости среды на процесс электролитической диссоциации. Роль химических взаимодействий между электролитом и растворителем. Вода как растворитель. Модели строения молекул воды: модель молекулы воды Бернала и Фаулера; тетраэдрическая модель Н. Бьеррума. Строение воды как физического вещества. Истинные и потенциальные электролиты. Гидратация ионов. Инертные и лабильные аквакомплексы. Диссоциация электролитов в протонных и апротоных растворителях.
Теория растворов сильных электролитов. Особенности растворов сильных электролитов. Отличие растворов сильных электролитов от растворов слабых электролитов. Модельные методы описания взаимодействий в растворах электролитов. Теория Дебая-Гюккеля. Распределение ионов в растворе. Ионная атмосфера. Кажущаяся степень диссоциации. Термодинамическая теория растворов электролитов.Активность электролита. Коэффициент активности. Физический смысл коэффициента активности. Средняя ионная активность. Средний ионный коэффициент активности. Ионная сила раствора. Эмпирический закон Льюиса-Рендала. Ионная ассоциация в растворах электролитов. Полиэлектролиты.
Материал для повторения
Таблица 1.1
| Предмет
| Тема
| Вопросы для повторения
|
| 1
| 2
| 3
|
| Общая химия
| Химическая связь
| Ионная связь, водородная связь, ион-ионные, диполь-дипольные и ион-дипольные взаимодействия
|
| Вода. Растворы
| Строение молекул воды. Физические свойства воды. Химические свойства воды. Диссоциация воды.
|
| Растворы электролитов
| Теория электролитической диссоциации. Процесс диссоциации. Степень диссоциации, сильные и слабые электролиты. Свойства кислот, солей, оснований в свете теории электролитической диссоциации. Константы кислотности и основности. Произведение растворимости. Водородный показатель. Смещение ионных равновесий. Гидролиз солей
|
Продолжение таблицы 1.1
| 1
| 2
| 3
|
| Общая химия
| Растворы
| Осмос, давление пара растворов. Замерзание и кипение растворов. Способы выражения состава растворов. Концентрация растворенного вещества. Молярная концентрация вещества; молярная концентрация эквивалентов вещества; моляльная концентрация вещества. Растворимость. Коэффициент растворимости
|
| Атомно-молекулярное учение
| Количество вещества. Молярная масса. Эквивалент. Количество вещества эквивалентов. Закон эквивалентов.
|
| Аналитическая химия
| Общие вопросы теории растворов
| Комплексообразование. Равновесие комплексообразования. Равновесие в системе осадок – раствор. Основы теории сильных электролитов. Активность, коэффициент активности, ионная сила растворов. Кислотно-основное равновесие. Равновесие в водных растворах кислот, оснований и амфолитов. Буферные растворы, их состав и свойства. Расчет рН буферных систем (уравнение Гендерсона-Гассельбаха для расчета рН кислотного и основного буферных растворов). Расчет рН протолитических систем на основе теории Бренстеда – Лоури.
|
| Физическая химия
| Химическая термодинамика
| Химическое равновесие. Закон действующих масс. Критерий термодинамической возможности самопроизвольного протекания химических реакций. Химический потенциал. Активность компонента в растворе. Энергия кристаллической решетки. Теплоты растворения и сольватации. Энтальпия, энтропия, энергия Гиббса. Условия протекания самопроизвольных процессов. Условия равновесия.
|
| Физика
| Электричество и магнетизм
| Электрический заряд. Закон сохранения электрического заряда. Закон Кулона. Диэлектрическая проницаемость среды. Абсолютная и относительная диэлектрическая проницаемость.
|
Основные понятия и соотношения по изучаемой теме, используемые при решении задач
Таблица 1.2
| Понятие
| Символ
| Размерность
| Понятие, определение, формула
|
| 1
| 2
| 3
| 4
|
| Молярная концентрация вещества (молярность)
| СМ
| моль/дм3
| Отношение количества растворенного вещества (моль) к объему раствора (дм3)
СМ = n / V
СМ – молярность, моль/дм3
n – количество вещества, моль
V – объем раствора, дм3
|
| Молярная концентрация эквивалентов вещества (нормальность)
| Сн
| моль/дм3
| Отношение количества эквивалентов растворенного вещества (n, моль) к объему раствора (V, дм3)
Сн = n / V
Сн – молярная концентрация эквивалентов, моль/дм3 (нормальность)
|
| Моляльная концентрация (моляльность)
| Сm
| моль/кг
| Отношение количества растворенного вещества (n, моль) к массе растворителя (m, кг):
Сm = n / m
|
| Растворимость
| S
| %;
г/100 г;
см³/100 см³
| Концентрация растворенного вещества в насыщенном растворе при данной температуре
|
| Коэффициент растворимости
| ks
|
| Масса вещества в граммах, которая при растворении в 100 г (или в 1 дм3) растворителя образует при данной температуре насыщенный раствор. Для ks указывается вещество, растворитель и внешние условия (для веществ в твердом состоянии обычно в качестве внешних условий указывают только температуру)
|
Продолжение таблицы 1.2
| 1
| 2
| 3
| 4
|
| Коэффициент активности
| f (в шкале молярности)
γ (в шкале моляльности)
| –
| Коэффициент активности – величина, характеризующая степень отклонения свойств реальных растворов электролитов от идеальных растворов.
Кэффициент активности (f или γ) = отношению активности к концентрации вещества в растворе (соответственно См, моль/дм3 или Сm, моль/кг):
γ = a / Сm (в шкале моляльности)
f = a / См (в шкале молярности)
|
| Активность электролита
| а
| Единицы концентрации:
моль/дм3 или моль/кг
| Активность электролита (а) – эффективная (кажущаяся) концентрация электролита с учётом различных взаимодействий между компонентами в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора
а = f · Сm (молярная активность)
a = γ · CМ (моляльная активность),
где Сm и CМ – моляльность и молярность соответственно;
f и γ – соответствующие коэффициенты активности.
а = а+ · а–,
где а+ и а– – активности катионов и анионов (индивидуальные значения этих величин определить нельзя, можно рассчитать только средние значения)
|
| Изотонический коэффициент (i) и степень диссоциации (a)
|
|
| i = 1 + a (n - 1),
где n - количество ионов, образующихся при диссоциации одной молекулы электролита.
|
Продолжение таблицы 1.2
| 1
| 2
| 3
| 4
|
| Коллигативные свойства растворов электролитов
|
|
| Осмотическое давление: Росм = iCмRT
Понижение температуры замерзания: Δ Tзам. = iKСm
Повышение температуры кипения: Δ Tкип. = iЕСm,
где i – изотонический коэффициент;
Cм – молярная концентрация, моль/дм3;
Сm – моляльная концентрация, моль/кг;
R – универсальная газовая постоянная, 8.314;
T – температура, К
К – криоскопическая постоянная;
Е – эбуллиоскопическая постоянная.
|
| Средняя ионная активность
| a±
| Размерность концентрации:
моль/кг или
моль/дм3
| Средняя ионная активность (a±) для электролита, распадающегося с образованием n+ катионов и n– анионов определяется соотношением:
a± = (a+n+ × a–n -)1/n,
где n = n+ + n–
a± = Сm± × g± = L × Сm × g±
L – коэффициент, зависящий от ионного типа электролита.
Для бинарных 1,1 и 2,2–зарядных электролитов L = 1:
a± = Сm± × g± = Сm × g±
Для 1,2-х - зарядных электролитов
L = 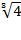 =1,59 a± = Сm± × g± × 1,59
Для 2,3-х - зарядных электролитов
L = =1,59 a± = Сm± × g± × 1,59
Для 2,3-х - зарядных электролитов
L = 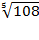 = 2,55 a± = Сm± × g± × 2,55 = 2,55 a± = Сm± × g± × 2,55
|
Продолжение таблицы 1.2
| 1
| 2
| 3
| 4
|
| Средний ионный коэффициент активности
| g±
или
f±
| –
| Средний ионный коэффициент активности в шкале моляльности (g±) для электролита, распадающегося с образованием n+ катионов и n– анионов определяется соотношением:
g± = (g+n+ × g–n -)1/n,
где n = n+ + n–
В шкале моляльности: g± = (g+n+ × g–n -)1/n
Соотношение между g ± и f ±:
f + = γ + · (ρ0 · Cm/См)
|
| Средняя ионная моляльность
| Сm±
| моль/кг
| Сm± = (Сm+n+ × Сm–n –)1/n = Сm (n+n+ × n–n –)1/n,
где Сm+ = Сm × n+; Сm– = Сm × n–
|
| Тип электролита
| Расчет
(n+n+ × n–n –)1/n
| Значение
(n+n+ × n–n –)1/n
|
| 1,1 или 2,2
| (11×11)1/2
| 1
|
| 1,2
| (22×11)1/3
| 1,53
|
| 1,3
| (33×11)1/4
| 2,28
|
| 2,3
| (22×33)1/5
| 2,55
|
| Общая активность электролита
| а
| моль/кг;
моль/дм3
| а = а+ν+ ⋅ а−ν− = а± ν
n = n+ + n–
|
| Ионная сила
| I
| моль/кг;
моль/дм3
| Ионная сила раствора равна полусумме произведений концентраций всех ионов в растворе, умноженных на квадрат их заряда
I =1/2 Σ (zi2 · mi)
Для растворов бинарных электролитов с однозарядными ионами I численно равна молярности (моляльности). Слабые электролиты вносят незначительный вклад в I, поэтому их обычно не учитывают при расчете ионной силы.
|
Продолжение таблицы 1.2
| 1
| 2
| 3
| 4
|
| Произведение растворимости
| ПР
(Кsp, Ls)
| -
| Произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении.
ПР – величина постоянная для каждого электролита в данных условиях.
Для электролита АmВn, диссоциирующего на ионы в соответствии с уравнением:
АmВn «mAn+ + nBm-,
ПР = аmA · аnB,
где аA – активность катиона;
аB – активность аниона (моль/дм3).
Для растворов с концентрациями меньшими, чем 1·10−4 моль/л вместо активностей можно использовать значения концентрации
|
| Соотношение между S и ПР
|
|
| Произведение растворимости (ПР) связано с растворимостью (S, моль/л) следующим соотношением:
S = 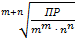 ,
где m+n – суммарное число катионов и анионов в формуле электролита;
m – число катионов;
n – число аниона;
Формула справедлива в том случае, если можно пренебречь влиянием ионной силы раствора и протеканием конкурирующих реакций ,
где m+n – суммарное число катионов и анионов в формуле электролита;
m – число катионов;
n – число аниона;
Формула справедлива в том случае, если можно пренебречь влиянием ионной силы раствора и протеканием конкурирующих реакций
|
Окончание таблицы 1.2
| 1
| 2
| 3
| 4
|
| Водородный показатель
| рН
| -
| Водородный показатель, pH – мера активности ионов водорода в растворе.
Водородный показатель численно равен отрицательному десятичному логарифму активности (или для разбавленных растворов концентрации ионов водорода), выраженной в моль/дм3:
pH = –lg аH+
|
| Концентрация ионов водорода в буферном растворе
| СмН+
| моль/дм3
|
СмН+ = 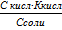
|
| Концентрация гидроксид-ионов в буферном растворе
| СмОН-
| моль/дм3
|
СмОН- = 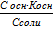
|
| Константа диссоциации слабого бинарного электролита
| К или Кд
(Ка – для кислоты;
Кb – для основания)
| -
| Для электролита, диссоциирующего в соответствии с уравнением:
ВА 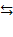 В+ + А–
К = В+ + А–
К = 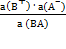 К =
К = 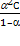 = = 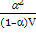 ,
a – степень диссоциации;
С – концентрация, моль/дм3;
V – разбавление (1/См) ,
a – степень диссоциации;
С – концентрация, моль/дм3;
V – разбавление (1/См)
|
Концентрация раствора
1. Рассчитайте молярную концентрацию 11,52 % раствора соляной кислоты, плотность которого составляет 1,055 г/см3. Какая масса хлороводорода содержится в 1 дм3 этого раствора?
(Ответ: 3,333 моль/дм3; 121,5 г/дм3).
2. В 1дм3 водного раствора содержится 224,2 г хлороводорода. Рассчитайте молярную концентрацию и массовую долю хлороводорода в растворе, если плотность раствора составляет 1,1 г/см3.
(Ответ: 20,39 %; 6,15 моль/дм3).
3. Плотность водного раствора, содержащего 123,9 г хлорной кислоты в 1 дм3, составляет 1,07 г/см3. Рассчитайте массовую долю и молярность соответствующего раствора. (Ответ: 11,58 %; 1,233 моль/дм3).
4. Рассчитайте массовую долю раствора, полученного смешиванием 100 г 10 % раствора гидроксида натрия и 200 г 25 % раствора этого вещества.
(Ответ: 20 %).
5. В каком массовом соотношении следует смешать 5 % и 20 % растворы сахарозы, чтобы получить 10 % раствор?
(Ответ: 1 масс. часть 20 % и 2 масс. части 5 % растворов).
6. Сколько масс. частей воды следует прибавить к 1 кг 25 % серной кислоты, чтобы получить 10 % раствор?
(Ответ:1,5 кг).
7. Сколько г 60 % раствора серной кислоты следует прибавить к 1 кг 5 % раствора, чтобы получить 10 % раствор?
(Ответ:100 г).
8. К 200 г 10 % раствора серной кислоты прибавили 500 см3 воды. Рассчитайте массовую долю полученного раствора. Рассчитайте молярную концентрацию этого раствора, если его плотность составила 1,016 г/см3.
(Ответ: 2,85 %; 0,296 моль/дм3).
9. Рассчитайте массу медного купороса, необходимого для приготовления 0,5 дм3 раствора, содержащего 0,1 моль эквивалентов ионов Cu 2+. Рассчитайте молярную концентрацию эквивалентов приготовленного раствора.
(Ответ: 12,5 г; 0,2 моль(экв)/дм3).
10. Пользуясь приведенными в таблице данными, выполните расчеты и заполните пустые ячейки.
| Величина
| Формула растворенного вещества
|
| Н2SО4
| NaNO3
| CaCl2
| NaCl
| NaOH
| Na2SO4
|
| Молярная масса
(М, г/моль)
|
|
|
|
|
|
|
| Количество вещества
(n, моль)
|
|
|
| 3,927
|
| 0,1296
|
| Масса растворенного вещества (m, г)
|
|
|
|
| 45,14
|
|
| Масса растворителя
(m, г)
|
|
|
|
|
|
|
| Объем раствора (V, дм3)
|
|
|
| 1
| 0,5
| 0,1
|
| Плотность раствора
(ρ, г/см3)
| 1,085
| 1,067
| 1,083
| 1,148
| 1,09
| 1,151
|
| Моляльность
(Сm, моль/кг)
|
|
|
|
|
|
|
| Молярность
(СМ, моль/дм3)
| 1,401
|
|
|
|
|
|
| Молярная концентрация эквивалентов
(Сн, моль/дм3)
|
|
|
|
|
|
|
| Массовая доля (ω,%)
|
|
| 10
|
|
|
|
| Концентрация (г/дм3)
|
| 106,7
|
|
|
|
|
11. Рассчитайте растворимость AgBrO3, при 20оС, если ПР этой соли при данной температуре составляет 5,5·10-5.
(Ответ: 0,0074 моль/дм3).
12. Рассчитайте растворимость и определите сколько г AuCl3 содержится в 1 дм3 насыщенного при 20 о С водного раствора, если ПР этой соли при данной температуре составляет 3·10-25. Коэффициент активности = 1. Других электролитов в растворе нет.
(Ответ: 3,25·10-27; 9,86·10-25 )
13. Какой объем 0,1 М раствора гидроксида натрия будет затрачен на титрование 10 см3 раствора серной кислоты, содержащей 9,9 г Н2SО4 в 1 дм3 раствора?
(Ответ: 20,2 см3).
14. Пользуясь приведенными в таблице данными, выполните необходимые расчеты и заполните пустые ячейки. Плотность всех растворов примите равной 1 г/см3. Коэффициенты активности примите равными 1. Раствор содержит только один электролит.
| Величина
| Формула растворенного вещества
|
| AgBr
| BaF2
| BaSO4
| CdCO3
| CuCl
|
| ПР
| 6·10-13
| 1,7·10-6
| 1,·10-10
|
|
|
| -lg ПР
|
|
|
| 12,0
| 6,0
|
| Растворимость S, моль/дм3
|
|
|
|
|
|
| Концентрация, г/дм3
|
|
|
|
|
|
| Молярная концентрация эквивалентов, Сн, моль/дм3
|
|
|
|
|
|
| Моляльность, Сm, моль/кг
|
|
|
|
|
|
| Коэффициент растворимости ks, г на 100 г воды
|
|
|
|
|
|
Буферные растворы
1. Рассчитайте рН ацетатного буфера, в 1 дм3 которого содержится 0,9 моль уксусной кислоты и 0,6 моль ацетата натрия (константа диссоциации уксусной кислоты 1,75·10-5)?
(Ответ: рН = 4,58)
2. Рассчитайте рН буферного раствора, полученного смешиванием 1,8 л 0,2 М уксусной кислоты и 200 мл 0,2 М ацетата натрия (константа диссоциации уксусной кислоты 1,75·10-5).
(Ответ: рН = 3,79).
3. Сколько см3 0,2 М раствора уксусной кислоты нужно добавить к 40 см3 0,1 М раствора ацетата натрия, чтобы получить раствор с рН 4?
(Ответ: 110 см3).
4. Рассчитайте рН буферного раствора, полученного смешиванием 200 мл 0,1 моль/дм3 раствора хлорида аммония и 50 мл 0,5 моль/дм3 раствора аммиака. рК (NH3) = 4,76.
(Ответ: 9,34).
5. К 200 дм3 0,2 моль/дм3 раствора CH3COONa прибавили 100 см3 0,1 моль/дм3 раствора HCl. Рассчитайте рН полученной системы.
(Ответ: 5,24).
6. Рассчитать значение буферной емкости фосфатного буферного раствора, если после добавления 10 см3 0,5 моль/дм3 раствора гидроксида натрия к 20 см3 этого раствора рН последнего увеличивается с 7,2 до 8,0.
(Ответ: 0,3125 моль).
7. Определите, на сколько изменится pH формиатного буферного раствора, содержащего по 0,1 моль/дм3 муравьиной кислоты (KHCOOH = 1,77⋅10-4) и формиата натрия (HCOONa) после добавления к 1 дм3 этого раствора 0,01 моль соляной кислоты (HCl).
(Ответ: pH раствора уменьшилось на 0,08 единиц).
8. Рассчитайте pН буферного раствора в 1 дм3 которого содержится 0,1 моль уксусной кислоты и 0,01 моль ацетата натрия. КCH3COOH = 1,75 ⋅ 10-5.
(Ответ: 3,76).
9. Сколько г формиата натрия следует прибавить к 100 мл 0,2 М раствора соляной кислоты, чтобы получить буферный раствор с рН = 4,3?
(Ответ: 6,256 г).
10. Рассчитайте рН раствора, полученного смешиванием 30 см3 уксусной кислоты (0,1 моль/дм3) и 50 см3 раствора ацетета калия (0,3 моль/дм3). КCH3COOH = 1,75 ⋅ 10-5.
(Ответ: 5,46)
11. Определите, в каких случаях образуются буферные растворы и рассчитайте их рН:
| №
| Формулы веществ
| Объем,
дм3
| Концентрация, моль/дм3
| Кд
|
| 1
| СН3СООН
| 0,5
| 1
| 1,8·10-5
|
| СН3СООNa
| 0,5
| 1
|
|
| 2
| NН4ОН
| 1
| 2
| 1,8·10-5
|
| NН4Cl
| 0,5
| 1
|
|
| 3
| СН3СООН
| 0,5
| 0,5
|
|
| NаОН
| 0,2
| 0,5
|
|
| 4
| СН3СООН
| 0,1
| 0,5
|
|
| НCl
| 0,5
| 0,1
|
|
| 5
| NН4ОН
| 0,2
| 0,1
|
|
| NаОН
| 0,2
| 0,1
|
|
| 6
| С6Н5СН2СООН
| 0,5
| 0,1
| 4,88·10-5
|
| С6Н5СН2СООК
| 0,5
| 0,1
|
|
Водородный показатель
1. Определить молярную концентрацию гидроксида аммония в растворе, если рН соответствующего раствора = 11; Кд = 1,8∙10-5. (Ответ: 0,056 моль/дм3).
3. Рассчитайте примерное значение рН систем, полученных смешиванием растворов следующих веществ: Коэффициенты активности ионов в растворе примите равными 1.
| №
| Формулы веществ
| Концентрация раствора, моль/дм3
| Объем раствора,
дм3
|
| 1
| NaOH
| 0,01
| 0,5
|
| HCl
| 0,01
| 0,1
|
| 2
| KOH
| 0,01
| 0,5
|
| HNO3
| 0,05
| 0,1
|
| 3
| NaOH
| 1
| 0,5
|
| KOH
| 0,1
| 1
|
| 4
| HCl
| 0,5
| 0,1
|
| HNO3
| 0,5
| 0,1
|
| 5
| NaCl
| 1
| 0,5
|
| HNO3
| 1
| 0,5
|
Произведение растворимости
1. При 250С ПР AgCl составляет 1,8∙10-10, а ПР Ag2CО3 = 8,2∙10-12. Растворимость какой соли выше?
(Ответ: S ( AgCl) = 1,34∙10-5; S ( Ag2CО3 ) = 1,27∙10-4)
2. Рассчитайте ПР бромата серебра, если его растворимость (S) в воде равна 7,4∙10-3 моль/дм3 при температуре 20 о С.
(Ответ: 5,5∙10-5)
3. Рассчитайте растворимость MgF2 в воде (моль/дм3; г/дм3) при температуре 20 о С, если произведение растворимости этой соли при данных условиях составляет 9∙10-9.
(Ответ: 1,2∙10-3 моль/дм3; 0,074 г/дм3)
4. Рассчитайте растворимость CuBr в чистой воде и 0,1 моль/дм3 бромиде калия, если ПР (CuBr) при данных условиях составляет 5,3∙10-9.
(Ответ: 7,28∙10-5 моль/дм3; 5,3∙10-8 моль/дм3)
5. Растворимость Ag2CO3 при 200С в воде равна 3,5·10-2 г/л. Рассчитайте ПР этой соли. Рассчитайте растворимость этой соли в растворе Na2CO3, концентрация которого составляет 0,01 моль/дм3. Активность принять равной концентрации.
(Ответ: 8,2∙10-12; 0,46∙10-6 )
9. К 100 см3 хлорида кальция прибавили равный объем карбоната натрия. Исходные концентрации растворов солей составляли 0,02 моль/дм3. Рассчитайте ионное произведение СаСО3 (ИП) и определите, выпадет ли осадок карбоната кальция ПР (СаСО3) = 3,8∙10-9.
(Ответ: ИП = 1,0∙10-4. Осадок образуется).
Гидролиз солей
Пользуясь приведенными данными, выполните соответствующие расчеты и заполните таблицу.
| Формула соли
| Константа диссоциации
слабой кислоты или основания, образующей соль Кд
| Константа гидролиза Кг
| Степень гидролиза h,
%
| рН
| Концентрация,
моль/дм3
|
| NH4C1
| 1,76·10-5
|
|
|
| 0,01
|
| NaNO2
| 1,76·10-5
|
|
|
| 0,05
|
| КСN
| 7,9·10-10
|
|
|
| 0,1
|
| С6Н5СООNa
| 6,6·10-5
|
|
|
| 0,5
|
1.5. Контрольные вопросы
1. Каковы основные отличия растворов электролитов от растворов неэлектролитов?
2. Что такое электролитическая диссоциация?
3. Какова роль воды в процессах диссоциации электролитов?
4. Каковы отличия проводников 1 рода от проводников второго рода?
5. Каковы отличия слабых электролитов от сильных?
6. Какие явления свидетельствуют о том, что в водных растворах электролиты диссоциируют на ионы?
7. Для чего был введен изотонический коэффициент Вант-Гоффа?
8. Назовите основные положения теории электролитической диссоциации С. Аррениуса.
9. Что такое степень диссоциации?
10. Какова зависимость степени диссоциации от концентрации электролита?
11. Каковы недостатки теории электролитической диссоциации?
12. Что такое константа электролитической диссоциации?
13. Какие факторы оказывают влияние на значение константы электролитической диссоциации?
14. В чем выражается закон разведения Оствальда?
15. Как рассматриваются кислоты, основания и соли в рамках теории электролитической диссоциации?
16. Что такое ионное произведение воды?
17. Как рассчитать степень гидролиза соли?
18. Что такое константа гидролиза?
19. Что такое растворимость?
20. Какие факторы оказывают влияние на растворимость электролитов?
21. Что такое произведение растворимости? Для чего используется эта величина?
22. Каковы причины электролитической диссоциации?
23. Что такое диэлектрическая проницаемость среды?
24. Что такое химический потенциал?
25. Что является критерием термодинамической возможности самопроизвольного протекания химических реакций?
26. В чем проявляется сольватирующая способность растворителя?
27. Что такое сольваты?
28. Что такое энергия сольватации?
29. В рамках каких моделей рассматривается строение воды?
30. Что такое истинные и потенциальные электролиты?
31. Что такое инертные и лабильные аквакомплексы?
32. Каковы основные положения и допущения теории Дебая–Гюккеля?
33. Что такое ионная атмосфера?
34. Каков смысл введения представлений об ионной атмосфере для объяснения строения растворов электролитов?
35. Что такое кажущаяся степень диссоциации?
36. Что такое активность электролита?
37. Что такое коэффициент активности? Каков физический смысл этой величины?
38. Что такое средняя ионная активность?
39. Что такое средний ионный коэффициент активности?
40. Что такое ионная сила раствора?
41. Сформулируйте эмпирический закон Льюиса-Рендала.
42. Чем обусловлена и к чему приводит ионная ассоциация в растворах электролитов?
43. Что такое ионная пара?
44. Что такое полиэлектролиты?
Материал для повторения
Таблица 2.1.
| Предмет
| Раздел
| Вопросы для повторения
|
| Физика
| Электричество и магнетизм
| Электрический заряд. Носители заряда. Закон сохранения электрического заряда.
Закон Кулона. Работа сил электростатического поля. Потенциал. Электрический диполь. Силы, действующие на диполь в электрическом поле. Проводники в электростатическом поле. Силы, действующие на проводники в электрическом поле. Диэлектрики. Диэлектрическая проницаемость. Поляризация ионных кристаллов. Электрические свойства кристаллов. Постоянный электрический ток. Сила и плотность тока. Электрическое напряжение. Закон Ома для участка цепи. Электросопротивление. Удельная электропроводность вещества. Закон сохранения энергии для цепей постоянного тока. Переменный синусоидальный ток. Закон Ома для цепей переменного тока. Механизмы электропроводности. Проводники. Электролиты. Закон Фарадея.
|
2.3. Основные понятия и соотношения, используемые при решение задач
Таблица 2.2.
| Понятие
| Символ
| Размерность
| Определение
|
| 1
| 2
| 3
| 4
|
| Миграция (перенос) ионов
| -
| -
| Направленное движение (перенос) ионов к электродам противоположного знака под влиянием электрического поля
|
| Электропроводность
| L
| Ом–1 (обратный ом);
См (сименс)
| Электропроводность (L) представляет собой суммарный электрический заряд, проходящий через вещество за единицу времени, при приложении к нему разности потенциалов в 1 В.
L можно выразить как величину обратную сопротивлению проводника R:
L = 1 / R
|
| Сопротивление раствора
| R
| Ом
| Как и для металлических проводников, сопротивление (R) растворов рассчитывается по формуле: R = ρ ·  ,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов) ,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов)
|
Продолжение таблицы 2.2
| 1
| 2
| 3
| 4
|
| Удельная электропроводность
| ϰ
| См ∙ м–1;
Ом–1 ∙ м–1;
В справочной литературе ϰ часто выражается в Ом–1∙ см–1
или
См ∙ см–1
| Удельная электропроводность (ϰ) – величина, обратная удельному сопротивлению (r).
ϰ =  = = 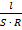 ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
|
| Постоянная кондуктометрической ячейки
| К
|
м-1
| К =  ,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К = ,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К =  ,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2) ,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2)
|
| Эквивалентная электропроводность
| λV ;
λ
(Λ)
| 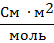
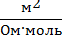 В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2
В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2
| Эквивалентная электропроводность – электрическая проводимост |



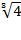 =1,59 a± = Сm± × g± × 1,59
Для 2,3-х - зарядных электролитов
L =
=1,59 a± = Сm± × g± × 1,59
Для 2,3-х - зарядных электролитов
L = 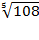 = 2,55 a± = Сm± × g± × 2,55
= 2,55 a± = Сm± × g± × 2,55
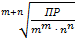 ,
где m+n – суммарное число катионов и анионов в формуле электролита;
m – число катионов;
n – число аниона;
Формула справедлива в том случае, если можно пренебречь влиянием ионной силы раствора и протеканием конкурирующих реакций
,
где m+n – суммарное число катионов и анионов в формуле электролита;
m – число катионов;
n – число аниона;
Формула справедлива в том случае, если можно пренебречь влиянием ионной силы раствора и протеканием конкурирующих реакций
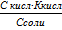
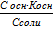
 В+ + А–
К =
В+ + А–
К = 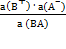 К =
К = 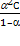 =
= 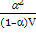 ,
a – степень диссоциации;
С – концентрация, моль/дм3;
V – разбавление (1/См)
,
a – степень диссоциации;
С – концентрация, моль/дм3;
V – разбавление (1/См)
 ,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов)
,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов)
 =
= 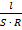 ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
 ,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К =
,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К =  ,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2)
,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2)
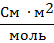
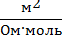 В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2
В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2

