1. Потенциал электрода зависит от активности как окисленной, так и восстановленной форм вещества, содержащихся в растворе
а) Уравнение электродного равновесия в общем виде:
aOxр + ne– «bRedр
б) Форма уравнения Нернста:
j = j 0 +  ln
ln  ,
,
где j 0 – стандартный электродный потенциал, В; R – универсальная газовая постоянная, (R = 8,314 Дж/моль∙К);
n – число электронов, участвующих в электрохимической реакции;
F – постоянная Фарадея (96500 Кл);
Т – температура, К;
[Ox] и [Red] - соответственно активности окисленной и восстановленной формы вещества.
Для температуры 298 К при замене натурального логарифма (ln) на десятичный (lg) соотношение  = 0,059 В. В этом случае уравнение Нернста можно записать в следующем виде:
= 0,059 В. В этом случае уравнение Нернста можно записать в следующем виде:
j = j 0 +  lg
lg 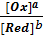
в) Пример:
| Электродное равновесие:
| Sn4+ + 2e– «Sn2+
|
| Уравнение Нернста:
| j = j0 +  ln ln 
|
| Расчет j по уравнению Нернста (для 298 К)
| j = 0,14 +  lg lg 
|
2. Потенциал электрода определяется несколькими окисленными и несколькими восстановленными формами веществ, содержащимися в растворе
Уравнение электродной реакции в общем виде:
aOx1р + bOx2р + … + ne– «cRed1р + dRed2р + …
j = j 0 +  ln
ln  ,
,
Пример:
| Электродное равновесие:
| Cr2O72– + 14H+ + 6e– «2Cr3+ + 7H2O
|
|
Уравнение Нернста:
| j = j0 +  ln ln  В расчетное уравнение следовало бы включить и активность воды, однако в разбавленных растворах активность воды можно считать постоянной величиной, которая учитывается значением j0
В расчетное уравнение следовало бы включить и активность воды, однако в разбавленных растворах активность воды можно считать постоянной величиной, которая учитывается значением j0
|
| Расчет j по уравнению Нернста (для 298 К)
| j = 1,333 +  lg lg 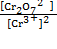 – 0,138 рН – 0,138 рН
|
3. Потенциал металлического электрода определяется активностью катионов данного металла, находящихся в растворе, в который погружен электрод (электрод 1 рода, обратимый по катиону)
Уравнение электродной реакции в общем виде:
Меn+ + nе «Ме
j = j 0 +  ln [Меn+]
ln [Меn+]
или для температуры 298 К: j = j 0 +  lg [Меn+]
lg [Меn+]
Пример:
| Электродное равновесие:
| Сu2+ + 2e– «Сu
|
| Уравнение Нернста:
| j = j0 +  ln [Сu2+] ln [Сu2+]
|
| Расчет j по уравнению Нернста (для 298 К)
| j = 0,377 +  lg [Сu2] lg [Сu2]
|
4. Потенциал электрода 1 рода, обратимого по аниону
Уравнение электродной реакции в общем виде:
Э + nе «Эn-
j = j 0 –  ln [Эn-]
ln [Эn-]
или для температуры 298 К: j = j 0 –  lg [Эn-]
lg [Эn-]
Пример:
| Электродное равновесие:
| 2Te + 2e– «Te22-
|
| Уравнение Нернста:
| j = j0 –  ln [Te22-] ln [Te22-]
|
| Расчет j по уравнению Нернста (для 298 К)
| j = j0 –  lg [Te22-] lg [Te22-]
|
5. Потенциал электрода, для случая, когда в электродном равновесии принимают участие малорастворимые в воде газы (H2, O2, N2 и т.п.)
Газообразное вещество может находиться в окисленной или восстановленной форме. В уравнении Нернста вместо активности газов используется парциальное давление соответствующего газа.
Пример электродной реакции с участием газа:
О2(Г) + 4Н+р + 4е– «2H2O
В данном случае потенциал электрода будет зависеть от активности ионов водорода, парциального давления кислорода и активности воды. Уравнение Нернста принимает следующую форму:
j = j 0 +  ln
ln 
В разбавленных растворах активность воды можно считать постоянной величиной, которая учитывается значением j 0, тогда выражение для расчета j можно представить в следующем виде:
или j = j 0 + 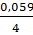 lg (р (О2) · [Н+]4)
lg (р (О2) · [Н+]4)
Если парциальное давление кислорода = 101 325 Па (1 атм.), то выражение упрощается и принимает вид: j = j 0 + 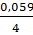 lg [Н+]4
lg [Н+]4
Пример 1:
| Электродное равновесие:
| 2Н+ + 2e «Н2
|
| Уравнение Нернста:
| j = j0 +  ln + ln + 
|
| Расчет j по уравнению Нернста (для 298 К)
| j = 0 +  lg lg  Если давление водорода равно 1 атм, то уравнение упрощается: j = 0,059 lg[Н+]
Если давление водорода равно 1 атм, то уравнение упрощается: j = 0,059 lg[Н+]
|
Пример 2:
| Электродное равновесие:
| Сl2 + 2e «2Cl–
|
| Уравнение Нернста:
| j = j0 +  ln ln  Если давление хлора равно 1 атм, то уравнение упрощается: j = j0 +
Если давление хлора равно 1 атм, то уравнение упрощается: j = j0 +  – ln[Cl–] – ln[Cl–]
|
| Расчет j по уравнению Нернста (для 298 К)
| j = 1,360 +  lg lg  Если давление хлора равно 1 атм, то уравнение упрощается: j = 1,360 – 0,059 lg[Cl–]
Если давление хлора равно 1 атм, то уравнение упрощается: j = 1,360 – 0,059 lg[Cl–]
|
6. Потенциал электродов второго рода
К электродам второго рода относят системы, в которых в качестве электродов используется металл, покрытый слоем его труднорастворимой соли или оксида, а в растворе содержатся анионы этой соли или соответственно ионы ОН–. Электроды 2-го рода обратимы по аниону, т.е. потенциал электрода определяется активностью соответствующих анионов в растворе.
Пример:
Уравнение электродной реакции, реализующейся в хлорсеребряном электроде можно записать в следующем виде:
AgCl + e «Ag + Cl–
Электродный потенциал хлорсеребряного электрода при температуре 298 К будет определяться активностью ионов Cl–.
j = j 0 –  ln [Cl–] или j = j 0 – 0,059lg [Cl–]
ln [Cl–] или j = j 0 – 0,059lg [Cl–]



 ln
ln  ,
, = 0,059 В. В этом случае уравнение Нернста можно записать в следующем виде:
= 0,059 В. В этом случае уравнение Нернста можно записать в следующем виде: lg
lg 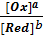
 ln
ln 
 lg
lg  ln
ln  ,
, В расчетное уравнение следовало бы включить и активность воды, однако в разбавленных растворах активность воды можно считать постоянной величиной, которая учитывается значением j0
В расчетное уравнение следовало бы включить и активность воды, однако в разбавленных растворах активность воды можно считать постоянной величиной, которая учитывается значением j0
 lg
lg 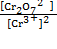 – 0,138 рН
– 0,138 рН
 ln [Меn+]
ln [Меn+] lg [Меn+]
lg [Меn+] ln [Эn-]
ln [Эn-] lg [Эn-]
lg [Эn-] ln [Te22-]
ln [Te22-]
 lg [Te22-]
lg [Te22-]
 ln
ln 
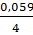 lg (р (О2) · [Н+]4)
lg (р (О2) · [Н+]4) ln +
ln + 
 Если давление водорода равно 1 атм, то уравнение упрощается: j = 0,059 lg[Н+]
Если давление водорода равно 1 атм, то уравнение упрощается: j = 0,059 lg[Н+]
 Если давление хлора равно 1 атм, то уравнение упрощается: j = j0 +
Если давление хлора равно 1 атм, то уравнение упрощается: j = j0 +  – ln[Cl–]
– ln[Cl–]
 Если давление хлора равно 1 атм, то уравнение упрощается: j = 1,360 – 0,059 lg[Cl–]
Если давление хлора равно 1 атм, то уравнение упрощается: j = 1,360 – 0,059 lg[Cl–]
 ln [Cl–] или j = j 0 – 0,059lg [Cl–]
ln [Cl–] или j = j 0 – 0,059lg [Cl–]

