2.1. Содержание темы
Проводники первого и второго рода. Электропроводность. Электрическая проводимость растворов и расплавов электролитов. Сопротивление ионных проводников. Удельная, эквивалентная, молярная электропроводность. Зависимость электропроводности слабых и сильных электролитов от концентрации, температуры и давления. Закон квадратного коня (уравнение Кольрауша), закон кубического корня. Предельная молярная электропроводность. Электропроводность воды.
Подвижность ионов, зависимость подвижности от температуры и природы ионов. Числа переноса. Закон независимого движения ионов (закон Кольрауша). Коэффициент электрической проводимости. Методы измерения электропроводности растворов электролитов. Измерение удельной электропроводности. Постоянная ячейки. Основы теории электрической проводимости Онзагера. Электрофоретический и релаксационный эффекты торможения ионов в электрическом поле. Эффекты Вина и Дебая-Фалькенгагена. Подвижность и числа переноса. Влияние различных факторов на подвижность ионов. Предельная подвижность ионов. Эстафетный механизм перемещения заряда. Применение измерений электропроводности для определения констант диссоциации и гидролиза, энтальпии и энтропии электролитической диссоциации, для аналитических целей (кондуктометрическое титрование).
Электропроводность неводных растворов электролитов. Влияние концентрации электролита на электропроводность неводных растворов с низкой диэлектрической проницаемостью растворителя. Правило Вальдена. Сольватированные электроны. Строение ионных жидкостей. Электропроводность расплавов. Зависимость эквивалентной электропроводности расплавов электролитов от температуры. Проблема сравнения электропроводности различных расплавов. Явление стеклования. Практическое значение расплавов электролитов.
Твердые электролиты. Электропроводность твердых электролитов. Механизмы электропроводности твердых тел. Зависимость электропроводности твердых электролитов от температуры. Суперионные проводники.
Материал для повторения
Таблица 2.1.
| Предмет
| Раздел
| Вопросы для повторения
|
| Физика
| Электричество и магнетизм
| Электрический заряд. Носители заряда. Закон сохранения электрического заряда.
Закон Кулона. Работа сил электростатического поля. Потенциал. Электрический диполь. Силы, действующие на диполь в электрическом поле. Проводники в электростатическом поле. Силы, действующие на проводники в электрическом поле. Диэлектрики. Диэлектрическая проницаемость. Поляризация ионных кристаллов. Электрические свойства кристаллов. Постоянный электрический ток. Сила и плотность тока. Электрическое напряжение. Закон Ома для участка цепи. Электросопротивление. Удельная электропроводность вещества. Закон сохранения энергии для цепей постоянного тока. Переменный синусоидальный ток. Закон Ома для цепей переменного тока. Механизмы электропроводности. Проводники. Электролиты. Закон Фарадея.
|
2.3. Основные понятия и соотношения, используемые при решение задач
Таблица 2.2.
| Понятие
| Символ
| Размерность
| Определение
|
| 1
| 2
| 3
| 4
|
| Миграция (перенос) ионов
| -
| -
| Направленное движение (перенос) ионов к электродам противоположного знака под влиянием электрического поля
|
| Электропроводность
| L
| Ом–1 (обратный ом);
См (сименс)
| Электропроводность (L) представляет собой суммарный электрический заряд, проходящий через вещество за единицу времени, при приложении к нему разности потенциалов в 1 В.
L можно выразить как величину обратную сопротивлению проводника R:
L = 1 / R
|
| Сопротивление раствора
| R
| Ом
| Как и для металлических проводников, сопротивление (R) растворов рассчитывается по формуле: R = ρ ·  ,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов) ,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов)
|
Продолжение таблицы 2.2
| 1
| 2
| 3
| 4
|
| Удельная электропроводность
| ϰ
| См ∙ м–1;
Ом–1 ∙ м–1;
В справочной литературе ϰ часто выражается в Ом–1∙ см–1
или
См ∙ см–1
| Удельная электропроводность (ϰ) – величина, обратная удельному сопротивлению (r).
ϰ =  = = 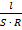 ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
|
| Постоянная кондуктометрической ячейки
| К
|
м-1
| К =  ,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К = ,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К =  ,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2) ,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2)
|
| Эквивалентная электропроводность
| λV ;
λ
(Λ)
| 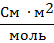
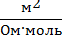 В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2
В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2
| Эквивалентная электропроводность – электрическая проводимость слоя раствора электролита толщиной 1 м, находящегося между одинаковыми электродами с такой площадью, чтобы объем жидкости, заключенный между ними, содержал 1 моль эквивалентов растворенного вещества.
Нижний индекс в символе «λV» обозначает объем раствора, содержащий 1 моль эквивалентов электролита.
|
Продолжение таблицы 2.2
| 1
| 2
| 3
| 4
|
| Эквивалентная электропроводность при бесконечном разбавлении
| λ∞
или
λ0
| См ∙ моль–1∙ м2
Ом–1∙моль–1∙м2
или
См∙моль–1∙см2
Ом–1∙моль–1∙см2
| Предельное значение электропроводности в условиях бесконечного разбавления, когда силы взаимодействия между ионами практически отсутствуют: λ∞ = λ+0+ λ–0,
где λ+0 и λ–0 – эквивалентные электропроводности катионов и анионов при бесконечном разбавлении
|
| Ионные электропроводности или подвижности ионов
| λλк
λа
| См ∙ моль–1∙ м2
Ом–1∙моль–1∙м2
или
См∙моль–1 ∙см2
Ом–1∙моль–1∙см2
| Произведение числа Фарадея на абсолютную скорость движения иона называют подвижностью иона.
Подвижность катиона и аниона представляет собой часть эквивалентной электропроводности λ, которая приходится на долю катиона и аниона:
λк = F ∙ uк
λа = F ∙ ua,
где F – постоянная Фарадея, равная 96500 Кл;
uк, ua – абсолютные скорости движения (м/с), соответственно, катионов и анионов при приложенной разности потенциалов 1 В/м.
|
| Абсолютная скорость движения иона
| ui
| м2∙B–1∙c–1
| Абсолютная скорость движения иона –– это расстояние в метрах, которое проходит ион за 1 с при градиенте потенциала 1 В/м. Численные значения абсолютных скоростей движения ионов в данном растворителе зависят только от их природы ионов и температуры.
|
Окончание таблицы 2.2.
| 1
| 2
| 3
| 4
|
| Предельные электропроводности (или предельные подвижности) ионов
| λ0к
λ0а
или
λ0+ λ0–
или
λ∞+ λ∞–
| См ∙ моль–1∙ м2
Ом–1∙моль–1∙м2
или
См∙моль–1∙см2
Ом–1∙моль–1∙см2
| Часть эквивалентной электропроводности λ0, которая приходится на долю катиона и аниона при бесконечном разбавлении.
λ0+ = F ∙ u0к; λ0– = F ∙ u0a,
где F – постоянная Фарадея;
u0к, u0a – абсолютные скорости движения (электрические подвижности, м/с), соответственно, катионов и анионов при приложенной разности потенциалов 1 В/м.
|
| Коэффициент электропроводности
| f
| –
| Величина, характеризующая степень электростатического взаимодействия между ионами в растворе: f = 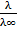
|
| Числа переноса ионов
(эффективные)
| ti
t+
t–
| –
| Доля количества электричества, переносимого ионами данного вида:
ti = 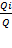 где Q – количество электричества, Кл;
Q = I ∙ τ,
где I – сила тока, А; τ – время, c.
Число переноса равно отношению подвижности данного иона к сумме подвижностей катиона и аниона:
t+ = u + / (u + + u -) = λ+/(λ + + λ -)
t- = u - / (u + + u -) = λ-/(λ + + λ -)
где Q – количество электричества, Кл;
Q = I ∙ τ,
где I – сила тока, А; τ – время, c.
Число переноса равно отношению подвижности данного иона к сумме подвижностей катиона и аниона:
t+ = u + / (u + + u -) = λ+/(λ + + λ -)
t- = u - / (u + + u -) = λ-/(λ + + λ -)
|
| Истинные числа переноса
| Ti
| –
| Ti = ti +  ,
где – С – концентрация раствора, моль(экв)/дм3;
Ср – концентрация растворителя, моль/дм3;
x – количество перенесенной воды, моль ,
где – С – концентрация раствора, моль(экв)/дм3;
Ср – концентрация растворителя, моль/дм3;
x – количество перенесенной воды, моль
|
Расчеты чисел переноса катионов и анионов (t +; t -)
Примечание: Значения эффективных чисел переноса, определенных разными методами обычно различаются между собой.
Таблица 2.3
| Метод
| Расчетные формулы
|
| Метод Гитторфа
| t+ = 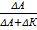 , t– = , t– = 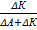 ,
где DА – убыль количества электролита в анодном пространстве (моль-экв);
DК – убыль количества электролита в катодном пространстве (моль-экв).
Для бинарного электролита с нерастворимым анодом: t+ = ,
где DА – убыль количества электролита в анодном пространстве (моль-экв);
DК – убыль количества электролита в катодном пространстве (моль-экв).
Для бинарного электролита с нерастворимым анодом: t+ = 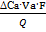 = =  ,
где ΔСа – убыль концентрации электролита в анодном пространстве;
Va – объём анодного пространства,
F число Фарадея, равное 96485 Кл/моль(экв);
Q – заряд (Кл), перенесенный в кулонометре за время электролиза;
z и y – масса электролита в граммах до и после электролиза в этом объеме,
М – молярная масса эквивалентов;
n – количество (моль) эквивалентов металла, выделившегося в кулонометре за время эксперимента.
Аналогичная формула используется для расчета числа переноса аниона (t-) при электролизе электролита с растворимым анодом. Расчеты выполняются по увеличению концентрации электролита в анодном пространстве:
t- = ,
где ΔСа – убыль концентрации электролита в анодном пространстве;
Va – объём анодного пространства,
F число Фарадея, равное 96485 Кл/моль(экв);
Q – заряд (Кл), перенесенный в кулонометре за время электролиза;
z и y – масса электролита в граммах до и после электролиза в этом объеме,
М – молярная масса эквивалентов;
n – количество (моль) эквивалентов металла, выделившегося в кулонометре за время эксперимента.
Аналогичная формула используется для расчета числа переноса аниона (t-) при электролизе электролита с растворимым анодом. Расчеты выполняются по увеличению концентрации электролита в анодном пространстве:
t- = 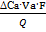 = = 
|
| Метод движущейся границы
|
ti = 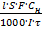 ,
где l – расстояние, на которое переместилась граница раздела между растворами двух электролитов, см;
S – площадь сечения трубки, см 2;
Сн – молярная концентрация эквивалентов электролита, моль/дм3;
I – сила тока, А;
t – время прохождения тока, с. ,
где l – расстояние, на которое переместилась граница раздела между растворами двух электролитов, см;
S – площадь сечения трубки, см 2;
Сн – молярная концентрация эквивалентов электролита, моль/дм3;
I – сила тока, А;
t – время прохождения тока, с.
|



 ,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов)
,
где ρ – удельное сопротивление проводника;
l – длина проводника (в случае раствора – расстояние между электродами);
S – площадь поперечного сечения проводника (для растворов – площадь поверхности электродов)
 =
= 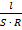 ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
ϰ характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга
 ,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К =
,
где К – постоянная ячейки; м-1
κ – удельная электропроводность, См ∙ м–1;
L – электропроводность, См.
К =  ,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2)
,
где l – расстояние между электродами, м (см);
S – площадь электродов, м2 (см2)
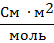
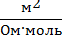 В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2
В справочной литературе для λV часто используют размерность
См∙моль–1∙см2 или
Ом–1∙моль–1∙ см2
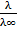
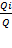 где Q – количество электричества, Кл;
Q = I ∙ τ,
где I – сила тока, А; τ – время, c.
Число переноса равно отношению подвижности данного иона к сумме подвижностей катиона и аниона:
t+ = u + / (u + + u -) = λ+/(λ + + λ -)
t- = u - / (u + + u -) = λ-/(λ + + λ -)
где Q – количество электричества, Кл;
Q = I ∙ τ,
где I – сила тока, А; τ – время, c.
Число переноса равно отношению подвижности данного иона к сумме подвижностей катиона и аниона:
t+ = u + / (u + + u -) = λ+/(λ + + λ -)
t- = u - / (u + + u -) = λ-/(λ + + λ -)
 ,
где – С – концентрация раствора, моль(экв)/дм3;
Ср – концентрация растворителя, моль/дм3;
x – количество перенесенной воды, моль
,
где – С – концентрация раствора, моль(экв)/дм3;
Ср – концентрация растворителя, моль/дм3;
x – количество перенесенной воды, моль
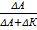 , t– =
, t– = 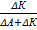 ,
где DА – убыль количества электролита в анодном пространстве (моль-экв);
DК – убыль количества электролита в катодном пространстве (моль-экв).
Для бинарного электролита с нерастворимым анодом: t+ =
,
где DА – убыль количества электролита в анодном пространстве (моль-экв);
DК – убыль количества электролита в катодном пространстве (моль-экв).
Для бинарного электролита с нерастворимым анодом: t+ = 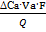 =
=  ,
где ΔСа – убыль концентрации электролита в анодном пространстве;
Va – объём анодного пространства,
F число Фарадея, равное 96485 Кл/моль(экв);
Q – заряд (Кл), перенесенный в кулонометре за время электролиза;
z и y – масса электролита в граммах до и после электролиза в этом объеме,
М – молярная масса эквивалентов;
n – количество (моль) эквивалентов металла, выделившегося в кулонометре за время эксперимента.
Аналогичная формула используется для расчета числа переноса аниона (t-) при электролизе электролита с растворимым анодом. Расчеты выполняются по увеличению концентрации электролита в анодном пространстве:
t- =
,
где ΔСа – убыль концентрации электролита в анодном пространстве;
Va – объём анодного пространства,
F число Фарадея, равное 96485 Кл/моль(экв);
Q – заряд (Кл), перенесенный в кулонометре за время электролиза;
z и y – масса электролита в граммах до и после электролиза в этом объеме,
М – молярная масса эквивалентов;
n – количество (моль) эквивалентов металла, выделившегося в кулонометре за время эксперимента.
Аналогичная формула используется для расчета числа переноса аниона (t-) при электролизе электролита с растворимым анодом. Расчеты выполняются по увеличению концентрации электролита в анодном пространстве:
t- = 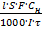 ,
где l – расстояние, на которое переместилась граница раздела между растворами двух электролитов, см;
S – площадь сечения трубки, см 2;
Сн – молярная концентрация эквивалентов электролита, моль/дм3;
I – сила тока, А;
t – время прохождения тока, с.
,
где l – расстояние, на которое переместилась граница раздела между растворами двух электролитов, см;
S – площадь сечения трубки, см 2;
Сн – молярная концентрация эквивалентов электролита, моль/дм3;
I – сила тока, А;
t – время прохождения тока, с.



