Содержание темы
Особенности электрохимических реакций. Электрохимические системы. Электрод. Электролит. Анодные и катодные процессы. Инертные электроды. Потенциалопределяющие ионы. Электрохимический потенциал. Электрохимическое равновесие на границе электрод – электролит. Термодинамическое равновесие в электрохимических системах. Равновесный электродный потенциал. Уравнение Нернста. Современные представления о механизме возникновения электродных потенциалов и двойного электрического слоя. Роль сольватации в возникновении электродного потенциала на границе металл – раствор. Обратимые и необратимые электроды. Водородный электрод. Электродные потенциалы по водородной шкале.
Классификация электродов. Электроды первого, второго рода, третьего рода, окислительно-восстановительные, газовые, мембранные (ионообменные). Стеклянный электрод. Вывод и анализ уравнений, выражающих зависимость электродных потенциалов от активностей компонентов электродных реакций для электродов различных типов. Стандартные потенциалы.
Электродвижущая сила. Схематическая запись электрохимических систем. Стандартная ЭДС. Классификация электрохимических цепей: физические, концентрационные, химические цепи. Диффузионный потенциал, механизм его возникновения и зависимость от активности и от природы электролитов. Методы устранения диффузионных потенциалов. Цепи без переноса и с переносом. Термодинамическое выражение для равновесного электродного потенциала в гальваническом элементе. Методы измерения ЭДС гальванических элементов и электродных потенциалов. Электроды сравнения.
Взаимодействие между металлом и раствором. Переход катионов с поверхности металла в раствор и из раствора на поверхность металла. Энергия сольватации. Двойной электрический слой. Строение двойного электрического слоя. Плотная и диффузная часть двойного электрического слоя. Распределение потенциала в двойном электрическом слое.
Определение коэффициентов активности на основании измерений ЭДС. Применение измерений ЭДС для определения изменений термодинамических функций при электродных реакциях, констант равновесия, произведения растворимости малорастворимых электролитов, активности электролитов и др. Применение измерений ЭДС для определения рН растворов. Прямая потенциометрия. Потенциометрическое титрование.
Общая характеристика электрохимических процессов. Скорость электрохимической реакции. Стадии электродных процессов. Процессы массопереноса, электрохимические и химические стадии. Влияниеотдельных стадий на скорость электродного процесса. Понятие лимитирующей стадии электродной реакции. Поляризация электродов. Концентрационная поляризация. Предельный ток. Электрохимическая поляризация. Ток обмена. Влияние двойного электрического слоя на скорость стадии разряда. Зависимости скорости электрохимической реакции от температуры, материала электрода и растворителя. Уравнение Тафеля. Кинетика выделения водорода. Перенапряжение. Механизм восстановления молекулярного кислорода.
Материал для повторения
Таблица 3.1
| Предмет
| Тема
| Вопросы для повторения
|
| Общая химия
| Окислительно-восстановительные реакции. Основы электрохимии
| Окислительно-восстановительные реакции. Химические источники электрической энергии. Электролит. Электроды. Электрохимические цепи. Элемент Якоби-Даниэля. Работа электрического тока. Электродвижущие силы. Электродные потенциалы. Уравнение Нернста. Водородный электрод. Потенциал стандартного водородного электрода. Водородная шкала потенциалов. Электроды сравнения. Влияние рН раствора на значение электродного потенциала. Ряд стандартных электродных потенциалов.
|
| Физика
| Электричество и магнетизм
| Потенциал. Разность потенциалов. Напряженность электростатического поля. Поверхностный заряд. Плотность поверхностного заряда. Напряженность электростатического поля. Потенциал поля точечного заряда. Потенциал поля системы точечных зарядов. Энергия взаимодействия двух точечных зарядов в электрическом поле. Связь напряженности электростатического поля с разностью потенциалов. Поле заряженного проводника
|
| Физика
| Электричество и магнетизм
| Поверхностный заряд проводника. Плотность поверхностного заряда проводника. Проводники в электростатическом поле. Конденсаторы. Электроемкость. Энергия заряженного конденсатора. Энергия электрического поля.
Электрическое поле в диэлектриках. Электрический диполь. Энергия диполя в электрическом поле. Поляризация диэлектриков. Ориентационная (дипольная) поляризация.
Постоянный электрический ток. Сила тока. Плотность тока. Закон Ома для участка цепи. Источники тока. ЭДС. Закон Ома для участка цепи с ЭДС.
|
Основные понятия и соотношения, используемые при решении задач
Таблица 3.2
| Понятие
| Символ
| Размерность
| Определение, формула
|
| 1
| 2
| 3
| 4
|
| Электродный потенциал
| j
(Е)
| В
| Электродный потенциал – ЭДС элемента, составленного из данного электрода и стандартного водородного электрода, электродный потенциал которого принят равным нулю.
Знак электродного потенциала считают положительным, если в гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом.
При записи электродного потенциала стандартный водородный электрод всегда располагается слева:
Pt,H2 | H2SO4 || CuSO4 | Cu | Pt (j > 0)
Pt,H2 | H2SO4 || ZnSO4 | Zn | Pt (j < 0)
Вертикальная черта «|» обозначает границу между фазами; «||» – солевой мостик.
|
| Стандартный электродный потенциал
| j0
(Е0)
| В
| Стандартный электродный потенциал – ЭДС гальванического элемента, содержащего в качестве левого электрода стандартный водородный электрод (j0H+/H2,Pt = 0), а в качестве правого электрода – измеряемый электрод, в условиях, когда активности всех участников окислительно-восстановительных реакций равны единице, внешнее давление составляет 101325 Па (1 атм) и диффузионный потенциал устранен.
|
| Электродвижущая сила
(ЭДС)
| Е
| В
| Электродвижущая сила (ЭДС) – разность потенциалов на концах правильно разомкнутой равновесной электрохимической цепи.
E = jкатод – jанод
|
Окончание таблицы 3.2
| 1
| 2
| 3
| 4
|
| Диффузионный потенциал
| Δjдифф
| В
| Разность потенциалов, возникающая на границе раздела между двумя неодинаковыми (качественно и (или) количественно) растворами электролитов. Δjдифф обусловлен диффузией ионов через границу раздела и вызывает торможение более быстро диффундирующих ионов и ускорение более медленно диффундирующих ионов (как катионов, так и анионов). Диффузионный потенциал, является гальвани-потенциалом между точками, находящимися в разных по химическому составу фазах, потому его измерить нельзя.
Значение Δjдифф на границе двух растворов одного 1,1-зарядного электролита разной концентрации можно рассчитать по формуле: Δjдифф = ±  · · 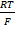 ln ln 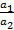 ,
где lk и la – подвижности катиона и аниона;
а1 и а2 – активности, причем а1 > а2;
если lk > la в уравнении знак «+»;
если lk < la в уравнении знак «–»
Для 2,2-зарядных электродов: Δjдифф = ± ,
где lk и la – подвижности катиона и аниона;
а1 и а2 – активности, причем а1 > а2;
если lk > la в уравнении знак «+»;
если lk < la в уравнении знак «–»
Для 2,2-зарядных электродов: Δjдифф = ±  · ·  ln ln 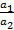
|
| Мембранный потенциал
|
| В
| Алгебраическая сумма скачков потенциалов на противоположных поверхностях
мембраны называется мембранным потенциалом. Скачки потенциала на противоположных границах направлены противоположно друг другу
|
| Константа равновесия
| К
|
| lgK = 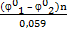 ,
где K – константа равновесия;
j01 и j02 – стандартные потенциалы окислителя и восстановителя соответственно;
n – число электронов, отдаваемых восстановителем или принимаемых окислителем ,
где K – константа равновесия;
j01 и j02 – стандартные потенциалы окислителя и восстановителя соответственно;
n – число электронов, отдаваемых восстановителем или принимаемых окислителем
|
Электрохимические цепи
Таблица 3.3
| Цепь
| Определение, схематическая запись
|
| Цепь с переносом
| Электрохимическая цепь, содержащая границу двух различных растворов, называется цепью с переносом.
Схематическая запись цепи с переносом:
M1 | раствор(I) ⁞ раствор (II) | M2| M1
|
| Цепь без переноса
| Электрохимическая цепь, не содержащая границ двух растворов, называется цепью без переноса.
Схематическая запись цепи без переноса: M1 | раствор | M2 | M1
|
| Цепь с элиминированным диффузионным потенциалом
| Цепь, в которой резкое снижение диффузионного потенциала достигается за счет включения между двумя растворами солевого мостика – концентрированного раствора соли с близкими значениями подвижностей катионов и анионов (λ0+ ≈ λ0– ≈ 0,5).
Электрохимическую цепь с элиминированным диффузионным потенциалом схематически изображают следующим образом:
M1| раствор (I) || раствор (II) | М2| M1
|
| Схема цепи со стеклянным электродом
| Пример цепи для измерения рН: стеклянный электрод/раствор/солевой мостик/каломельный электрод:
Pt | Ag, AgCl | НСl (0,1 М) | ст. мембр. | раствор || KCl | Hg2Cl2, Hg | Pt
Потенциал стеклянного электрода зависит от рН раствора, в который погружен данный электрод: j = j0 +  · рН · рН
|



 ·
· 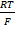 ln
ln 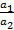 ,
где lk и la – подвижности катиона и аниона;
а1 и а2 – активности, причем а1 > а2;
если lk > la в уравнении знак «+»;
если lk < la в уравнении знак «–»
Для 2,2-зарядных электродов: Δjдифф = ±
,
где lk и la – подвижности катиона и аниона;
а1 и а2 – активности, причем а1 > а2;
если lk > la в уравнении знак «+»;
если lk < la в уравнении знак «–»
Для 2,2-зарядных электродов: Δjдифф = ±  ln
ln 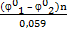 ,
где K – константа равновесия;
j01 и j02 – стандартные потенциалы окислителя и восстановителя соответственно;
n – число электронов, отдаваемых восстановителем или принимаемых окислителем
,
где K – константа равновесия;
j01 и j02 – стандартные потенциалы окислителя и восстановителя соответственно;
n – число электронов, отдаваемых восстановителем или принимаемых окислителем
 · рН
· рН



