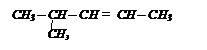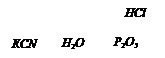Муравьиная кислота. Метановая НСООН.
Бесцветная жидкость с острым запахом, жгучим вкусом, при попадании на кожу вызывает ожоги. В промышленности получают нагреванием порошкообразной NаОН с СО. Полученную соль обрабатывает разбавленной серной кислотой.(Н2SO4)
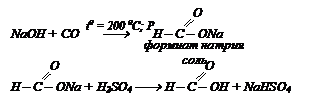
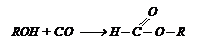 Из спирта и СО получают эфиры муравьиной кислоты:
Из спирта и СО получают эфиры муравьиной кислоты:
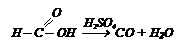 Так как муравьиная кислота отличается от других кислот строением, она отличается и свойствами. Она разлагается под действием катализаторов:
Так как муравьиная кислота отличается от других кислот строением, она отличается и свойствами. Она разлагается под действием катализаторов:
Наличие в ее молекуле альдегидной группы
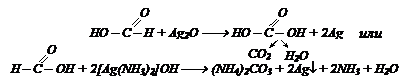 обуславливает ее восстанавливающие свойства. Она дает реакцию «серебряного зеркала»:
обуславливает ее восстанавливающие свойства. Она дает реакцию «серебряного зеркала»:
Восстанавливает соли тяжелых металлов до металлов:
Нагреванием натриевой соли муравьиной кислоты с последующей обработкой серной кислотой получают щавелевую кислоту:
Муравьиная кслота используется в текстильной промышленности в качестве протравы, в кожевенной при дублении кожи, для консервирования кормов, в органическом синтезе.
Уксусная кислота (этановая кислота) СН3 – СООН - бесцветная жидкость с резким запахом, кислым жгучим вкусом. Безводная уксусная кислота – бесцветные кристаллы, как лед;
tпл = +16,6 0С поэтому ее называют ледяной.
Получается в промышленности:
1) окислением уксусного альдегида;
2) окислением этилового спирта:
| |
| | | СН3 – СН2ОН + О2 ¾® СН3 – СООН + Н2О
| |
3) прямым окислением бутана:
 4) оксосинтезом метилового спирта:
4) оксосинтезом метилового спирта:
Уксусная кислота используется для получения этилацетата, ацетата целлюлозы, уксусного ангидрида. Соли ее – ацетаты алюминия, хрома, железа – используются при крашении тканей в качестве протрав, соли свинца для изготовления свинцовых белил, соли меди (парижская зелень) для борьбы с вредителями в сельском хозяйстве.
Бензойная кислота С6Н5СООН – это белое криталлическое вещество, tпл = 122 0С, легко возгоняется, плохо растворима в холодной воде, лучше в горячей и органических растворителях. Получается в промышленности:
1) окислением толуола и других гомологов бензола:
2) гидролизом бензотрихлорида:
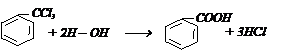
Она вступает в реакции по карбоксильной группе и бензольному ядру. Применяется в производстве красителей и в качестве консервирующего вещества.
Вопросы для самопроверки.
- Какие соединения называются карбоновыми кислотами? Их общая формула. Классификация.
- Одноосновные карбоновые кислоты. Их общая формула. Изомерия.
- Номенклатура: Р.н. и М.н. Кислотный ацил.
- Способы получения.
- Физические свойства. Ассоциации кислот – линейная и димерная. Водородная связь.
- Химические свойства. Строение карбоксильной группы. Взаимное влияние атомов в молекуле кислоты.
- Кислотные свойства, образование солей, гидролиз солей.
- Образование производных: хлорангидридов, ангидридов, сложных эфиров, амидов.
- Реакции окисления, восстановления. Замещение a-водорода в молекуле кислоты.
- Муравьиная кислота, получение в промышленности, отличительные свойства, применение.
- Уксусная кислота, получение в промышленности, применение. Какой из способов получения является экономически выгодным?
- Бензойная кислота, получение в промышленности, применение.
- Почему в молекуле кислоты в карбонильной группе не происходит разрыва двойной связи?
- Расположите в ряд по уменьшению кислотных свойств следующие кислоты:
| |
| |  |
- С помощью какой реакции можно оличить муравьиную кислоту от уксусной?
- Какие соли и какой кислоты применяются в строительстве, в медицине, в текстильной промышленности, в сельском хозяйстве, при консервировании.
- В четырех пробирках находятся растворы муравьиной кислоты, уксусной кислоты, муравьиного альдегида, этанола. Определите в какой пробирке какие вещества находятся. Напишите соответствующие уравнения реакциий.
- Разделите смесь, состоящую из бензола, этанола, уксусной кислоты.
16. 7 Обучающеезадание№1.
Напишите структурные формулы:
1) третбутилуксусной кислоты и назовите по М.н.;
2) 2,3-диметилпентановой кислоты и назовите по Р.н.
 Решение:
Решение:
I.
| | | | |
| | | 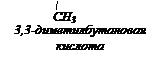 |
| |
| | | СН3 – СН2 – СН – СН – СООН
| |
| вторбутилметилуксусная
кислота
| |

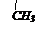
II.
Обучающее задание №2.
С помощью магнийорганического соединения и СО2 получите изомасляную кислоту.
Решение: пишем формулу этой кислоты
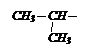 Эта кислота состоит из карбоксильной группы и радикала изопропила, который должен войти в состав МОС.
Эта кислота состоит из карбоксильной группы и радикала изопропила, который должен войти в состав МОС.
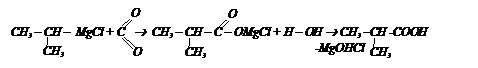
Обучающее задание №3.
Осуществите следюущие превращения:
Решение:
Обучающее задание №4.
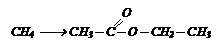 Исходя из метана и используюя неорганические реагенты получите этилацетат, написав соответствующие уравнения реакций.
Исходя из метана и используюя неорганические реагенты получите этилацетат, написав соответствующие уравнения реакций.
Решение:
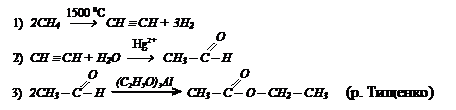 I способ:
I способ:
 II способ:
II способ:
 III способ:
III способ:
Обучающее задание №5.
Исходя из бутана получите ангидрид уксусной 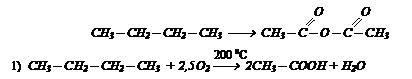 кислоты, используя неорганические реагенты.
кислоты, используя неорганические реагенты.
Решение:
Обучающее задание №6.
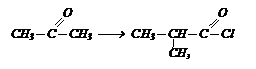 Исходя из ацетона получите хлорангидрид изомасляной кислоты, используя неорганические реагенты:
Исходя из ацетона получите хлорангидрид изомасляной кислоты, используя неорганические реагенты:
Решение:
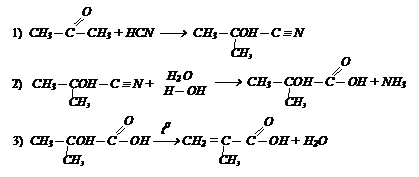 В исходное вещество необходимо ввести углеродный атом. Это можно осуществить действием НСN.
В исходное вещество необходимо ввести углеродный атом. Это можно осуществить действием НСN.
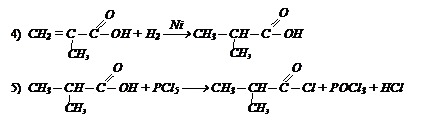
Обучающее задание №7.
В четырех колбах без этикеток находятся растворы уксусной кислоты, муравьиной кислоты, муравьиного альдегида, уксусного альдегида. С помощью химических реагентов определите эти вещества.
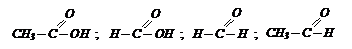 Решение: напишем формулы этих веществ
Решение: напишем формулы этих веществ
Опустим в каждую колбу синие лакмусовые бумажки. Они покраснеют в колбах с кислотами СН3СООН и НСООН. Из этих колб отольем растворы в две пробирки и в каждую добавили реактив [Ag(NH3)2]OH (протекает реакция «серебряного зеркала»). В пробирке, где находится муравьиная кислота образуется серебряный налет.
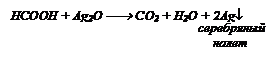
Обнаружены СН3СООН и НСООН.
Отольем в две пробирки растворы уксусногои муравьиного альдегидаи в каждую вольем NаОН. Уксусный альдегид конденсируется в альдоль, из которого затем образуется краснобурая жидкость (ВМС):
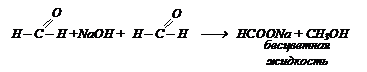 а муравьиный альдегид не изменяет цвета, т.к. получается:
а муравьиный альдегид не изменяет цвета, т.к. получается:
Обучающее задание №8.
Массовая доля углерода в предельной одноосновной кислоте равна 54,6%. Установите формулу этой кислоты.
Решение: общая формула одноосновной предельной кислоты СnН2nО2. Возьмем 100 г кислоты:
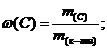

0,546(14n + 32) = 12n; n = 4.
Обучающее задание №9.
Через 150 г раствора уксусной кислоты с массовой долей кислоты 20% пропустили аммиак объемом 4,48 л. Определите массовую долю уксусной кислоты в полученном растворе.
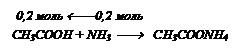 Решение:
Решение:
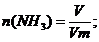

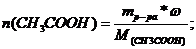 В растворе было уксусной кислоты:
В растворе было уксусной кислоты:
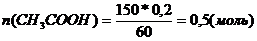
На взаимодействие с NН3 израсходовалось 0,2 моль кислоты, следовательно в растворе ее осталось 0,5 – 0,2 = 0,3 (моль).
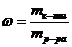
| | | | |
| | | | mр-ра = mр-ра к-ты + mNН3;
| |
| |
| | | mр-ра = 150 + n(NН3)*М(NН3) = 150 + 0,2*17 = 153,4 г
М(СН3СООН) = 60 г/моль
| |
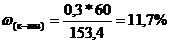
Ответ: 11,7%.
Обучающее задание №10.
Определите массу эфира, полученного при взаимодействии 12 г уксусной кислоты с 18,4 мл этилового спирта с массовой долей 95% и r = 0,79 г/моль, если выход эфира составил 90%.
 Решение:
Решение:
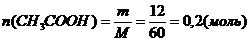
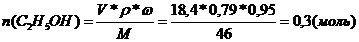
Следовательно спирт в избытке и расчет ведем по кислоте:
M(эфира) = 88 г/моль
m(эфира) = n*Mэф = 0,2*88 = 17,6 (г) – это теоретический выход.
Определяем практический выход:
| |
| | | mпр = h*mтеор = 17,6*0,9 = 15,84 (г)
| |
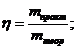
Ответ: 15,84 г.
Обучающее задание №11.
При сплавлении натриевой соли одноосновной органической кислоты с гидроксидом натрия выделилось 11,2 л газа (н.у.), плотность которого равна 1,965 г/л. Вычислите массу соли, вступившей в реакцию. Какой газ при этом выделился.
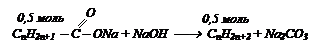 Решение: напишем уравнения реакции сплавления органической кислоты в общем виде:
Решение: напишем уравнения реакции сплавления органической кислоты в общем виде:
| | | | |
| | | | Мгаза=r*Vm=1,965*22,4=44г/моль
| |
| |
| | 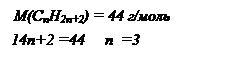 |
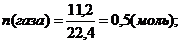
Формула газа СН3 – СН2 – СН3 – пропан
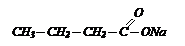 А так как соль содержит на один углеродный атом больше, следовательно формула соли будет:
А так как соль содержит на один углеродный атом больше, следовательно формула соли будет:
М(соли) = 110 г/моль; m(соли) = n*M = 0,5*110 = 55 г. Ответ: 55 г.
16.8 Контрольное задание №1.
| Какое из указанных веществ являются:
|
| 1. одноосновной насыщенной кислотой
| | А. СН3 – СО – О – СО – СН3
| |
|
| 2. одноосновной ненасыщенной кислой
| 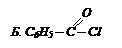
|
| 3. двухосновной насыщенной кислотой
| | В. СН3 – СН2 – СН2 – О – СН2 – СН3
| |
|
| 4. ароматической кислотой
| 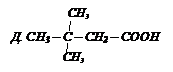
|
| 5. галогенангидридом кислоты
| 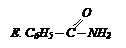
|
| 6. сложным эфиром
| 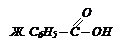
|
| 7. простым эфиром
|
|
| 8. амидом кислоты
|
|
| 9. ангидридом кислоты
| | И. НООС – СН2 – СН2 – СООН
| |
|
Контрольное задание №2.
| Какое из написанных справа соединений соответствует названиям слева?
|
| А. С2Н5 – СО – О – СО – С2Н5
| | 1) 2-метилпентановая кислота
|
|
| 2) фенилуксусная кислота
|
|
| 3) пропионат Nа
| 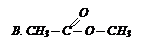
|
| 4) формамид
| | Г. СН3(СН2)2 – СН(СН)3 – СООН
| |
|
| 5) метилацетат
| 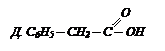
|
| 6) пропионовый ангидрид
|
|
| 7) триметилуксусная кислота
| 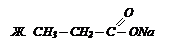
|
| 8) щавелевая кислота
|
|
| 9) валерьяновая кислота
|
|
Контрольное задание №3.
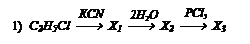 Какие вещества получаются в следующих превращениях? Какие вещества получаются в следующих превращениях?
|
| А. С3Н7ОН;С2Н5СН2ОNa;С3Н7ОСН3
| | 
|
|
| Б. (СН3)2СНО –СN;(СН3)2СОН–СООН;
(СН3)2ССl –СООН
| |
|
|
 | В. С6Н6; С6Н5СН3; С6Н5СООН;
С6Н5СООNН4
| |
|
|
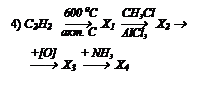 | Г. С2Н4СlСООН; С2Н3СООН;
С2Н5СООН
| |
|
|
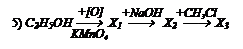
| | Д. С2Н5СN; С2Н5СООН;
С2Н5СОСl
| |
|
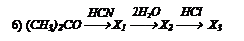
| | Е. С3Н6О2; С3Н5СlО2;
СН3СНОНСООН
| |
|
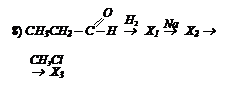 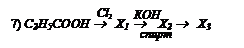
| | Ж. (СН3)2СНСОMgCl;
(СН3)2СНСООН; (С4Н7О2)2Са
| |
|
| З. СН3СООН; СН3СООNа;
СН3СООСН3
| |
|
|
| Напишите все указанные уравнения реакций.
|
Тест №1.
|
| Задание
| Ответы
| Код
|
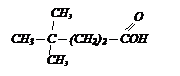 А А
| Назовите соединение:
| 2,2-диметилбутановая кислота
|
|
| изобутил уксусная кислота
|
|
| 4,4-диметилпентановая киcлота
|
|
| третизобутилуксусная кислота
|
|
| Б
| Какое соединение необходимо взять для получения
2-метилбутановой кислоты:
| 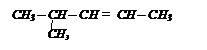
|
|
| (СН3)2СН – СН2 – СН2ОН
|
|
| (СН3)2СН – СН2MgCl + СО2
|
|
| С2Н5 – СН(СН3) – СН2ОН
|
|
| В
| Расположите в ряд по уменьшению кислотных свойств кислоты: СН3СООН; С6Н5СООН; НСООН; С3Н6О2:
| НСООН; С3Н6О2; С2Н4О2; С6Н5СООН
|
|
| С6Н5СООН; СН3СООН; НСООН; С3Н6О2
|
|
| НСООН; С6Н5СООН; СН3СООН; С3Н6О2
|
|
| НСООН; СН3СООН; С3Н6О2; С6Н5СООН
|
|
| Г
| Осуществите превращения, 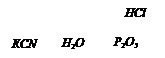 | С2Н5ОН ¾® Х1
¾® Х2 ¾® Х3 ¾® Х4
| | напишите уравнения реакции:
| С2Н5Сl; С3Н5N; С3Н6О2; С3Н8О
|
|
| С2Н4; С3Н3N; С3Н4О2; С3Н6О2
|
|
| С2Н5Cl; С3Н5N; С3Н6О2; С6Н10О3
|
|
| С2Н5Сl; С3Н5N; С3Н6О2; С6Н14О2
|
|
| Д
| Определите объем газа, выделившегося при взаимодействии 15 г уксусной кислоты с 12 г кальция.
| 5,6 л
|
|
| 2,8 л
|
|
| 0,25 моль
|
|
| 6,72 л
|
|
Тест №2
|
| Задание
| Ответы
| Код
|
| А
| Назовите соединение: (СН3)2СН – (СН2)2 - СООН
| 2,2-диметилбутановая кислота
|
|
| изопропилуксуная кислота
|
|
| 4,4-диметилпентановая кислота
|
|
| изопропилметилуксусная кислота
|
|
| Б
| Какое соединение необходимо взять для получения 3-метилбутановой кислоты?
| (СН3)2СН – СН = СН2
|
|
| (СН3)2СН – СН2 – СН2ОН
|
|
| (СН3)2СНMgCl + СО2
|
|
| (СН3)2СН – С º N + Н2О
|
|
| В
| Расположите в ряд по уменьшению кислотных свойств кислоты: С4Н8О2; СН3СООН; НСООН; С6Н5СООН
| НСООН; С2Н4О2; С6Н5СООН; С4Н8О2
|
|
| С6Н5СООН; С2Н4О2; СН3СООН; НСООН
|
|
| СН3СООН; С6Н5СООН; С4Н8О2; НСООН
|
|
| НСООН; С6Н5СООН; С2Н4О2; С4Н8О2
|
|
| Г
| Осуществите превращения, написав уравнения реакции:
Н2O [O] Ca(OH)2
СН º СН ® Х1 ® Х2 ®
t0
Х3 ® Х4
| С2Н4О; С2Н4О2; С2Н5ОСа; С2Н4
|
|
| С2Н4О; С2Н4О2; С4Н6О4Са; С3Н6О
|
|
| С2Н4О; С2Н4О2; С2Н5ОСа; С2Н4О
|
|
| С2Н5ОН; С2Н4О; С2Н4О2; С2Н4О
|
|
| Д
| Установите формулу одноосновной предельной кислоты, если 22,2 г этой кислоты при взаимодействии с избытком магния выделяют 3,36 л газа.
| С4Н8О2
|
|
| С3Н6О2
|
|
| С2Н4О2
|
|
| С5Н10О2
|
|



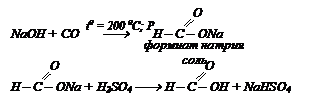
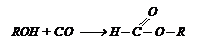 Из спирта и СО получают эфиры муравьиной кислоты:
Из спирта и СО получают эфиры муравьиной кислоты: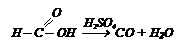 Так как муравьиная кислота отличается от других кислот строением, она отличается и свойствами. Она разлагается под действием катализаторов:
Так как муравьиная кислота отличается от других кислот строением, она отличается и свойствами. Она разлагается под действием катализаторов: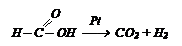
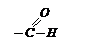
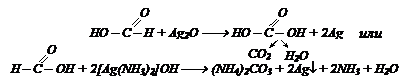 обуславливает ее восстанавливающие свойства. Она дает реакцию «серебряного зеркала»:
обуславливает ее восстанавливающие свойства. Она дает реакцию «серебряного зеркала»: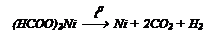
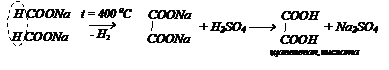

 4) оксосинтезом метилового спирта:
4) оксосинтезом метилового спирта: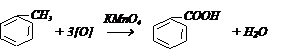

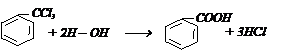

 Решение:
Решение: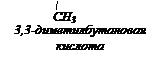

 II.
II.
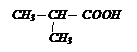
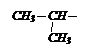 Эта кислота состоит из карбоксильной группы и радикала изопропила, который должен войти в состав МОС.
Эта кислота состоит из карбоксильной группы и радикала изопропила, который должен войти в состав МОС.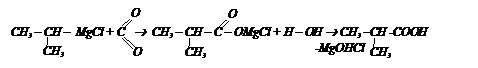

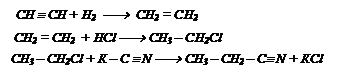

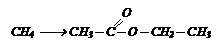 Исходя из метана и используюя неорганические реагенты получите этилацетат, написав соответствующие уравнения реакций.
Исходя из метана и используюя неорганические реагенты получите этилацетат, написав соответствующие уравнения реакций.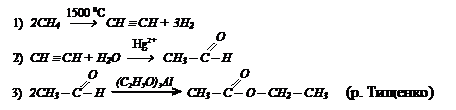 I способ:
I способ: II способ:
II способ: III способ:
III способ: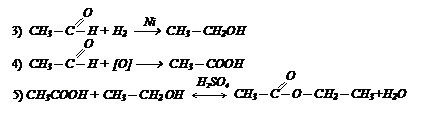
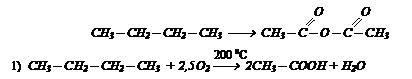 кислоты, используя неорганические реагенты.
кислоты, используя неорганические реагенты.
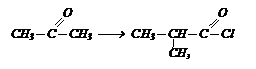 Исходя из ацетона получите хлорангидрид изомасляной кислоты, используя неорганические реагенты:
Исходя из ацетона получите хлорангидрид изомасляной кислоты, используя неорганические реагенты: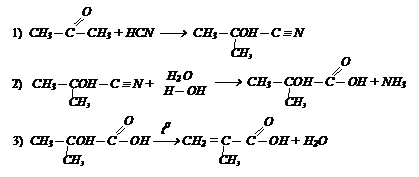 В исходное вещество необходимо ввести углеродный атом. Это можно осуществить действием НСN.
В исходное вещество необходимо ввести углеродный атом. Это можно осуществить действием НСN.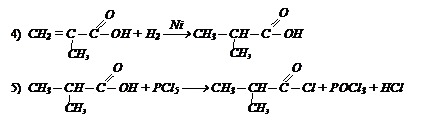
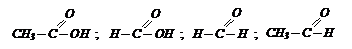 Решение: напишем формулы этих веществ
Решение: напишем формулы этих веществ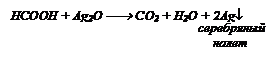

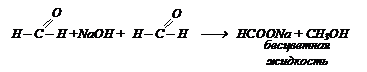 а муравьиный альдегид не изменяет цвета, т.к. получается:
а муравьиный альдегид не изменяет цвета, т.к. получается: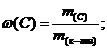

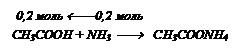 Решение:
Решение: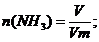

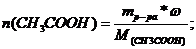 В растворе было уксусной кислоты:
В растворе было уксусной кислоты: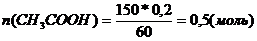
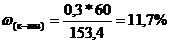
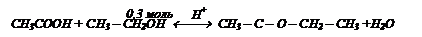
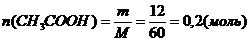
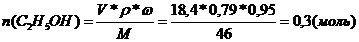
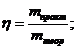
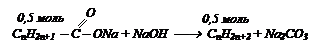 Решение: напишем уравнения реакции сплавления органической кислоты в общем виде:
Решение: напишем уравнения реакции сплавления органической кислоты в общем виде: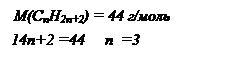
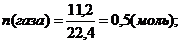
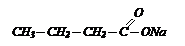 А так как соль содержит на один углеродный атом больше, следовательно формула соли будет:
А так как соль содержит на один углеродный атом больше, следовательно формула соли будет: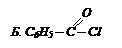
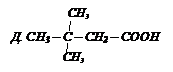
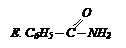
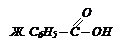
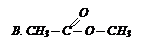
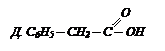
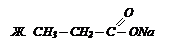
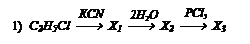 Какие вещества получаются в следующих превращениях?
Какие вещества получаются в следующих превращениях?


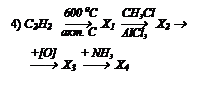
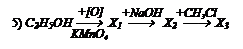
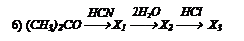
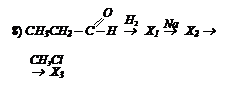
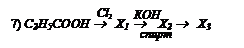
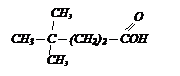 А
А