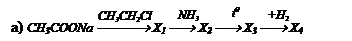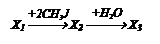Они существуют в виде трех изомеров:
Они существуют в виде трех изомеров:
Фталевая кислота – кристаллическое вещество, tпл = 200 0С, растворима в горячей воде. В промышленности получают окислением нафталина:

 Широкое применение находят фталевый ангидрид, диэфиры этой кислоты в лакокрасочной промышленности и производстве пластических масс.
Широкое применение находят фталевый ангидрид, диэфиры этой кислоты в лакокрасочной промышленности и производстве пластических масс.
Терефталевая кислота – кристаллическое вещество
tпл = 425 0С (в запаянном капиляре), так как при нагревании до 300 0С возгоняется, плохо растворима в Н2О и органических растворителях. В промышленности получают:
- окислением n-ксилола:
- изомеризацией фталата калия:

Применяется в качестве сырья для получения синтетического волокна лавсана.
Вопросы для самопроверки.
1. Высшие карбоновые кислоты, получение в промышленности. Мыла, их недостатки.
2. Одноосновные непредельные кислоты, общая формула, изомерия (структурная, пространственная).
3. Способы получения непредельных кислот.
4. Химические свойства, влияние двойной связи на силу кислоты.
5. Напишите уравнения реакций взаимодействия акриловой кислоты с Н2, НСl, Н2О, Br2 (по двойной связи).
6. Реакции по карбоксильной группе (с NаОН, Mg, СН3ОН, РСl5).
7. Акриловая кислота, получение в промышленности.
8. Метакриловая кислота, получение. Метилметакрилат, применение.
9. Двухосновные карбоновые кислоты, способы получения.
10. Химические свойства дикарбоновых кислот показать на примере щавелевой кислоты.
11. Реакции декарбоксилирования, дегидратации.
12. Щавелевая кислота, получение в промышленности, характерные свойства, применение.
13. Малоновая кислота, получение. Малоновый эфир, синтезы на его основе.
14. Малеиновая и фумаровая кислоты, получение, их свойства, малеиновый ангидрид, применение.
15. Адипиновая кислота, получение, применение.
16. Фталевая, терефталевая кислоты, получение, свойства, применение.
17. Почему мыла плохо мылятся в морской воде, поясните уравнениями реакций.
18. Почему мыла способствуют удалению загрязнений с поверхности тканей, предметов?
19. Почему одноосновные непредельные кислоты сильнее соответствующих предельных?
20. Напишите уравнение реакции полимеризаций этилового эфира акриловой кислоты.
21. Почему двухосновные карбоновые кислоты сильнее одноосновных?
22. Как можно доказать наличие двойной связи в метакриловой кислоте?
23. Почему в малоновом эфире атом водорода способен замещаться на щелочной металл?
24. Почему фумаровая кислота не образует ангидрид?
17. 8 Обучающее задание №1.
Осуществите превращения: СН4 ¾® кротоновую кислоту
Решение:

Обучающее задание №2.
Осуществите превращения:

Решение:
| | | | |
| | | 1) СН3 – СН3 ¾¾® СН º СН + 3Н2
| |
| | |  |
| |
| 2) СН º СН + СО + Н2О ¾¾® СН2 = СН – С – ОН
| |
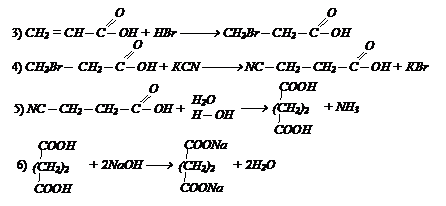
Обучающее задание №3.
 Осуществите превращения: СН º СН ¾® этиловый эфир малоновой кислоты
Осуществите превращения: СН º СН ¾® этиловый эфир малоновой кислоты
Решение:
Обучающее задание №4.

 Осуществите превращение, используя неорганические реагенты пропилен ¾® оргстекло.
Осуществите превращение, используя неорганические реагенты пропилен ¾® оргстекло.
 Решение:
Решение:
Обучающее задание №5.
Пропаналь, массой 24,8 г окислили в кислоту, в которую добавили избыток суспенции карбоната бария, при этом выделилось 4,48 л газа. Определите с каким выходом (%) прошла реакция.
 Решение:
Решение:
- должно получиться
пропионовой кислоты.
После добавления ВаСО3 определим количество газа, а следовательно, и количество вступившей и практически полученной по реакции (I) кислоты.
Тогда n(кислоты) = 0,4 (моль) реакции(II)
Ответ: 93,5%.
Обучающее задание №6.
Газ, выделившийся при нейтрализации предельной одноосновной кислоты массой 37 г водным раствором гидрокарбоната натрия, пропустили через известковую воду. Выпало 50 г осадка. Определите молекулярную формулу кислоты и объем выделившегося газа.
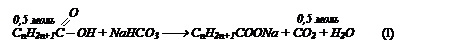 Решение: напишем уравнение реакции в общем виде:
Решение: напишем уравнение реакции в общем виде:

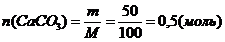 Определим количество осадка и подставим в уравнение реакции (II):
Определим количество осадка и подставим в уравнение реакции (II):
Cледовательно n(СаСО3) = n(СО2). Подставим n(СО2) в уравнение (I), тогда n(CnH2nO2) = 0,5 (моль)
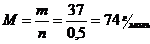 Находим молярную массу кислоты:
Находим молярную массу кислоты:
 СnH2nO2; 12n + 2n + 32 = 74; n = 3; C3Н6О2
СnH2nO2; 12n + 2n + 32 = 74; n = 3; C3Н6О2
V(СО2) = n*22,4 = 0,5*22,4 = 11,2 л
Ответ: С3Н6О2; 11,2 л СО2.
Обучающее задание №7.
При действии на смесь этанола, ацетальдегида и пропионовой кислоты массой 10,4 г избытком натрия выделилось 1,12 л водорода. Ту же массу исходной смеси можно полностью восстановить водородом объемом 4,48 л. Определите состав исходной смеси в массовых долях (%).
Решение: с натрием будут взаимодействовать этанол и пропионовая кислота.
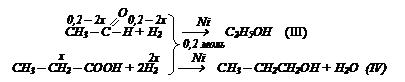 С водородом будут вступать в реакцию ацетальдегид и пропионовая кислота.
С водородом будут вступать в реакцию ацетальдегид и пропионовая кислота.
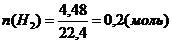
В реакции (II) обозначим n(С3Н6О2) = х моль, тогда n(Н2)р-я2 = 0,5х, а в реакции (I) n(Н2) = 0,05 – 0,5х Þ n(C2Н5ОН) = 0,1 – х. В уравнении (IV) n(С3Н6О2) = х моль; n(Н2) = 2х моль в уравнении (III) n(Н2) = 0,2 – 2х; n(альд) = 0,2 – 2х. Определяем их массы по формуле m = nM
m(C2Н5ОН) = (0,1 - х)*46 (г);
m(С2Н5О2) = 74х (г);
m(альдегид)=44(0,2 – 2х(г).
Их общая масса равна 10,4 г.
(0,1 – х)46 + 74х + 44(0,2 – 2х) = 10,4; х = 0,05(моль).
m(сп) = 0,05*46 = 2,3 (г);
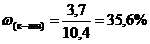 m(к-ты) = 74*0,05 = 3,7 (г);
m(к-ты) = 74*0,05 = 3,7 (г);
m(альдегида) = 4,4*0,1 = 4,4 (г);
Ответ: 22,1%С2Н5ОН; 35,6%С3Н6О2; 42,3%С2Н4О
17.9 Контрольное задание №1.
Контрольное задание №2.
1. Какая кислота более сильнее уксусная или хлоруксусная и почему?
2. Как можно получить уксусную кислоту из бутана?
3. Как можно доказать присутствие муравьиной кислоты в уксусной?
4. Предложите способы очистки уксусной кислоты от небольшого количества: а) ацетальдегида; б) пропанола.
5. Расположите в ряд по уменьшению кислотных свойств следующие кислоты: уксусную, пропионовую, муравьиную, бензойную, хлоруксусную, триметилуксусную.
6. Осуществите превращения:
7. Имея в наличии ацетилен и любые неорганические реагенты получите этиловый эфир пропионовой кислоты.
8. Из пропилена получите хлорангидрид изомасляной кислоты.
9. Пропанол-1 ¾¾® амид изомасляной кислоты.
10. Из метана и неорганических реагентов получите ангидрид пропионовой кислоты.
11. СаСО3 ¾¾® этиловый эфир бензойной кислоты.
12. Ацетон ¾¾® этиловый эфир метакриловой кислоты.
13. Метан ¾¾® щавелевую кислоту ¾¾® этиловый эфир щавелевой кислоты.
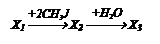
14. Уксусный альдегид
¾¾® малоновую кислоту
¾¾® диэтиловый эфир малоновый кислоты
¾¾®
(назовите).
15. Установите формулу кислоты, если массовая доля углерода в ней составляет 58,9%. Напишите структурные формулы возможных изомеров и назовите их.
16. Через 150 г 20%-ного раствора уксусной кислоты пропустили 4,48 л аммиака. Определите массовую (%) долю уксусной кислоты в полученном растворе. Ответ: 11,7%.
17. К 200 г водного раствора, содержащего 13,2 г смеси уксусной и акриловой кислот добавили 127 мл 6%-ного раствора гидроксида натрия (r = 1,05 г/моль) до полной нейтрализации. Определите массовую долю веществ в исходном растворе.
Ответ: 3% С2Н4О2; 3,6% С3Н4О2
18. Газ, образующийся при действии избытка цинка на смесь муравьиной и уксусной кислот массой 15,2 г пропустили через
3,36 л этилена на платиновом катализаторе. Этилен и Н2 прореагировали полностью. Определите массовую долю кислот в исходной смеси.
Ответ: 60,5% СН2О; 39,5% С2Н4О2.



 Они существуют в виде трех изомеров:
Они существуют в виде трех изомеров:
 Широкое применение находят фталевый ангидрид, диэфиры этой кислоты в лакокрасочной промышленности и производстве пластических масс.
Широкое применение находят фталевый ангидрид, диэфиры этой кислоты в лакокрасочной промышленности и производстве пластических масс.



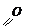
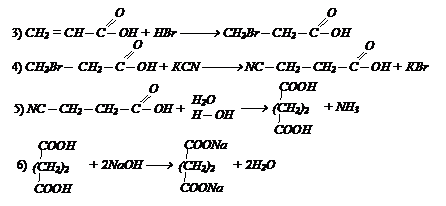
 Осуществите превращения: СН º СН ¾® этиловый эфир малоновой кислоты
Осуществите превращения: СН º СН ¾® этиловый эфир малоновой кислоты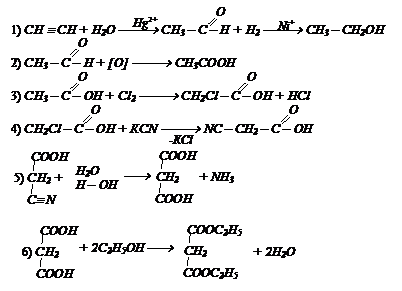

 Осуществите превращение, используя неорганические реагенты пропилен ¾® оргстекло.
Осуществите превращение, используя неорганические реагенты пропилен ¾® оргстекло. Решение:
Решение: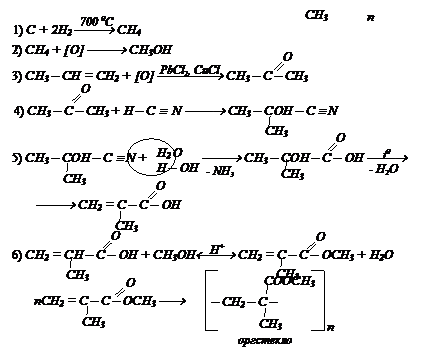
 Решение:
Решение:


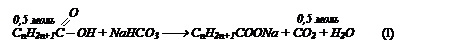 Решение: напишем уравнение реакции в общем виде:
Решение: напишем уравнение реакции в общем виде:
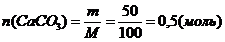 Определим количество осадка и подставим в уравнение реакции (II):
Определим количество осадка и подставим в уравнение реакции (II):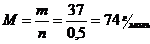 Находим молярную массу кислоты:
Находим молярную массу кислоты: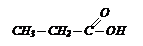 СnH2nO2; 12n + 2n + 32 = 74; n = 3; C3Н6О2
СnH2nO2; 12n + 2n + 32 = 74; n = 3; C3Н6О2
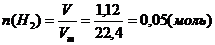
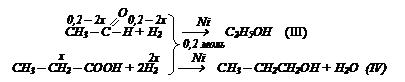 С водородом будут вступать в реакцию ацетальдегид и пропионовая кислота.
С водородом будут вступать в реакцию ацетальдегид и пропионовая кислота.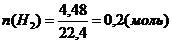

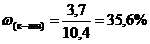 m(к-ты) = 74*0,05 = 3,7 (г);
m(к-ты) = 74*0,05 = 3,7 (г);










 Х3
Х3

 7. СН3 – СНСl – СООН;
7. СН3 – СНСl – СООН;