Пример 1. Вычисление изотонического коэффициента раствора сильного электролита по осмотическому давлению раствора.
Осмотическое давление 0,1 н. ZnSO4 при 0 ºС равно 1,59×105 Па. Вычислите изотонический коэффициент этого раствора.
Решение.
Изотонический коэффициент i показывает, во сколько раз значения осмотического давления р осм, повышения температуры кипения Δ t `кип (или понижения температуры замерзания Δ t `зам), понижения давления пара растворителя Δ р ` для раствора электролита, найденные экспериментально, больше соответствующих значений (Δ р осм, Δ t `кип,Δ t `зам, Δ р) для растворов неэлектролитов при той же молярной концентрации или молярности. Отклонение растворов электролитов от законов Вант-Гоффа и Рауля объясняется тем, что при растворении электролита в воде увеличивается общее число частиц, так как электролиты диссоциируют на ионы.
Значение изотонического коэффициента для растворов электролитов больше 1, а для растворов неэлектролитов равно 1. Осмотическое давление для растворов электролитов с учетем изотонического коэффициента равно:
р осм = i  .
.
Отсюда:
i =  =
=  =
= 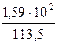 = 1,4.
= 1,4.
Пример 2. Вычисление изотонического коэффициента по давлению пара растворителя над раствором.
Давление водяного пара над раствором 24,8 г KCI в 100 г H2O при 100ºС равно 9,14×104 Па. Вычислите изотонический коэффициент, если давление водяного пара при этой температуре равно 1,0133×105 Па.
Решение.
Первый закон Рауля для электролитов выражается уравнением:
 = i
= i  ,
,
M (KCI) = 74,56 г/моль; n = 24,8/74,56 = 0,33 моль;
M (H2O) = 18,02 г/моль; N = 100/18,02 = 5,55 моль.
Изотонический коэффициент равен:
i =  =
=  =
=  =
=  =1,75.
=1,75.
Пример 3. Вычисление кажущейся степени диссоциации сильного электролита по значению изотонического коэффициента.
Изотонический коэффициент 0,2н. раствора нитрата кальция Ca(NO3)2 равен 2,48. Вычислите кажущуюся степень диссоциации этого электролита.
Решение.
В случае сильных электролитов кажущуюся степень диссоциации определяют экспериментально, она всегда меньше истинной степени диссоциации, которая близка к единице. Степень диссоциации и изотонический коэффициент электролита связаны между собой соотношением
α = 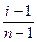 ,
,
где n – число ионов, образующихся при диссоциации молекулы вещества.
При диссоциации Ca(NO3)2 образуется три иона. Кажущаяся степень диссоциации этого электролита равна
α =  = 1,48/2 = 0,74 (или 74%).
= 1,48/2 = 0,74 (или 74%).
Пример 4. Вычисление степени диссоциации электролита по осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации LiCI в 0,1 н. растворе соли, если раствор изотоничен с 0,19 М раствором сахара C12H22O11 при 0ºС.
Решение.
Моль сахара равен 342,3 г. Осмотическое давление 0,19 М раствора сахара равно
po cм =  =
=  H/м2 = 4,31·105 Па.
H/м2 = 4,31·105 Па.
M (LiCI) = 42,39 г/моль. По осмотическому давлению определяем изотонический коэффициент раствора LiCI:
i =  =
=  = 1,9.
= 1,9.
Кажущаяся степень диссоциации в 0,1 н. LiCI равна
α =  =
=  =
=  = 0,9 (или 90%).
= 0,9 (или 90%).
Задачи для самостоятельного решения
181 - 190. Изотонический коэффициент некоторого раствора электролит концентрацией См моль/л равен i. Сколько растворенных частиц содержится в объёме V л этого раствора?
| параметры
| № задачи
|
|
|
|
|
|
|
|
|
|
|
|
| в-во
| HF
| KCI
| KNO3
| KNO3
| CaCI2
| NaOH
| MgCI2
| HNO3
| HCl
| Ba(NO3)2
|
| См моль/л
| 0,1
| 0,2
| 0,2
| 9×10-2
| 3,37
| 0,2
| 0,1
|
| 1,87
| 0,12
|
| i
| 1,15
| 1,81
| 1,78
| 2,0
| 1,78
| 1,8
| 2,5
| 1,03
| 1,66
| 1,92
|
| V, л
| 1,1
| 2,1
| 3,2
| 4,6
| 7,4
| 5,8
| 5,2
| 8,6
| 4,9
| 4,7
|
191 – 200. Осмотическое давление некоторого вещества концентрацией См моль/л при температуре t ºС равно р осм Па. Вычислите изотонический коэффициент этого раствора.
| параметры
| № задачи
|
|
|
|
|
|
|
|
|
|
|
|
| См моль/л
| 0,1
| 0,05
| 0,06
| 0,07
| 0,08
| 0,09
| 0,11
| 0,12
| 0,13
| 0,14
|
| t ºС
|
| 1,5
|
| 2,5
|
| 3,5
|
| 4,5
|
| 5,5
|
| р осм ×105Па
| 1,58
| 1,46
| 1,38
| 1,47
| 1,33
| 1,40
| 1,56
| 1,42
| 1,87
| 1,94
|
201 - 210. Рассчитайте кажущуюся степень диссоциации вещества в растворе концентрацией Сн моль/л, если изотонический коэффициент раствора данного вещества равен i. Вычислите осмотическое давление этого раствора при температуре t ºС.
| параметры
| № задачи
|
|
|
|
|
|
|
|
|
|
|
|
| в-во
| KCI
| KNO3
| NaOH
| MgCI2
| HF
| HNO3
| HCl
| Ba(NO3)2
| KNO3
| CaCI2
|
| i
| 1,81
| 1,78
| 1,8
| 2,5
| 1,15
| 1,03
| 1,66
| 1,92
| 2,0
| 1,78
|
| Сн моль/л
| 0,2
| 0,2
| 0,2
| 0,2
| 0,1
|
| 1,87
| 0,24
| 9×10-3
| 6,73
|
| t ºС
|
|
|
|
|
|
|
|
|
|
|
Буферные растворы.
Пример 1. Вычисление рН буферного раствора.
1 л буферного раствора содержит 0,01 моль ацетата натрия и 0,1 моль уксусной кислоты. Найдите рН этого буферного раствора. Константа диссоциации уксусной кислоты равна Ксн3соон = 1,75×10-5.
Решение:
Буферными называют растворы, одновременно содержащие слабую кислоту и её соль (слабое основание и его соль) и обладающие свойством сохранять практически неизменной концентрацию ионов водорода при разбавлении, добавлении небольших количеств кислот или щелочей. Для любой слабой кислоты НА:
| К дис.кисл.
| =
| [Н+] [А-]
| ;
| [Н+]
| =
| Ккисл [НА]
| .
|
| [НА]
| [А-]
|
При добавлении к раствору слабой кислоты раствора сильного электролита (соли этой кислоты) концентрация аниона А- значительно возрастает за счёт диссоциации соли. Так как сильные электролиты диссоциируют практически полностью, то концентрацию аниона А- можно считать равной концентрации соли: [А-] = [соли]. Концентрацию недиссоциированной части слабой кислоты можно приравнять к общей концентрации кислоты, пренебрегая очень малой долей распавшихся молекул: [НА] = [кисл.]
| Отсюда:
| [Н+]
| =
| Ккисл [кисл]
|
| [соли]
|
Для нашей задачи: 
рН = –lg 1,75×10-4 = 3,76
Ответ: 3,76
Пример 2. Вычисление концентрации ионов Н+ в буферном растворе при его разбавлении.
1 л буферного раствора содержит 0,1 моль хлорида аммония и 0,01 моль гидроксида аммония (КNН4ОН = 1,77×10-5). Найдите концентрацию ионов водорода [Н+] в буферном растворе. Как изменится [Н+] при разбавлении раствора в 100 раз?
Решение:
Рассуждая аналогично примеру 1, получим соотношение для вычисления концентрации гидроксид-ионов [ОН-] в буферном растворе, содержащем слабое основание и его соль:
| [ОН-]
| =
| К осн
| [осн ]
| ;
| [Н+]
| =
| Кн2о [соли]
| .
|
| [соли]
| К осн [осн]
|
Для нашей задачи: 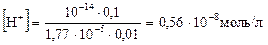
При разбавлении буферного раствора в 100 раз концентрация каждого из компонентов уменьшается в 100 раз:
[NН4СI] = 0,001 моль/л; [NН4ОН] = 0,0001 моль/л.
| Тогда
| [Н+]
| =
| 10-14 × 0,001
| =
| 10-17
| =
| 0,56×10-8 моль/л
|
| 1,77×10-5 × 0,0001
| 1,77×10-9
|
Итак, при разбавлении буферного раствора в 100 раз концентрация ионов Н+ не меняется.
Ответ: [Н+] = 0,56×10-8 моль/л; концентрация [Н+] не меняется.
Пример 3. Вычисление рН буферного раствора при добавлении сильной кислоты.
1 л формиатного буферного раствора содержит по 0,1 моль/л НСООNа и НСООН (К дис = 1,77×10-4). Определите, как изменится рН этого буферного раствора, после добавления к нему 0,01 моль НСI.
Решение:
Найдём концентрацию ионов водорода [Н+] и рН в исходном буферном растворе.
 рН = –lg 1,77×10-4 = 3,75.
рН = –lg 1,77×10-4 = 3,75.
При добавлении к 1 л буферного раствора 0,01 моль НСI произойдет реакция, в результате которой концентрация НСООН увеличится на 0,01 моль, т.е. будет равной 0,1 + 0,01 = 0,11 моль/л, а концентрация НСООNа соответственно уменьшится на 0,01 моль: 0,1 – 0,01 = 0,09 моль/л.
После прибавления к формиатному буферному раствору НСI получим:
 рН = –lg 2,16×10-4 = 3,67.
рН = –lg 2,16×10-4 = 3,67.
Таким образом, при прибавлении сильной кислоты рН раствора уменьшилось на 3,75 – 3,67 = 0,08 единиц.
Ответ: рН уменьшилось на 0,08
Пример 4. Вычисление буферной ёмкости раствора.
1 л формиатного буферного раствора содержит по 1 моль НСООNа и НСООН (К дис = 1,77×10-4). Рассчитайте буферную ёмкость раствора, по отношению к НСI и NаОН (ВHCl; BNaOH).
Решение:
Буферная ёмкость раствора характеризует способность буферного раствора поддерживать постоянное значение рН при добавлении кислоты или щелочи. Буферную ёмкость раствора выражают количеством кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы понизить или повысить рН раствора на единицу. Добавление к буферному раствору кислоты понижает, а добавление щелочи увеличивает рН раствора. Буферная ёмкость раствора тем больше, чем выше концентрация его компонентов.
Для исходного раствора:
 ; рН = –lg 1,77×10-4 = 3,75.
; рН = –lg 1,77×10-4 = 3,75.
При добавлении НСI к буферному раствору протекает реакция:
НСООNа + НСI = НСООН + NаСI
Через хмоль обозначим буферную ёмкость раствора по отношению к соляной кислоте. Тогда при добавлении к 1 л раствора х моль НСI концентрация НСООН увеличится до (1 + х) моль/л, а концентрация НСООNа уменьшится до (1 – х) моль/л.
При добавлении НСI в количестве, равном буферной ёмкости раствора, рН раствора понизится на единицу, т.е. будет равным 2,75. В этом случае
[Н+] = 1,78×10-3 моль/л, [Н+] = 
 ; 1 – х = 0,1 (1 + х); 1 – х = 0,1 + 0,1 х; 0,9 = 1,1 х;
; 1 – х = 0,1 (1 + х); 1 – х = 0,1 + 0,1 х; 0,9 = 1,1 х;
х = 0,818.
Т. о., буферная ёмкость раствора по отношению к НСI равна 0,818 моль/л.
При добавлении NаОН к буферному раствору протекает реакция:
НСООН + NаОН = НСООNа + Н2О
Через у моль обозначим буферную ёмкость раствора по отношению к NаОН. При добавлении у моль гидроксида натрия к 1 л раствора концентрация соли увеличится до (1 + у) моль/л; концентрация кислоты НСООН уменьшится до (1 – у) моль/л. При добавлении NаОН в количестве, равном буферной ёмкости раствора по отношению к NаОН, рН раствора увеличится на единицу и будет равным 4,75;
[Н+] = 1,78×10-5 моль/л. 
0,1 (1 + у) = 1 – у; 0,1 + 0,1 у = 1 – у; 1,1 у = 0,9; у = 0,818.
Буферная ёмкость раствора по отношению к NаОН также равна 0,818 моль/л. Ответ: 0,818; 0,818
Пример 5. К 12 мл 0,15 М раствора формиата калия прибавлено 15 мл 0,03 М раствора муравьиной кислоты (рКНСООН = 3,75). Вычислить рН этого буферного раствора.
Решение:
После смешивания двух растворов концентрация кислоты и её аниона равны:
в 1000 мл раствора содержится – 0,03 моль НСООН
в 15 мл – х моль х = 4,5×10-4 моль
Общий объем смеси равен 27 мл, концентрация НСООН составит:
4,5×10-4 моля кислоты содержится – в 27 мл раствора
у моля – в 1000 мл у = 0,017 моль/л
Найдём концентрацию соли:
в 1000 мл раствора содержится – 0,15 моль НСООК
в 12 мл – z моль z = 1,8×10-3 моль
1,8×10-3 моль НСООК содержится – в 27 мл раствора
q моль – в 1000 мл q = 0,066 моль/л
Найдём рН буферного раствора:
рН = рКНА – Ig 
Ответ: 4,35
Задачи для самостоятельного решения
211 - 220. Буферный раствор объёмом V (л) содержат определённое количество моль уксусной кислоты СН3СООН (К дис = 1,75×10-5) и моль ацетата натрия СН3СООNа. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI и гидроксиду натрия NаОН (ВHCl; BNaOH).
| № задачи
| V (л)
| СН3СООNа (моль)
| СН3СООН (моль)
| № задачи
| V (л)
| СН3СООNа (моль)
| СН3СООН (моль)
|
|
|
| 0,1
| 0,15
|
|
| 0,15
| 0,32
|
|
|
| 0,03
| 0,15
|
|
| 0,43
| 0,38
|
|
|
| 0,06
| 0,25
|
|
| 0.07
| 0,08
|
|
|
| 0,5
| 0,45
|
|
| 0,18
| 0,22
|
|
|
| 0,08
| 0,65
|
|
| 0,27
| 0,33
|
221 - 230. В 1200 мл воды растворили определённую массу муравьиной кислоты НСООН (К дис = 1,77×10-4) и формиата натрия HCOONa. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора и растворов, полученных при добавлении n1 моль соляной кислоты НСI и n2 моль гидроксида натрия NaOH.
| № задачи
| НСООН
(г)
| HCOONa
(г)
| НСI
n1 (моль)
| NaOH
n2 (моль)
| № задачи
| НСООН
(г)
| HCOONa
(г)
| НСI
n1 (моль)
| NaOH
n2 (моль)
|
|
|
|
| 0,1
| 0,05
|
|
|
| 0,21
| 0,15
|
|
|
|
| 0,13
| 0,06
|
|
|
| 0,22
| 0,19
|
|
|
|
| 0,15
| 0,07
|
|
|
| 0,32
| 0,25
|
|
|
|
| 0,17
| 0,08
|
|
|
| 0,35
| 0,29
|
|
|
|
| 0,19
| 0,09
|
|
|
| 0,41
| 0,34
|
231 - 240. Буферный раствор получен при смешении раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и раствора хлорида аммония NН4СI определённого объёма V и концентрации См. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI и гидроксиду натрия NаОН (ВHCl; BNaOH).
| № задачи
| NН4ОН
| NН4СI
| № задачи
| NН4ОН
| NН4СI
|
| V (л)
| См (моль/л)
| V (л)
| См (моль/л)
| V (л)
| См (моль/л)
| V (л)
| См (моль/л)
|
|
| 1,5
| 1,5
| 0,8
| 0,8
|
| 3,1
| 2,0
| 4,2
| 1,6
|
|
| 2,5
| 1,5
| 1,5
| 1,0
|
| 2,7
| 2,2
| 2,5
| 2,3
|
|
| 2,3
| 2,0
| 1,2
| 1,5
|
| 3,5
| 3,2
| 3,3
| 2,8
|
|
| 1,2
| 1,2
| 0,9
| 0,7
|
| 4,7
| 1,7
| 5,2
| 1,6
|
|
| 1,8
| 1,5
| 1,1
| 1,2
|
| 3,9
| 2,6
| 4,8
| 2,5
|



 .
. =
=  =
= 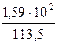 = 1,4.
= 1,4. = i
= i  ,
, =
=  =
=  =
=  =1,75.
=1,75.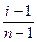 ,
, = 1,48/2 = 0,74 (или 74%).
= 1,48/2 = 0,74 (или 74%). =
=  H/м2 = 4,31·105 Па.
H/м2 = 4,31·105 Па. =
=  = 1,9.
= 1,9. =
=  =
=  = 0,9 (или 90%).
= 0,9 (или 90%).
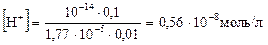
 рН = –lg 1,77×10-4 = 3,75.
рН = –lg 1,77×10-4 = 3,75. рН = –lg 2,16×10-4 = 3,67.
рН = –lg 2,16×10-4 = 3,67. ; рН = –lg 1,77×10-4 = 3,75.
; рН = –lg 1,77×10-4 = 3,75.
 ; 1 – х = 0,1 (1 + х); 1 – х = 0,1 + 0,1 х; 0,9 = 1,1 х;
; 1 – х = 0,1 (1 + х); 1 – х = 0,1 + 0,1 х; 0,9 = 1,1 х;




