Занятие №1
Тема: Электронная структура атомов. Свойства химических элементов и их электронная структура.
Значение темы: Данная тема лежит в основе изучения строения веществ и их свойств. Зная электронное строение атомов можно прогнозировать свойства элементов, характер изменения свойств химических элементов в группах и подгруппах периодической системы Д.И. Менделеева.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: правила составления электронных конфигураций элементов. Принцип минимальной энергии, правила В. Клечковского и Гунда, запрет Паули, квантовые числа.
Уметь: составлять электронные формулы элементов. Решать упражнения и задачи на обобщение, систематизацию и закрепление знаний.
План изучения темы:
- Организационная часть — 15 мин.
- Разбор тематического материала — 60 мин.
- Ознакомление с техникой безопасности — 30 мин.
- Выполнение упражнений и ситуационных задач — 60 мин.
- Итоговый контроль знаний — 10 мин.
- Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
1. Строение атома
2. Изотопы
3. Электронная структура атомов
4. Электронные и графические формулы элементов
5. Принцип минимальной энергии
6. Правила В. Клечковского и Гунда
7. Запрет Паули
8. Квантовые числа
Контрольные задания:
1. Укажите для атомов: цинка, фосфора, неона, осмия общее число нуклонов, число протонов и нейтронов в ядре, общее число электронов в атоме.
2. Определите среднюю относительную атомную массу магния, если массовые доли его изотопов 2412Mg, 2512Mg, 2612Mgв земной коре 78,60; 10,11; 11,29 %.
3. Назовите элементы первой группы, в предпоследнем слое атомов которых содержится 8 электронов, 18 электронов.
4. Напишите электронную формулу атома технеция. Сколько электронов находится на d-подуровне предпоследнего электронного слоя? К какому электронному семейству относится элемент?
5. Сколько неспаренных электронов содержится в основном состоянии в электронных оболочках в атомах серы, хлора, углерода, кальция, кобальта?
6. Напишите электронные формулы для атомов и ионов: Fe, Fe2+, Fe3+, Cl, Cl-, Cl+1,Cl+3, Cl+5, Cl+7, O-1, S+6, Mn, Mn+7, Cu, Cr.
7. Составьте электронную форму атома элемента, расположенного в 6 группе 3 периода, 4 группе 4 периода, 7 группе 5 периода.
8. Сколько неспаренных электронов содержат невозбужденные атомы: a) B; б) S; в) As; г) Cr; д) Hg; е) Eu?
9. Электронная структура атома описывается формулой 1s22s22p63s23p63d64s2. Какой это элемент?
Домашнее задание:
Решение задания в тетрадях: запишите электронные формулы атомов элементов с зарядом ядра: а) 8; б) 13; в) 18; г) 23; д) 53; е) 63; ж) 83. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
Занятие №2
Тема: Природа химических связей, строение молекул.
Значение темы: Данная тема является фундаментальной темой общей химии, знание которой позволяет студентам не только понять суть химических явлений, но и сформировать диалектико-материалистическое мышление и способность к познанию общих законов окружающего мира, законов природы и общественного развития.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: Тему «Природа химических связей, строение молекул»
Уметь: составлять электронные формулы элементов. Характеризовать состояние электрона с помощью квантовых чисел. Характеризовать s-, p-, d-элементы и объяснить изменение их свойств в соответствии с электронной структурой и периодическим законом. Определять тип химической связи; валентность элементов; степень окисления элементов. Изображать пространственное строение молекул. Решать упражнения на определение по формулам веществ типа химической связи, степени окисления атомов и валентности. Решать упражнения и задачи на обобщение, систематизацию и закрепление знаний.
План изучения темы:
- Организационная часть — 20 мин.
- Заслушивание докладов и рефератов – 95 мин.
- Контрольная работа – 60 мин.
4. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
Строение атома. Изотопы. Электронная структура атомов
1. Электронные и графические формулы элементов
2. Характеристика состоянияэлектрона с помощью квантовых чисел.
3. Принадлежность химических элементов к s-, p-, d-семействам и их характеристика.
4. Токсичность солей тяжелых металлов. Хелатотерапия.
5. Внутрикомплексные соединения и их роль в биологических процессах.
6. Периодическая система Д.И. Менделеева.
7. Взаимосвязь электронного строения элементов, положение в периодической системе и химических свойств.
8. Образование сложных частиц.
9. Природа химической связи, ее виды: ковалентная, ионная, металлическая, водородная, сигма-связь, кратные связи.
10. Гибридизация атомных орбиталей. Пространственная конфигурация молекул.
11. Полярность молекул.
Контрольные задания:
1. Указать тип химической связи в молекулах H2, Cl2, HCl, Li2O, HBr, KBr, Br2O, Br2. Привести схему перекрывания электронных облаков.
2. Какой характер имеют связи в молекулах NCl3, CS2, ICl5, NF3, OF2, ClF, CO2? Указать для каждой из них направление смещения общей электронной пары.
3. Составить валентную схему молекулы хлороформа CHCl3 и указать: а) какая связь наиболее полярна; б) в каком направлении смещено электронное облако этой связи.
Домашнее задание:
Подготовка к проверочной работе по вопросам самоконтроля.
Занятие №3
Тема: Элементы химической термодинамики.
Значение темы: Изучение данной темы способствует выработке единой линии, позволяющей устранить разрыв между отдельными сторонами физических, химических и биологических процессов; позволяет сформировать четкое понимание причин возможности протекания того или иного химического процесса самопроизвольно.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: общие понятия термодинамики: внутренняя энергия, теплота, работа, энтальпия, энтропия, энергия Гиббса. Первый и второй закон термодинамики.
Уметь: охарактеризовать общие понятия термодинамики; формулировать и применять начала термодинамики к различным химическим процессам, протекающим в организме; проводить термохимические и термодинамические расчеты. Решать упражнения на обобщение, систематизацию и закрепление знаний.
План изучения темы:
- Организационная часть — 10 мин.
- Разбор тематического материала – 60 мин.
- Решение упражнений и ситуационных задач – 70 мин.
- Итоговый контроль – 35 мин.
5. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
1. Внутренняя энергия, теплота, работа.
2. Первый закон термодинамики.
3. Энтальпия
4. Энтропия и ее изменение при химической реакции
5. Энергия Гиббса
6. Второй закон термодинамики
7. Применение законов термодинамики к живым системам.
Контрольные задачи
1. Будет ли уравнение термохимическим? С(т) + ½ О2(г) =СО2(г). ∆Н°298 = -221 кДж/моль. Назовите данный тепловой эффект.
2. Какая система называется открытой? Приведите примеры открытой системы.
3. Какой параметр системы является функцией состояния? Назовите величины, являющиеся функциями состояния.
4. Какие из предложенных параметров состояния относятся к экстенсивным: масса, температура, давление, энтропия, энергия?
5. Напишите математическое выражение 1 начала термодинамики для изобарных процессов.
6. Чему равна теплота изохорного и изобарного процесса?
7. Что является критерием самопроизвольно протекающих необратимых процессов в изолированных системах?
8. Как можно определить абсолютное значение энтропии вещества? Запишите уравнение Л.Больцмана для расчета энтропии.
9. Если известны ∆Н°298и ∆S°298. Как можно рассчитать ∆G°298реакции? При каких значениях ∆G реакция идет в прямом направлении?
10. При каких значениях ∆Gи ∆S изменение энергии Гиббса будет меньше нуля?
11. Дайте определение второго начала термодинамики в соответствии с Р. Клаузисом.
12. Запишите уравнение 2-го начала термодинамики для живых организмов.
Домашнее задание:
1. Решение задачи: на испарение 1 моля воды требуется 40 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 720 г воды?
2. Подготовка по вопросам самоконтроля.
Занятие №4
Тема: Способы выражения количественного состава растворов.
Значение темы: данная тема очень важна для будущих лаборантов, так как каждый из них обязан прежде всего уметь обращаться с растворами, готовить растворы заданной концентрации и делать для этого необходимые расчеты.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: способы выражения количественного состава растворов: массовую долю растворенного вещества, молярную концентрацию и молярную концентрацию эквивалента.
Уметь: решать задачи на приготовление растворов: по заданной концентрации; методом разбавления концентрированных растворов водой и методом смешивания растворов с различной массовой долей одного и того же растворенного вещества.
План изучения темы:
- Организационная часть — 10 мин.
- Разбор тематического материала – 60 мин.
- Решение упражнений и ситуационных задач – 70 мин.
- Итоговый контроль –35 мин.
5. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
1. Массовая доля растворенного вещества. Молярная доля. Объемная доля.
2. Молярная концентрация.
3. Закон эквивалентов. Эквивалент вещества. Молярная концентрация эквивалента.
4. Моляльная концентрация.
5. Титр.
6. Расчеты, проводимые при приготовлении растворов позаданнойконцентрации.
7. Расчеты, проводимые при разбавлении концентрированных растворов и смешивании растворов с различной массовой долей растворенного вещества.
Контрольные задачи:
1. Заполните таблицу перехода от одного способа выражения концентрации вещества к другому. Используйте полученные формулы для решения задач.
| Вычислить
Дано
| m(x)
| C(x)
| C(1/z x)
| w%
| t(x)
| b(x)
|
| w%
|
| w%p10/M(x)
|
|
|
|
|
| C(x)
|
|
|
|
|
|
|
| C(1/z x)
|
|
|
|
|
|
|
| t(x)
|
|
|
|
|
|
|
| b(x)
|
|
|
|
|
|
|
Пример решения: C( x)= n( x)/ V, моль/л, n( x) = m( x) / M( x), моль. Тогда C( x) = m( x) / M( x) • V, моль/л. Объем переводят в мл: С( x) = m( x) 1000/ M( x) V, моль/л и выражают массу m( x)= C( x) M( x) V/1000г; W% = m( x)100%/ m(р-ра), m(р-ра)=р V, тогда m( x)= w% pV/100%. Поскольку масса растворенного вещества при разных способах выражения концентрации одна и та же – m( x): C( x) M( x) V/1000= w% pV/100%, С( x) = w% p 10/ M( x) моль/л.Выведенное выражение заносят в таблицу.
2. Вычислите массовую долю и молярную концентрацию раствора карбоната калия, содержащего 75 г соли в 500 г воды.
3. К 180 г 8-%-ного раствора хлорида натрия добавили 20 г NaCl. Массовая доля хлорида натрия в образовавшемся растворе равна __ % (ответ:17,2%)
4. К 200г 15-%-ного раствора хлорида натрия добавили 40 г воды. Определите массовую долю соли в полученном растворе (ответ: 12,5%).
5. Определите массовую долю сульфата натрия в растворе, полученном сливанием 120г 10%-ного раствора Na2SO4 и 200г 4%-ного раствора того же вещества (ответ: 6,25%).
Домашнее задание:
1. Решение задачи: К 25 мл раствора серной кислоты с массовой долей 96%(р=1,84 г/мл) прибавили 100 г воды. Рассчитайте массовую долю нового раствора и его молярную концентрацию.
2. Подготовка по вопросам самоконтроля.
Занятие № 5
Тема: Дисперсные системы. Коллоидные растворы.
Значение темы: данная тема очень важна для будущих лаборантов, потому что биологическая жидкость – кровь, лимфа, моча, слюна являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. Изучение свойств растворов показывает, что их поведение подчиняется ряду законов, которые необходимо учитывать в медицинской практике.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: общие свойства дисперсных систем и их классификацию; природу и общие свойства коллоидных систем, методы их получения и очистки; строение мицелл; виды коллоидных растворов, причины их устойчивости и факторы, вызывающие ее нарушение; явление коллоидной защиты; основные свойства аэрозолей, суспензий, эмульсий.
Уметь: решать упражнения на обобщение, систематизацию и закрепление знаний.
План изучения темы:
- Организационная часть — 10 мин.
- Разбор тематического материала – 60 мин.
- Решение упражнений и ситуационных задач – 70 мин.
- Итоговый контроль – 35 мин.
5. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
1. Дисперсные системы и их классификация.
2. Общая характеристика аэрозолей, суспензий и эмульсий.
3. Методы получения и очистки коллоидных растворов.
4. Оптические свойства дисперсных систем.
5. Электрические свойства дисперсных систем.
6. Строение мицелл.
7. Электрофорез.
8. Электроосмос.
9. Устойчивость и коагуляция коллоидных систем.
Контрольные задачи:
1. Заполните таблицу:
| № п/п
| Размер частицы
| Название раствора
| Пример
|
|
|
|
|
|
2. Напишите строение мицеллы сульфида меди, йодида серебра и карбоната кальция, если при электрофорезе они движутся к катоду. Определите заряд гранулы.
3. Напишите строение мицеллы сульфида меди, йодида серебра и карбоната кальция, если при электрофорезе они движутся к аноду. Определите заряд гранулы.
Домашнее задание:
1. Решение задачи: расположите в ряд электролиты, по увеличению порога коагуляции: фосфат натрия, йодид цезия, сульфат натрия, хлорид натрия.
2. Подготовка по вопросам самоконтроля.
Занятие № 6.
Тема: Теория электролитической диссоциации. Протолитическая теория кислот и оснований.
Значение темы: биологические жидкости и ткани содержат много различных электролитов. Устойчивость биологических ВМС и скорость многих биохимических реакций, обмен веществ, поддержание осмотического и онкотического давлений в значительной мере зависят от природы и концентрации, присутствующих в жидкостях и тканях ионов. Поведение ионов в сложных биологических системах описывает теория электролитической диссоциации, поэтому знания, полученные студентами при изучении этой темы пригодятся им в будущей профессии.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: основные свойства кислот, оснований, солей в свете теории электролитической диссоциации; взаимосвязь кислот, оснований, солей. Буферные растворы.
Уметь: писать уравнения реакций в молекулярном и ионном виде; выполнять задания на осуществление превращений веществ; определять последовательность действий при решении экспериментальных задач. Приготовит буферные растворы и проводить с ними реакции.
План изучения темы:
- Организационная часть — 10 мин.
- Лабораторная работа – 120 мин.
- Защита лабораторной работы – 45 мин.
4. Подведение итогов занятия. Домашнее задание — 5 мин.
Контрольные задания:
1. Как называются и чем различаются между собой следующие частицы: а) Cl–, Cl, Cl2; б) SO 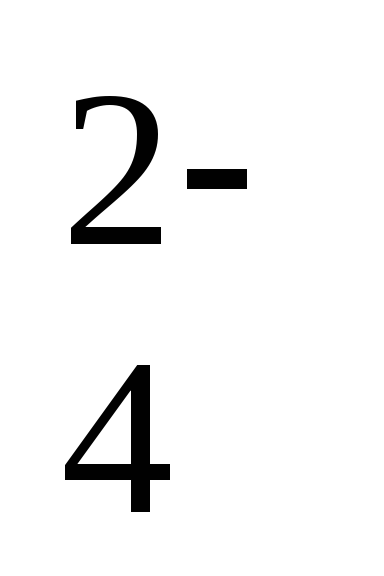 ,SO3; в) Na, Na+?
,SO3; в) Na, Na+?
2. Напишите формулы электролитов, в водных растворах которых содержатся ионы:
а)Al3+ и SO 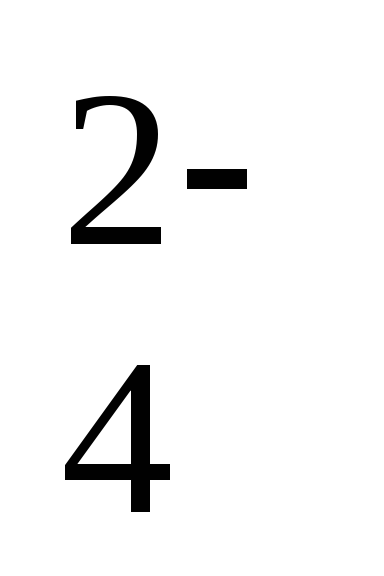 ; б) К+ и Сr2О
; б) К+ и Сr2О  ; в) Ва2+ и ОН-; г) Са2+ и NO
; в) Ва2+ и ОН-; г) Са2+ и NO  ;д) Cr3+ и NO
;д) Cr3+ и NO 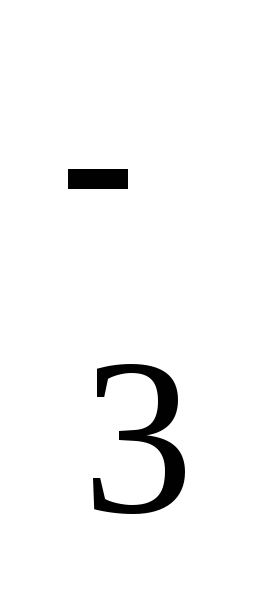 ; е) Mn2+ и Br-; ж) Na+ и НСО
; е) Mn2+ и Br-; ж) Na+ и НСО 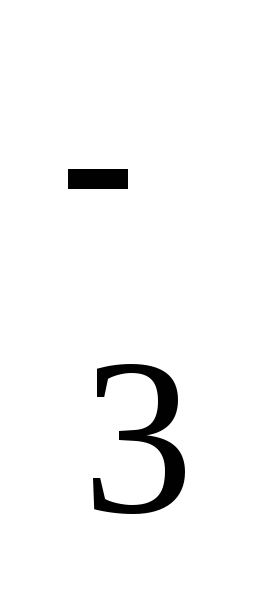 ; з) К+ и СО
; з) К+ и СО  ;и) Na+ и СlО
;и) Na+ и СlО  ; к) Са2+ и НСО
; к) Са2+ и НСО  .
.
3. Составьте уравнения диссоциации следующих электролитов: Ва(ОН)2; Мg(ОН)2, Al(ОН)3; HNO3; H2CO3; H2SO4; KHCO3.
4. Составьте уравнения диссоциации следующих электролитов: (CuOH)2SO4; Al(OH)Cl2; K2HPO4; Na2S; Mg(HCO3)2; H2SO3; Fe(OH)2. Какие из этих электролитов образуют в растворе гидроксид-ионы?
5. Какие из следующих электролитов образуют в растворе одновременно ионы водорода и гидроксид-ионы: KOH; Sr(OH)2; H2O; Pb(OH)2; Cа(HCO3)2; Sn(OH)2; Cr(OH)3; Al(OH)3? Напишите уравнения электролитической диссоциации этих веществ.
Пробирка
| №1
| №2
| №3
|
| Объем раствора кислоты, мл
| 9
| 5
| 1
|
| Объем раствора соли, мл
| 1
| 5
| 9
|
| Соотношение кислота: соль
| 9:1
| 1:1
| 1:9
|
| Значение рН, найденное в опыте
|
|
|
|
| Значение рН вычисленное
|
|
|
|
Прибавляют к каждому раствору по 3 капли раствора универсального индикатора. Сравнивают окраску растворов с окраской цветной шкалы. Записывают значение рН для каждого раствора. Рассчитывают теоритическое значение рН и записывают в таблицу. Сравнивают измеренные значения рН растворов с расчетными. Растворы сохраняют для проведения следующих опытов.
Содержимое
| |
Исходное
|
После прибавления
|
| 0,01 моль/л НС l
| 0,1 моль/л HCl
| 0,01 моль/л NaOH
| 0,1 моль/л NaOH
|
| 1
| Буфер
|
|
|
|
|
|
| 2
| Вода
|
|
|
|
|
|
| 3
| Р-р NaCl
|
|
|
|
|
|
Анализируемый раствор
Результаты анализа
| | V р-ра , мл
| рН1(до титрования)
| V кислоты , мл
| рН2(после титрования)
| В, моль/л
|
| Раствор №2
|
|
|
|
|
|
| Раствор № 3
|
|
|
|
|
|
Для каждого определения рассчитывают значение буферной емкости анализируемых растворов. Сравнивают полученные результаты, формулируют выводы.
Вопросы к защите работы:
1. Приведите примеры солей с рН больше или меньше 7 при равных концентрациях кислоты и сопряженного основания.
2. Как изменится буферная емкость при разведении буфера? Изменяется ли рН при разведении буферного раствора?
Домашнее задание:
1. Подготовка к защите лабораторной работы (вопросы 1,2).
Занятие № 7
Тема: Буферные растворы. Гидролиз солей.
Значение темы: гидролиз в биохимических процессах представлен: ферментативным гидролизом пищи в ЖКТ и энергетическим гидролизом АТФ и других макроэргических соединений. Знание данных процессов необходимо для будущих специалистов.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: сущность процесса гидролиза различных типов солей; понятие степень гидролиза; влияние различных факторов на степень гидролиза; роль гидролиза в процессах жизнедеятельности.
Уметь: писать уравнения реакции гидролиза в молекулярном и ионном виде; применять методы усиления и подавления гидролиза на практике.
План изучения темы:
- Организационная часть — 10 мин.
- Разбор тематического материала – 80 мин.
- Лабораторная работа – 60 мин.
- Защита лабораторной работы – 25 мин.
5. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы, обсуждаемые на семинаре:
1. Сущность процесса гидролиза.
2. Гидролиз различных типов солей.
3. Степень гидролиза.
4. Зависимость степени гидролиза от природы соли, ее концентрации и температуры.
5. Изменение степени гидролиза.
6. Составление уравнений гидролиза различных типов солей в ионном и молекулярном виде.
Контрольные задания:
1. Для гидролизующихся солей напишите уравнения реакций гидролиза в молекулярной и ионной формах: K3PO4, BaCO3, Na2S, KNO3, CuSO4, CaCl2? Укажите рН растворов.
2. В растворе какого вещества концентрация ионов Н+ наибольшая: MgCl2, KNO3, Na2SO3, КНСО3? Ответ обоснуйте с помощью уравнений реакций.
3. Водные растворы каких из нижеперечисленных веществ будут вызывать изменение окраски индикатора: NaCl, NaCN, KH2PO4, FeCl3, KClO4, NH4Cl, Ba(NO3)2, FeSO4. Напишите ионные и молекулярные уравнения процессов, протекающих при взаимодействии указанных солей с водой.
4. К водному раствору, содержащему 3,17 г хлорида хрома(III) прилили раствор, содержащий 3,85 г сульфида калия. Какое вещество образуется? Какова его масса? (Ответ: 2,06 г).
Занятие № 8
Тема:Окислительно-восстановительные процессы.
Значение темы: ОВР – основа всех биологических и физиологических процессов, происходящих в организме человека, изучаемых на курсах биохимии, гистологии, патологии и других специальных медицинских курсах.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: Сущность ОВР; классификацию ОВР;важнейшие окислители и восстановители; биологическое значение окислительно-восстановительных процессов; применение ОВР в клиническом, биохимическом, санитарно-гигиеническом анализе.
Уметь: уравнивать ОВР методом электронного баланса и методом полуреакции. Решать упражнения на обобщение, систематизацию и закрепление знаний.
План изучения темы:
- Организационная часть — 10 мин.
- Разбор тематического материала – 70 мин.
- Решение упражнений и ситуационных задач – 60 мин.
- Итоговый контроль – 35 мин.
5. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
1. Степень окисления.
2. Сущность окислительно-восстановительных реакций.
3. Типы окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, диспропорционирования.
4. Составление уравнений ОВР методом электронного баланса.
5. Составление уравнений ОВР реакций ионно-электронным методом.
Вопросы для самостоятельного изучения студентами:
1. Биологически важные редокс-системы.
Контрольные задачи:
1. Определите степень окисления всех элементов в следующих соединениях: H2SO3, KIO3, NH4Cl, K2Cr2O7, MnO2, CuI, KMnO4, KNO2.
2. Укажите, в каких случаях в приведенных примерах происходит:
А) окисление HNO2→HNO3; PbO2→PbSO4; HclO4→ClO2
Б) восстановление KMnO4→MnO2; SO2→K2SO4; NaBrO3→Br2
3. В следующих ОВР укажите окислитель и восстановитель, напишите электронные уравнения:
H2+Cl2=2HCl; H2+2Na=2NaH; O2+2Na=Na2O2; Cl2+2Na=2NaCl
3. В следующих уравнениях реакций определите окислитель и восстановитель, их степени окисления, расставьте коэффициенты:
a) MnO2+KclO2+KOH→K2MnO4+KCl+H2O
b) CuCl2 + SO2+H2O→CuCl+HCl+H2SO4
c) HgS+HNO3+HCl→HgCl2+S+NO+H2O
d) SnCl2+K2Cr2O7+H2SO4→Sn(SO4)+SnCl4+Cr2(SO4)3+K2SO4+H20
e) AsH3+AgNO3+H2O→H3AsO4+Ag+HNO3
f) Zn+KNO3+KOH→K2ZnO2+NH3+H2O
4. В следующих уравнениях реакций, в которых окислитель и восстановитель находятся в одном и том же веществе (реакции внутримолекулярного окисления-восстановления), расставьте коэффициенты:
Hg(NO3)2→Hg+NO2+O2; NH4NO3→N2O+H2O; KСlO3→KCl+O2; Ag2O→Ag+O2
Домашнее задание:
Решение упражнения: для реакций диспропорционирования напишите электронные схемы и расставьте коэффициенты:
K2SO3→K2SO4+K2S; K2MnO4+H2O→KМnO4+MnO2+KOH; HСlO3→ClO2+HСlO4
HNO2→HNO3+NO+H2O
Чем эти реакции отличаются от реакций межмолекулярного и внутримолекулярного окисления – восстановления?
Занятие № 9
Тема: Основы строения органических соединений. Пространственное строение органических соединений.
Значение темы: в настоящее время известно около 10 млн. органических соединений. Такое громадное количество их предопределяет необходимость строгой классификации и единых международных номенклатур правил. Этому вопросу в медицине уделяется также большое внимание, так как в соответствии с общими правилами номенклатуры строятся названия многочисленных лекарственных средств, с которыми медики встречаются в своей профессиональной деятельности
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: основные положения теории строения органических соединений; классификацию органических соединений; систематическую номенклатуру ИЮПАК и заместительную номенклатуру; природу химической связи в органических соединениях; сущность взаимного влияния атомов в молекуле; понятия: гомология, изомерия, родоначальная структура, заместитель, электронодонор, электроноакцептор, индуктивный эффект.
Уметь: называть соединения, относящиеся к различным классам органических веществ по систематической номенклатуре ИЮПАК и заместительной номенклатуре; и писать формулы веществ по названию. Определить вид и полярность химической связи, в органических соединениях, виды индуктивных эффектов различных функциональных групп.
План изучения темы:
- Организационная часть — 10 мин.
- Разбор тематического материала – 70 мин.
- Решение упражнений и ситуационных задач – 60 мин.
- Итоговый контроль – 35 мин.
5. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
1. Основные положения теории строения органических соединений.
2. Классификация органических соединений, основанная на особенностях строения углеродного скелета и наличия функциональных групп.
3. Основы систематической номенклатуры углеводородов ИЮПАК; родоначальная структура, заместитель.
4. Структурная изомерия. Номенклатура простейших алкильных радикалов.
5. Номенклатура основных классов органических соединений. Старшинство функциональных групп. Поли и гетерофункциональность.
6. Электронное строение и типы гибридизации атома углерода в органических соединениях.
7. Типы химических связей в органических соединениях: ковалентная, π, σ, донорно-акцепторная.
8. Сущность взаимного влияния атомов в молекуле; электронодонор, электроноакцептор, индуктивный эффект.
Вопросы для самостоятельного изучения студентами:
1. Современное состояние теории строения органических соединений.
Контрольные задачи:
1. Приведите строение и назовите функциональные группы, в состав которых входят гетероатомы. Приведите названия класса соединений и приведите общую формулу.
2. Напишите структурные формулы и назовите по систематической или заместительной номенклатуре: (CH3)2CH-CH2-CH3, (CH3)2CH(C2H5)-CH2-CH3, (CH3)2CH-CH2-CH3, Br-CH2-CH3, CH3-CH2-OH, CH3-CH2-O-CH2-CH3, CH3-C(O)-O-C3H7, HO-CH2-CH2-OH, HO-CH2-CH2(OH)-CH2-OH, C6H6(OH)6, C6H5-NO2, C6H4OHCH3, C6H4(OH)2, HOC6H4COOH, Cl3CCHO, CH3-CH2CHO, CH3-SH.
3. Приведите строение соединений, имеющих следующие названия:бензосульфокислота, пропанон-ацетон, бутанол-2, 4-метилфенол-пара-крезол, 2-амино-4-фенилпропановая кислота – фенилаланин, этиламин, бензол, метилбензол-толуол, изопропиловый спирт.
4. Приведите по 2 структурные формулы поли- и гетерофункциональных соединений состава С6Н8О4.
5. Приведите структурные формулы трех соединений состава С4Н8О2, относящиеся к различным классам органических соединений.
6. Выберите самую полярную связь в молекулах: этанола, этандиол, этиламина.
7. Сравните величины частичных положительных зарядов на атоме С-2 1-хлорпропана и 1-йодбутана.
8. Какая связь и почему является неполярной в молекуле транс-1,4-дихлорбутена-2.
Домашнее задание:
Выполнить упражнения:
1. Приведите по 3 структурные формулы ациклических и карбоциклических соединений, имеющих состав С5Н8 и С5Н10О.
2. Напишите схему реакции метиламина и бромводорода. Определите виды связей в получившемся соединении.
Занятие № 10
Тема: Алифатические углеводороды. Циклические углеводороды.
Значение темы: углеводороды служат фундаментом органической химии.«Органическая химия-это химия углеводородов и их производных» - так более 100 лет назад определил предмет органической химии выдающийся немецкий химик К.Шорлеммер (1834-1892).
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: классификацию, номенклатуру, изомерию, гомологические ряды, физические и химические свойства алифатических углеводородов; понятия: конформация, нуклеофильная частица, электрофильная частица.
Уметь: писать формулы гомологов и изомеров алифатических углеводородов, называть их по систематической номенклатуре, писать уравнения реакций, давать сравнительную характеристику химических свойств алифатических углеводородов; прогнозировать химические свойства алифатических углеводородов на основе строения молекулы.
План изучения темы:
- Организационная часть — 10 мин.
- Разбор тематического материала – 70 мин.
- Решение упражнений и ситуационных задач – 60 мин.
- Итоговый контроль – 35 мин.
5. Подведение итогов занятия. Домашнее задание — 5 мин.
Вопросы для самоконтроля:
1. Алифатические углеводороды: алканы, алкены, алкодиены, алкины. Определение, общая формула, номенклатура, гомологический ряд, последовательное изменение свойств гомологов, виды изомерии: структурная, пространственная, положения кратной связи.
2. Графические способы изображения молекул: стереохимические и проекционные формулы Ньюмена, заслоненные и заторможенные конформации.
3. Классификация органических реакций.
4. Способы получения алканов, алкенов, алкадиенов, алкинов.
5. Химические свойства алифатических углеводородов.
6. Механизм реакций электрофильного присоединения.
7. Качественные реакции на обнаружение алифатических углеводородов
Вопросы для самостоятельного изучения студентами:
1. Механизм реакций радикального замещения.
Контрольные задачи:
1. Назовитеследующиесоединения: (CH3)2CH-CH3, (CH3)2C(C2H5)-CH2-CH3, (CH3)2CH-CH2-CH3, CH3-CH=CH-CH3, CH3-CH=CH-CH(CH3)-CH2-CH3, CH=CH, CH2=CH-CH=CH2, CH2=CH-CH=CH-CH3, CH2=CH-C=CH.
2. Напишите структурные формулы 3-этилпентана; 2,2-диэтилпентана; 2,5-диметил-3-изопропилгексана; 2,4-диэтилоктена-1; 2-изопропилпентена-1; 4,4-диметилпентина-2.
3. Напишите структурные формулы цис-пентена-2 и транс-пентена-2.
4. Напишите структурные формулы гексадиена-1,4 и гексадиена-2,4. В какой из молекул присутствует эффект сопряжения?
5. Какой углеводород получится при каталитическом гидрировании пропилена? Напишите схему реакции.
6. Какой углеводород получится по реакции Вюрца, если в качестве исходного соединения взять 1-йодпропан? Напишите схему реакции.
7. Напишите схему реакции бромирования метана. Определите и напишите механизм реакции.
8. Какой продукт будет получаться преимущественно при нитровании 2-метилбутана? Напишите схему реакции укажите условия.
9. Напишите схему реакции взаимодействия бутена-1 с хлороводородом. Почему получается только один продукт реакции?
10. Напишите схему реакции окисления пропена перманганатом калия в кислой и щелочной среде.
11. Напишите схему реакции полимеризации 2-метилпропена.
12. Какие продукты получаются при взаимодействии пентадиена-1,3 с бромоводородом? Назовите их.
13. Напишите схемы реакции получения пропина из дибромалканов.
14. Напишите схемы последовательного взаимодействие бутина-2 с хлором и с водородом. Назовите промежуточный и конечный продукты.
15. Напишите схему реакции гидратации бутина-1.
Домашнее задание:
Выполнить упражнения:
- Напишите для гексана структурный изомер с четвертичным атомом углерода и структурный изомер с двумя третичными атомами углерода.
2. Напишите схему реакции дегидратации бутанола-2. Объясните действие правила Зайцева. Назовите полученный алкен.
Занятие № 11
Тема: Спирты. Фенолы. Альдегиды. Кетоны.
Значение темы: углеводороды, относящиеся к классам альдегидов, кетонов, спиртов и фенолов человек контактирует ежедневно, поэтому необходимо знать их свойства, и возможности последствий при непосредственном контакте с данными веществами. Многие вещества этих классов нашли применение в медицине как растворители лекарственных препаратов и дезинфицирующие средства, поэтому будущим специалистам необходимо обладать знаниями об их химических и физических свойствах.
Цель занятия:
Для формирования общих и профессиональных компетенций (ОК 1-14; ПК 3.1, 3.2) студент должен:
Знать: классификацию, номенклатуру, изомерию, физические и основные химические свойства спиртов, фенолов, альдегидов и кетонов, действие на организм человека данных веществ, качественные реакции на глицерин и фенолы, альдегиды и кетоны.
Уметь: писать формулы гомологов и изомеров спиртов и фенолов, альдегидов и кетонов, называть их по систематической номенклатуре, давать сравнительную характеристику одно- и многоатомных спиртов и фенолов, характеризовать свойства и писать уравнения реакции с участием спиртов и фенолов, объяснять зависимость химических свойств от строения молекулы и взаимного влияния атомов.
План изу



 ,SO3; в) Na, Na+?
,SO3; в) Na, Na+? ; в) Ва2+ и ОН-; г) Са2+ и NO
; в) Ва2+ и ОН-; г) Са2+ и NO  ;д) Cr3+ и NO
;д) Cr3+ и NO  ; е) Mn2+ и Br-; ж) Na+ и НСО
; е) Mn2+ и Br-; ж) Na+ и НСО  ;и) Na+ и СlО
;и) Na+ и СlО  ; к) Са2+ и НСО
; к) Са2+ и НСО 


