Метиловый спирт (метанол) - сильный яд, к которому особенно чувствительна центральная нервная система. Прием даже небольшого количества метанола (30-50 мл) может привести к слепоте, парезам и параличам. Более высокие дозы смертельны для человека. Одним из способов лечения отравления метанолом считают введение (внутрь или внутривенно) большого количества этанола, что позволяет насытить все активные центры алкогольдегидрогеназы и, таким образом, затормозить метаболизм метанола. В результате этанол является конкурентным ингибитором алкогольдегидрогеназы по отношению к метанолу. Хотя взятые по отдельности оба вещества - субстраты одного фермента.
При неконкурентном ингибировании вещество, тормозящее скорость ферментативной реакции, не обладает структурным сходством с субстратом. Поэтому конкуренции ингибитора и субстрата за активный центр фермента не происходит, и неконкурентный ингибитор, как правило, связывается с молекулой фермента вне активного центра. Однако это вызывает такое изменение структуры фермента, при котором нарушается нормальное взаимодействие активного центра с субстратом. При этом неконкурентные ингибиторы не влияют на связывание фермента с субстратом, а изменяют только Vмакс. Поскольку неконкурентный ингибитор может связываться как с Е, так и с ES, такое ингибирование нельзя уменьшить путем простого увеличения концентрации субстрата.
Кинетически неконкурентное ингибирование характеризуется снижением Vмакс при неизменном значении Км (рис. 5-26).
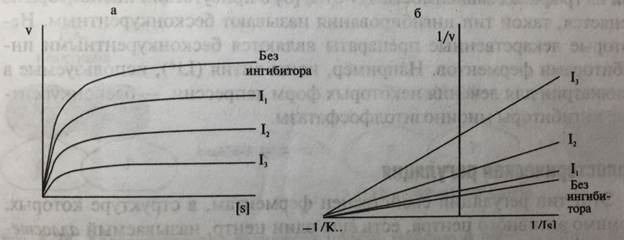 Рис. 5-26. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I I2, I3) неконкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S]
Рис. 5-26. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I I2, I3) неконкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S]
В табл. 5-3 суммированы основные отличия конкурентного и неконкурентного ингибирования.
Таблица 5-3. Основные отличия конкурентного и неконкурентного ингибирования
| Особенности действия ингибитора
| Конкурентное ингибирование
| Неконкурентное ингибирование
|
| Место действия
| Активный центр
| Любой участок молекулы
|
| Сходство с субстратом
| Есть
| Нет
|
| Комплексы с ферментом
| ES, EI
| ES, EI, ESI
|
| Влияние на
Кинетические
параметры
| ↑Км, V = CONST
| ↓V, Км=CONST
|
Стрелки показывают увеличение (↑) или снижение (↓), а знак равенства - отсутствие изменений кинетического параметра.
Смешанное и бесконкурентное ингибирование
Неконкурентное ингибирование в чистом виде встречают очень редко. Чаще наблюдают смешанное ингибирование, когда под действием ингибитора происходит не только снижение Vмакс, но и изменение Км.
В том случае, когда кинетика ингибирования активности фермента характеризуется снижением Vмакс и увеличением Км, а наклон кривой на графиках зависимости 1/v от 1/[S] в присутствии ингибитора не меняется, такой тип ингибирования называют бесконкурентным. Некоторые лекарственные препараты являются бесконкурентными ингибиторами ферментов. Например, ионы лития (Li⁺), используемые в психиатрии для лечения некоторых форм депрессии, - бесконкурентные ингибиторы миоинозитолфосфатазы.
Аллостерическая регуляция
Этот тип регуляции свойственен ферментам, в структуре которых, помимо активного центра, есть еще один центр, называемый аллостерическим (от греч. al l os - другой и stereos - пространственный). Он может находиться на значительном расстоянии от активного центра. Как
правило, аллостерические центры обнаруживают у ферментов, обладающих четвертичной структурой. При этом аллостерический центр может располагаться на одной субъединице, а активный центр на другой. Регуляторы присоединяются к аллостерическому центру с помощью нековалентных связей. Это приводит к конформационным изменениям в структуре всей молекулы, в результате чего каталитическая активность фермента либо увеличивается, либо снижается. Например, фермент цАМФ-зависимая протеинкиназа катализирует реакцию фосфорилирования белка (рис. 5-27).
 Рис. 5-27. Реакция фосфорилирования белка
Рис. 5-27. Реакция фосфорилирования белка
Фермент представляет собой гетеротетрамер, состоящий из двух типов субъединиц: регуляторной (Р) и каталитической (К) (рис. 5-28). Регуляторная субъединица содержит 2 аллостерических центра, в которых связывается аллостерический активатор - цАМФ, а каталитическая - осуществляет собственно реакцию фосфорилирования (присоединения фосфата к аминокислотным остаткам серина или треонина белка-субстрата). В отсутствии цАМФ фермент неактивен. При связывании цАМФ в аллостерических центрах происходит высвобождение каталитических субъединиц из тетрамерного комплекса, которые могут осуществлять реакцию фосфорилирования белков только в виде мономеров. При снижении концентрации свободного цАМФ в клетке он диссоциирует от регуляторных субъединиц, которые вновь соединяются с каталитическими субъединицами в функционально неактивный тетрамер.
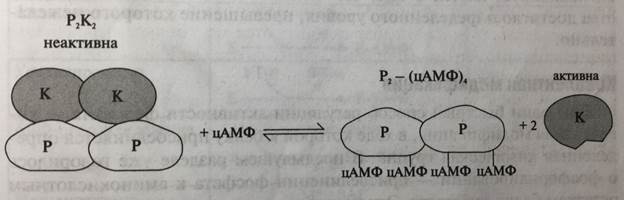 Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
Однако чаще при аллостерической регуляции четвертичная структура белка не меняется, а происходит изменение конформации субъединиц, которое и приводит к изменению каталитической активности фермента. Например, цГМФ-зависимая протеинкиназа, катализирующая реакцию цГМФ-зависимого фосфорилирования белков, аллостерически активируется цГМФ без изменения своего олигомерного состава. Другой пример аллостерической регуляции - ингибирование аспартат-карбамоилтрансферазы - первого фермента биосинтеза пиримидиновых нуклеотидов конечным продуктом данного метаболического пути, включающего несколько промежуточный стадий, цитидинтрифосфатом (ЦТФ).
Аллостерическое ингибирование конечным продуктом метаболического пути активности первого фермента - распространенный способ регуляции обмена веществ в клетке (рис. 5-29).

Рис. 5-29. Механизм регуляции активности фермента по принципу отрицательной обратной связи (схема). Конечный продукт метаболического пути (F) является аллостерическим ингибитором первого фермента этого пути (Е1)
Его еще называют механизмом отрицательной обратной связи. Он сигнализирует клетке о том, что количество синтезируемого вещества достигло определенного уровня, превышение которого нежелательно.
Ковалентная модификация
Еще один быстрый способ регуляции активности фермента - ковалентная модификация, в ходе которой к белку присоединяется определенная химическая группа. В предыдущем разделе уже говорилось о фосфорилировании - присоединении фосфата к аминокислотным остаткам белка-субстрата. Эту реакцию катализируют ферменты класса трансфераз - протеинкиназы. При физиологических значениях рН фосфатная группа несет отрицательный заряд. Именно поэтому присоединение при участии протеинкиназ одного или нескольких остатков фосфата изменяет третичную (четвертичную) структуру и каталитическую активность фосфорилированного фермента.
Ковалентная модификация ферментов, как правило, обратима. В клетках существуют ферменты, возвращающие ковалентно модифицированные белки в исходное состояние. Например, протеинфосфатазы катализируют реакцию дефосфорилирования белка (рис. 5-30).
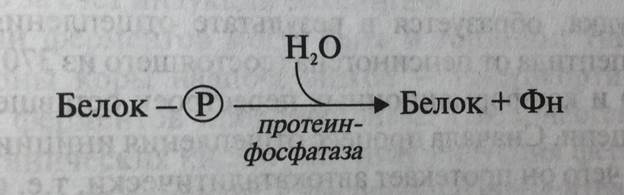 Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
Фосфорилирование - не единственный способ обратимой ковалентной модификации ферментов в клетке. Другие виды обратимой химической модификации ферментов, имеющие важное регуляторное значение, приведены в табл. 5-4.
Таблица 5-4. Примеры обратимой ковалентной модификации ферментов (Е)

Помимо обратимой ковалентной модификации, в организме человека протекают и реакции необратимой ковалентной модификации ферментов. Физиологическое значение имеют реакции ограниченного протеолиза неактивных предшественников протеолитических ферментов желудочно-кишечного тракта, которые приводят к образованию каталитически активных протеиназ: пепсина, трипсина, химотрипсина.
Например, активный пепсин - основной протеолитический фермент желудка, образуется в результате отщепления 42-членного N-концевого пептида от пепсиногена (состоящего из 370 аминокислотных остатков) и конформационных перестроек оставшейся части полипептидной цепи. Сначала процесс отщепления инициируется кислой средой, после чего он протекает автокаталитически, т.е. образовавшиеся молекулы активного пепсина участвуют в превращении пепсиногена в пепсин (рис. 5-31).
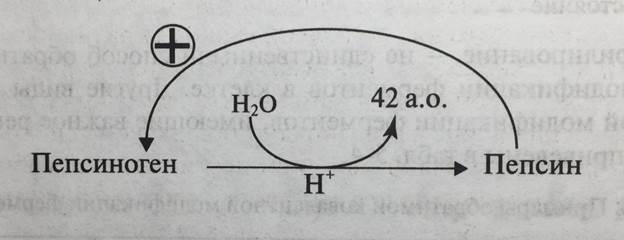 Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки
Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки
Таким образом, в результате ограниченного протеолиза происходит необратимая ковалентная модификация и фермент остается активированным в течение всего времени его жизни.



 Рис. 5-26. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I I2, I3) неконкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S]
Рис. 5-26. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I I2, I3) неконкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S] Рис. 5-27. Реакция фосфорилирования белка
Рис. 5-27. Реакция фосфорилирования белка Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
 Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
 Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки
Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки


