

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...
Топ:
Оснащения врачебно-сестринской бригады.
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Функциональные группы каталитических аминокислотных остатков проявляют свойства кислоты (отдают протон) или основания (принимают протон). Осуществляя перенос протона, эти группы способствуют многократному увеличению скорости реакции. Такой вид катализа называют кислотно-основным.
При связывании субстрата в активном центре его атакуют электрофильные (т.е. принимающие электроны) или нуклеофильные (то есть отдающие электроны) группы каталитических аминокислотных остатков. Это вызывает перераспределение электронной плотности и разрыв связей в субстрате. Такой вид катализа называют ковалентным. Для него характерно формирование ковалентных связей между функциональными группами каталитических аминокислотных остатков активного центра и субстрата.
Для большинства ферментативных реакций характерно сочетание этих механизмов, которые можно рассмотреть на примере гидролиза пептидной связи химотрипсином (рис. 5-8). Активный центр этого фермента включает три каталитических аминокислотных остатка: Сер-195, Гис-57, Асп-102, где остаток гистидина выступает в качестве основания, которое принимает протон от гидроксильной группы Сер-195.
Лишенный протона остаток Сер-О- осуществляет нуклеофильную атаку на группу С=О молекулы субстрата (на рисунке это пептид-СО-NH-пептид). Это приводит к образованию промежуточного соединения (интермедиата), карбоксильная группа которого связана сложноэфирной связью с остатком Сер-195, и высвобождению одного продукта реакции (пептида-NH2).
Сложноэфирная связь затем подвергается гидролизу молекулой Н2О, реакционная способность которой повышается в результате отщепления протона от Гис-57. Этому способствует карбоксильная группа Асп-102. На заключительном этапе положительно заряженный остаток гистидина выступает в качестве кислоты, отдающей протон остатку Сер-195. По завершении каталитического цикла все аминокислотные остатки активного центра возвращаются в исходное состояние.
|
|
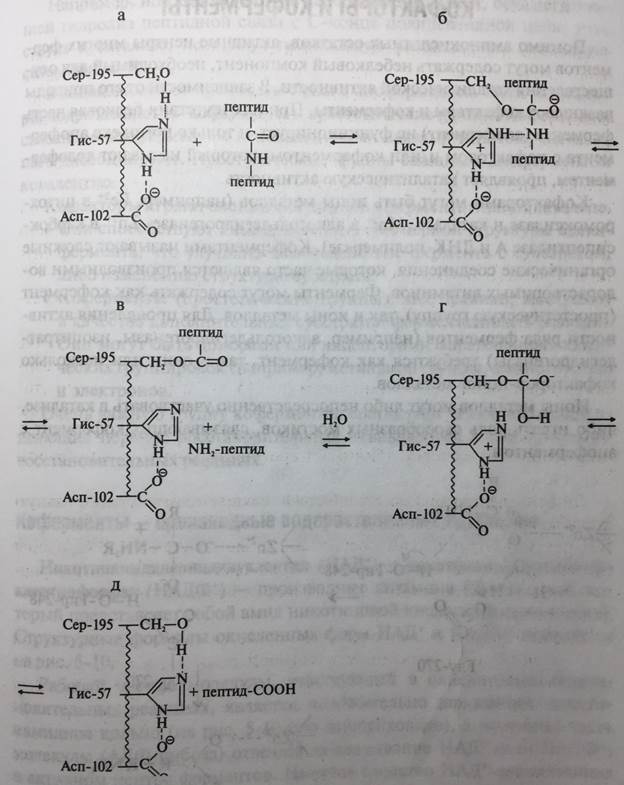
Рис. 5-8. Механизм гидролиза пептидной связи химотрипсином как пример кислотно-основного и ковалентного катализа (а-д)
КОФАКТОРЫ И КОФЕРМЕНТЫ
Помимо аминокислотных остатков, активные центры многих ферментов могут содержать небелковый компонент, необходимый для осуществления каталитической активности. В зависимости от его природы различают кофакторы и коферменты. При их отсутствии белковая часть фермента (апофермент) не функционирует, и только комплекс апофермента с кофактором и/или коферментом, который называют холоферментом, проявляет каталитическую активность.
Кофакторами могут быть ионы металлов (например, Fe2+ в цитохромоксидазе и каталазе, Mn2+ в алкогольдегидрогеназе, Zn2+ в карбоксипептидазе А и ДНК-полимеразе). Коферментами называют сложные органические соединения, которые часто являются производными водорастворимых витаминов. Ферменты могут содержать как кофермент (простетическую группу), так и ионы металлов. Для проявления активности ряда ферментов (например, алкогольдегидрогеназы, изоцитратдегидрогеназы) требуются как кофермент, так и один или несколько кофакторов-ионов металлов.
Ионы металлов могут либо непосредственно участвовать в катализе, либо играть роль своеобразных мостиков, связывающих кофермент с апоферментом.
 Рис. 5-9. Роль цинка в реакции гидролиза пептидной связи, катализируемой карбоксипептидазой А. Показаны каталитические аминокислотные остатки (Глу-270 и Тир-248) этого фермента.
Рис. 5-9. Роль цинка в реакции гидролиза пептидной связи, катализируемой карбоксипептидазой А. Показаны каталитические аминокислотные остатки (Глу-270 и Тир-248) этого фермента.
Например, ион цинка (Zn2+) в карбоксипептидазе А, осуществляющей гидролиз пептидной связи с С-конца полипептидной цепи, участвует в катализе, поляризуя подлежащую расщеплению пептидную связь (рис. 5-9).
|
|
В зависимости от прочности связи с апоферментом такие кофакторы подразделяют на коферменты и простетические группы. Коферменты связаны с апоферментом нековалентными связями и потому легко от него диссоциируют. Простетические группы связаны с апоферментом ковалентно.
Кофакторы играют очень важную роль в ферментативном катализе.
• Они способствуют либо изменению трехмерной структуры белка-фермента, что улучшает взаимодействие фермента с субстратом, либо изменению структуры субстрата.
• Коферменты (простетические группы), как правило, выступают в качестве дополнительных субстратов ферментативной реакции. Они могут быть донорами или акцепторами определенных химических группировок (например, метильной группы, аминогруппы) и электронов.
Очень важную группу коферментов составляют вещества, осуществляющие перенос восстановительных эквивалентов в окислительно-восстановительных реакциях.
|
|
|

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!