Ферменты
ОПРЕДЕЛЕНИЕ
В клетках человека ежесекундно совершается множество химических превращений, которые осуществляются в мягких условиях (при температуре тела, умеренных значениях рН и атмосферном давлении) с высокой скоростью, благодаря присутствию особых биологических катализаторов. В настоящее время каталитическая активность обнаружена главным образом у ферментов, а также у антител и некоторых видов РНK.
Общие свойства биологических и небиологических катализаторов:
· Действуют в ничтожно малых количествах по сравнению с содержанием регулирующих веществ;
· Катализируют только энергетически возможные реакции;
· Не сдвигают равновесие реакции, но ускоряют его достижение;
· Не расходуются (за редким исключением) в процессе реакции.
Биологические катализаторы, как и катализаторы небиологических систем, ускоряют химические реакции, сжигая энергию активации. В обычном состоянии исходные молекулы субстрата (S) характеризуются стабильной структурой, обладают невысокой свободной энергией и потому химически инертны (рис. 5-1). Для дестабилизации структуры и увеличения реакционной способности молекулы субстрата необходимо перевести в переходное состояние, характеризуемое более высоким значением свободной энергии. Именно в переходном состоянии возможны разрывы старых химических связей и образование новых.
Энергию, необходимую для достижения субстратом переходного состояния, называют энергией активации (Еакт). Для каждой химической реакции характерно свое значение энергии активации. Чем легче достигается переходное состояние, тем больше скорость реакции.
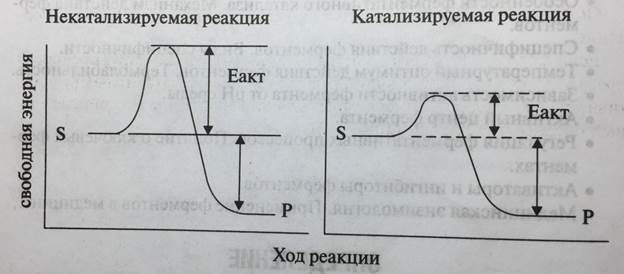
Рис. 5-1. Изменение свободной энергии некатализируемой и катализируемой химической реакции
Катализатор (биологический или небиологический) повышает скорость химической реакции (превращения субстрата S в продукт Р), изменяя ее путь таким образом, что каталитической реакции свойственна более низкая величина энергии активации. При этом общая энергия суммарной реакции не изменяется.
Ферменты – биологические катализаторы белковой природы. Раздел биохимии, изучающий структуру ферментов и катализируемые ими реакции, называют энзимологией. Именно ферменты катализируют тысячи химических реакций, из которых в конечном счете слагается обмен веществ в клетке. Их отличают:
· Высокая каталитическая эффективность – например, фермент карбоангидраза ускоряет реакцию образования угольной кислоты (СО2+Н2О→Н++НСО3-) в 107 раз (в 10 млн!);
· Специфичность действия – каждый фермент катализирует конкретную химическую реакцию, и при этом не образует побочные продукты;
· Регулируемость – разнообразные вещества могут увеличивать или снижать каталитическую активность ферментов.
Исследования структуры и функции ферментов позволили не только охарактеризовать особенности протекания метаболических процессов в клетках, но и использовать накопленные знания в клинической практике для диагностики и лечении многих заболеваний.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
В основу классификации ферментов (КФ) положен тип катализируемой реакции, а также те превращения, которые претерпевают те или иные функциональные группы молекул субстратов. Все ферменты (а к настоящему времени открыто более 2000 ферментов, и этот список продолжает пополняться) разделены на 6 классов:
· Оксидоредуктазы – катализируют окислительно-восстановительные реакции;
· Трансферазы – осуществляют межмолекулярный перенос групп;
· Гидролазы – катализируют гидролитическое расщепление субстратов;
· Лиазы – осуществляют негидролитическое отщепление от субстратов различных химических групп (NH₂, CO₂, H₂o, и др.) или присоединение по двойной связи молекул воды, а также других метaболитов без участия энергии АТФ;
· Изомеразы – катализируют реакции изомеризации органических субстратов;
· Лигазы, или синтетазы, - катализируют синтетические реакции, сопровождаемые отщеплением остатков фосфорной кислоты от АТФ или другого нуклеозидтрифосфата.
Каждый из этих классов подразделяют на подклассы, а их, в свою очередь, на более мелкие группы подклассы.
В современной КФ каждому индивидуальному ферменту присвоен свой шифр, состоящий из четырех разделенных точками чисел. Первое число показывает, к какому классу из шести классов принадлежит фермент. Второе число указывает подкласс. Третье обозначает подподкласс, а четвертое – порядковый номер фермента в его подклассе. Например, фермент алкогольдегидрогеназа, катализирующий реакцию дегидрированию спиртов (R – СH₂OH + HAД⁺ → R – CHO + HAДН + Н⁺), имеет шифр КФ 1.1.1.1. это означает, что он относится к 1-му классу ферментов (оксидоредуктаз), действует на –СН–ОН-группу окисляемого субстрата (1-й подкласс), что акцептором, на который переносится атом водорода и электрон, является НАД (1-й подкласс), и, наконец, что фермент алкогольдегидрогеназа стоит первым в списке такого рода ферментов.
Специфичность ферментов
Одним из характерных свойств ферментов является их высокая специфичность, в силу которой каждый фермент действует либо на одно вещество, либо на группу родственных по структуре веществ.
В зависимости от того, превращение какого количества субстратов катализирует данный фермент, различают абсолютную и относительную субстратную специфичность. Под термином абсолютная специфичность подразумевают способность фермента катализировать превращение одного единственного субстрата. Абсолютной специфичностью обладает, например, фермент аргиназа, катализирующий реакцию расщепления аргинина на мочевину и орнитин. Наивысшей степенью абсолютной субстратной специфичности является стереоспецифичность, когда фермент может осуществлять каталитическое превращение только одного из стереоизомеров вещества.
Например, фермент фумараза, катализирующий реакцию гидратации фумарата (транс -изомер), неактивен в отношении малеината (цис- изомера) (рис. 5-3).
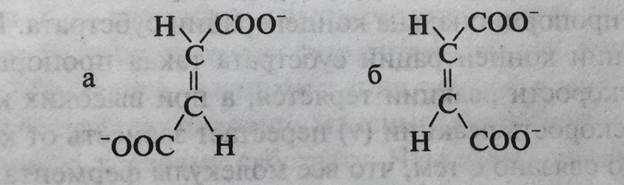 Рис. 5-3. Структурные формулы: а - фумарата; б - малеината
Рис. 5-3. Структурные формулы: а - фумарата; б - малеината
Чаще ферменты катализируют превращение сходной по строению группы субстратов, т.е. проявляют относительную (или групповую) субстратную специфичность. Такие ферменты, как правило, действуют либо на определенную химическую группу, либо на определенный тип химических связей. Например, уже упоминавшийся фермент алкогольдегидрогеназа катализирует реакцию дегидрирования не только этанола, но и метанола, а также других алифатических спиртов. Панкреатическая липаза, действующая в двенадцатиперстной кишке человека, гидролизует сложноэфирные связи в молекулах триацилглицеролов независимо от того, какие жирные кислоты участвуют в их образовании. Протеолитические ферменты катализируют реакцию гидролиза пептидной связи в различных белках. При этом протеолитические ферменты сильно различаются по степени субстратной специфичности. Так, фермент субтилизин, синтезируемый определенными видами бактерий, расщепляет пептидную связь независимо от природы образующих ее аминокислот, а фермент дуоденального сока трипсин расщепляет только те пептидные связи, которые образованы карбоксильными группами аргинина или лизина (рис. 5-4).
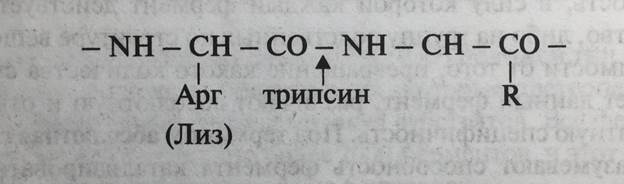
Рис. 5-4. Воздействие трипсина на пептидные связи
СТРУКТУРА ФЕРМЕНТОВ
Несмотря на то, что молекулярная масса различных ферментов колеблется в очень широком диапазоне, размеры белковых молекул ферментов намного превышают размеры их субстратов. Именно поэтому ферменты взаимодействуют с субстратами сравнительно небольшим участком, получившим название «активный центр».
Активный центр
Активный центр - участок молекулы фермента, осуществляющий связывание субстрата и его каталитическое превращение (рис. 5-6). Поскольку он формируется на уровне третичной структуры белка, аминокислотные остатки, входящие в его состав, могут быть расположены в полипептидной цепи на значительном расстоянии друг от друга. Например, в активном центре пепсина расположены каталитические аминокислотные остатки Асп-32 и Асп-215 (номер указывает на положение аминокислотного остатка в полипептидной цепи), и именно их карбоксильные группы участвуют в расщеплении пептидной связи субстрата. В молекуле химотрипсина каталитическими аминокислотными остатками являются Гис-57, Асп-102 и Сер-195.
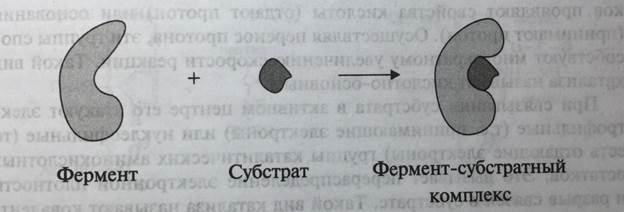 Рис. 5-6. Молекула фермента, в активном центре которого находится молекула субстрата
Рис. 5-6. Молекула фермента, в активном центре которого находится молекула субстрата
В составе активного центра выделяют участки субстратсвязывающий и каталитический, обеспечивающие ферментативное превращение субстрата.
Связывание субстрата с активным центром фермента осуществляется путем образования нековалентных связей (водородных, электростатических, гидрофобных) с аминокислотными остатками субстратсвязывающего участка. Это вызывает дестабилизацию связей в молекуле субстрата, которые атакуются каталитическими аминокислотными остатками с образованием продукта реакции (рис. 5-7).
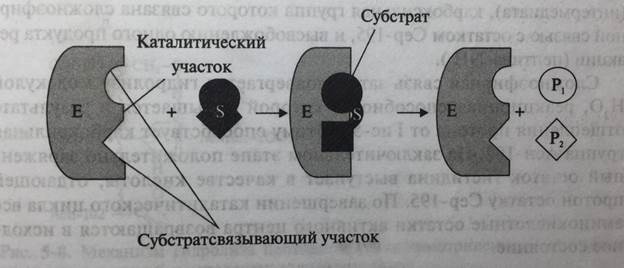
Рис. 5-7. Превращение субстрата S в активном центре фермента с образованием продуктов P1 и P2 (схема)
КОФАКТОРЫ И КОФЕРМЕНТЫ
Помимо аминокислотных остатков, активные центры многих ферментов могут содержать небелковый компонент, необходимый для осуществления каталитической активности. В зависимости от его природы различают кофакторы и коферменты. При их отсутствии белковая часть фермента (апофермент) не функционирует, и только комплекс апофермента с кофактором и/или коферментом, который называют холоферментом, проявляет каталитическую активность.
Кофакторами могут быть ионы металлов (например, Fe2+ в цитохромоксидазе и каталазе, Mn2+ в алкогольдегидрогеназе, Zn2+ в карбоксипептидазе А и ДНК-полимеразе). Коферментами называют сложные органические соединения, которые часто являются производными водорастворимых витаминов. Ферменты могут содержать как кофермент (простетическую группу), так и ионы металлов. Для проявления активности ряда ферментов (например, алкогольдегидрогеназы, изоцитратдегидрогеназы) требуются как кофермент, так и один или несколько кофакторов-ионов металлов.
Ионы металлов могут либо непосредственно участвовать в катализе, либо играть роль своеобразных мостиков, связывающих кофермент с апоферментом.
 Рис. 5-9. Роль цинка в реакции гидролиза пептидной связи, катализируемой карбоксипептидазой А. Показаны каталитические аминокислотные остатки (Глу-270 и Тир-248) этого фермента.
Рис. 5-9. Роль цинка в реакции гидролиза пептидной связи, катализируемой карбоксипептидазой А. Показаны каталитические аминокислотные остатки (Глу-270 и Тир-248) этого фермента.
Например, ион цинка (Zn2+) в карбоксипептидазе А, осуществляющей гидролиз пептидной связи с С-конца полипептидной цепи, участвует в катализе, поляризуя подлежащую расщеплению пептидную связь (рис. 5-9).
В зависимости от прочности связи с апоферментом такие кофакторы подразделяют на коферменты и простетические группы. Коферменты связаны с апоферментом нековалентными связями и потому легко от него диссоциируют. Простетические группы связаны с апоферментом ковалентно.
Кофакторы играют очень важную роль в ферментативном катализе.
• Они способствуют либо изменению трехмерной структуры белка-фермента, что улучшает взаимодействие фермента с субстратом, либо изменению структуры субстрата.
• Коферменты (простетические группы), как правило, выступают в качестве дополнительных субстратов ферментативной реакции. Они могут быть донорами или акцепторами определенных химических группировок (например, метильной группы, аминогруппы) и электронов.
Очень важную группу коферментов составляют вещества, осуществляющие перенос восстановительных эквивалентов в окислительно-восстановительных реакциях.
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Высокая эффективность ферментативного катализа, реализуемая в мягких физиологических условиях внутриклеточной среды, определяется уникальным соответствием между ферментом и субстратом, которое возникает в ходе их взаимодействия.
Связывание субстрата в активном центре, в котором участвуют силы, стабилизирующие пространственную структуру белка (см. главу 1), вызывает значительные изменения в расположении каталитических групп фермента. Это, в свою очередь, оказывает влияние и на молекулу субстрата, структура которого деформируется, подстраиваясь под структуру активного центра. В процессе сложных взаимодействий исходный фермент-субстратный комплекс (ES) претерпевает ряд изменений, в результате которых активный центр становится комплементарен переходному состоянию субстрата (ES*). При этом выделяется небольшое количество энергии, получившей название энергии связывания, которая и вносит основной вклад в достижение субстратом переходного состояния, необходимого для совершения химической реакции (рис. 5-19).
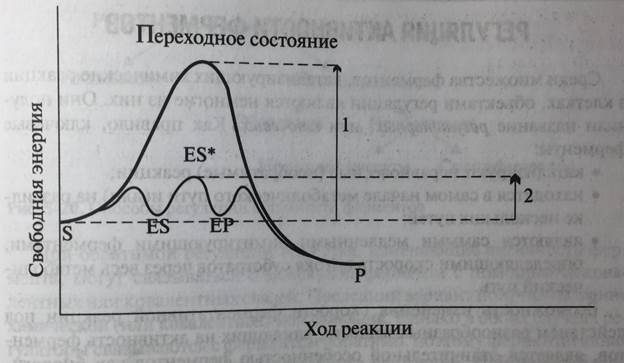
Рис. 5-19. Роль энергии связывания в ферментативном катализе. Энергия связывания вносит основной вклад в снижение энергии, которое происходит в результате ряда превращений фермент-субстратного комплекса (ES)→(ES*) с малым энергетическим барьером, в результате чего и происходит большое снижение энергии активации. 1 и 2 - показывают изменения свободной энергии, характерные для некатализируемой и катализируемой реакции S→P соответственно
Рассмотренный механизм изменения структуры фермента и субстрата получил название индуцированного соответствия. Он позволяет объяснить не только высокую каталитическую эффективность ферментов, но и природу специфичности их действия. Изменения в структуре активного центра, приводящие к определенной ориентации каталитических групп, могут быть вызваны только специфическими для данного фермента субстратами. В случае ферментов, проявляющих относительную субстратную специфичность, взаимные влияния фермента и субстрата в ходе преобразования фермент-субстратного комплекса будут различаться, поэтому эффективность каталитического превращения родственных субстратов тоже не будет одинаковой. Так, эффективность реакции дегидрирования одноатомных спиртов, катализируемой алкогольдегидрогеназой, зависит от структуры радикала и повышается с увеличением длины углеводородного скелета.
Аллостерическая регуляция
Этот тип регуляции свойственен ферментам, в структуре которых, помимо активного центра, есть еще один центр, называемый аллостерическим (от греч. al l os - другой и stereos - пространственный). Он может находиться на значительном расстоянии от активного центра. Как
правило, аллостерические центры обнаруживают у ферментов, обладающих четвертичной структурой. При этом аллостерический центр может располагаться на одной субъединице, а активный центр на другой. Регуляторы присоединяются к аллостерическому центру с помощью нековалентных связей. Это приводит к конформационным изменениям в структуре всей молекулы, в результате чего каталитическая активность фермента либо увеличивается, либо снижается. Например, фермент цАМФ-зависимая протеинкиназа катализирует реакцию фосфорилирования белка (рис. 5-27).
 Рис. 5-27. Реакция фосфорилирования белка
Рис. 5-27. Реакция фосфорилирования белка
Фермент представляет собой гетеротетрамер, состоящий из двух типов субъединиц: регуляторной (Р) и каталитической (К) (рис. 5-28). Регуляторная субъединица содержит 2 аллостерических центра, в которых связывается аллостерический активатор - цАМФ, а каталитическая - осуществляет собственно реакцию фосфорилирования (присоединения фосфата к аминокислотным остаткам серина или треонина белка-субстрата). В отсутствии цАМФ фермент неактивен. При связывании цАМФ в аллостерических центрах происходит высвобождение каталитических субъединиц из тетрамерного комплекса, которые могут осуществлять реакцию фосфорилирования белков только в виде мономеров. При снижении концентрации свободного цАМФ в клетке он диссоциирует от регуляторных субъединиц, которые вновь соединяются с каталитическими субъединицами в функционально неактивный тетрамер.
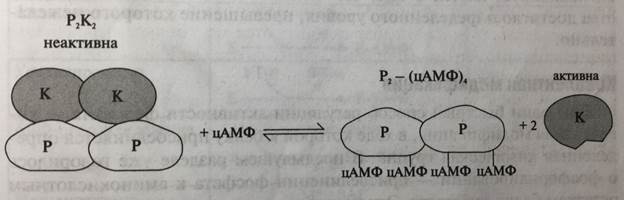 Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
Однако чаще при аллостерической регуляции четвертичная структура белка не меняется, а происходит изменение конформации субъединиц, которое и приводит к изменению каталитической активности фермента. Например, цГМФ-зависимая протеинкиназа, катализирующая реакцию цГМФ-зависимого фосфорилирования белков, аллостерически активируется цГМФ без изменения своего олигомерного состава. Другой пример аллостерической регуляции - ингибирование аспартат-карбамоилтрансферазы - первого фермента биосинтеза пиримидиновых нуклеотидов конечным продуктом данного метаболического пути, включающего несколько промежуточный стадий, цитидинтрифосфатом (ЦТФ).
Аллостерическое ингибирование конечным продуктом метаболического пути активности первого фермента - распространенный способ регуляции обмена веществ в клетке (рис. 5-29).

Рис. 5-29. Механизм регуляции активности фермента по принципу отрицательной обратной связи (схема). Конечный продукт метаболического пути (F) является аллостерическим ингибитором первого фермента этого пути (Е1)
Его еще называют механизмом отрицательной обратной связи. Он сигнализирует клетке о том, что количество синтезируемого вещества достигло определенного уровня, превышение которого нежелательно.
Ковалентная модификация
Еще один быстрый способ регуляции активности фермента - ковалентная модификация, в ходе которой к белку присоединяется определенная химическая группа. В предыдущем разделе уже говорилось о фосфорилировании - присоединении фосфата к аминокислотным остаткам белка-субстрата. Эту реакцию катализируют ферменты класса трансфераз - протеинкиназы. При физиологических значениях рН фосфатная группа несет отрицательный заряд. Именно поэтому присоединение при участии протеинкиназ одного или нескольких остатков фосфата изменяет третичную (четвертичную) структуру и каталитическую активность фосфорилированного фермента.
Ковалентная модификация ферментов, как правило, обратима. В клетках существуют ферменты, возвращающие ковалентно модифицированные белки в исходное состояние. Например, протеинфосфатазы катализируют реакцию дефосфорилирования белка (рис. 5-30).
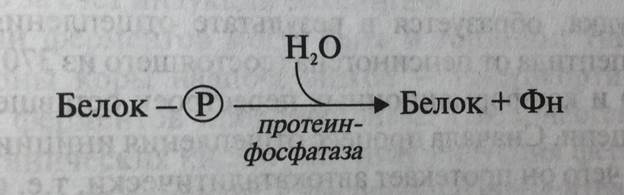 Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
Фосфорилирование - не единственный способ обратимой ковалентной модификации ферментов в клетке. Другие виды обратимой химической модификации ферментов, имеющие важное регуляторное значение, приведены в табл. 5-4.
Таблица 5-4. Примеры обратимой ковалентной модификации ферментов (Е)

Помимо обратимой ковалентной модификации, в организме человека протекают и реакции необратимой ковалентной модификации ферментов. Физиологическое значение имеют реакции ограниченного протеолиза неактивных предшественников протеолитических ферментов желудочно-кишечного тракта, которые приводят к образованию каталитически активных протеиназ: пепсина, трипсина, химотрипсина.
Например, активный пепсин - основной протеолитический фермент желудка, образуется в результате отщепления 42-членного N-концевого пептида от пепсиногена (состоящего из 370 аминокислотных остатков) и конформационных перестроек оставшейся части полипептидной цепи. Сначала процесс отщепления инициируется кислой средой, после чего он протекает автокаталитически, т.е. образовавшиеся молекулы активного пепсина участвуют в превращении пепсиногена в пепсин (рис. 5-31).
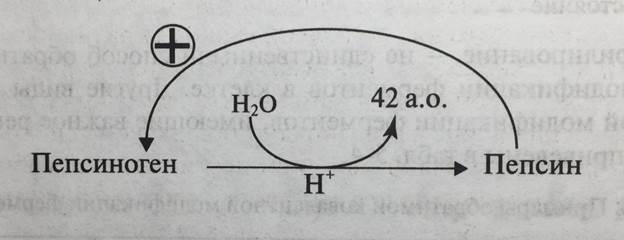 Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки
Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки
Таким образом, в результате ограниченного протеолиза происходит необратимая ковалентная модификация и фермент остается активированным в течение всего времени его жизни.
Изоферменты
Изоферментами называют каталитически сходные множественные формы фермента у организмов одного вида, отличаемые по своим физико-химическим и иммунологическим свойствам.
Различают следующие изоферменты:
• Генетически независимые белки, кодируемые разными генами. Например, цитозольная и митохондриальная формы малатдегидрогеназы (МДГ), катализирующие обратимую реакцию дегидрирования малата:
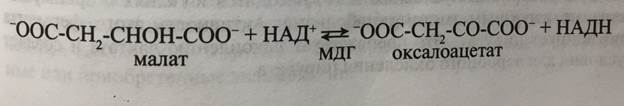
• Олигомерные ферменты, состоящие из разных субъединиц. Например, фермент гликолиза лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию дегидрирования молочной кислоты (лактата):
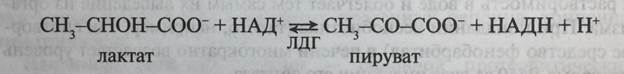
Фермент является тетрамером, который может быть построен из двух типов субъединиц - H и M. Они получили свое название по первым буквам органов, из которых были выделены (от англ. heart - сердце и muscle - мышца). Субъединичный состав ЛДГ в разных тканях зависит от того, какие гены в них экспрессируются. В организме человека присутствует пять изоферментов ЛДГ, образованных Н- и М-субъединицами (табл. 5-5).
Таблица 5-5. Распределение изоферментов лактатдегидрогеназы в органах

Изоферменты ЛДГ различают по оптимуму рН, сродству к субстратам реакции, электрофоретической подвижности.
Преобладание того или иного изофермента в определенных тканях имеет большое биологическое значение. Например, в тканях с преобладанием анаэробного метаболизма (скелетных мышцах, печени) присутствует ЛДГ5. Данный изофермент нечувствителен к ингибированию физиологическими концентрациями пирувата. Это способствует эффективному протеканию гликолиза (так называют процесс расщепления глюкозы до молочной кислоты, сопровождаемый образованием АТФ) в анаэробных условиях. ЛДГ1 находится в тканях с преимущественно аэробным типом метаболизма. Активность этого фермента ингибирует пируват. Это препятствует накоплению лактата и создает условия для аэробного окисления пирувата.
В записную книжку врача
ФЕРМЕНТЫ В МЕДИЦИНЕ
Медицинскую энзимологию подразделяют на два направления: энзимодиагностику и энзимотерапию.
Энзимодиагностика
Исследование активности внутриклеточных ферментов в биоптатах тканей или форменных элементах крови позволяет обнаружить увеличение, снижение, а также полное их отсутствие в организме. В одних случаях изменение активности ферментов может является критерием предрасположенности человека или фактором риска развития определенных заболеваний, в других - позволяет диагностировать врожденные или приобретенные энзимопатии.
Например, повышение активности моноаминоксидазы (МАО) в тромбоцитах взрослых людей увеличивает, а снижение активности уменьшает риск развития болезни Паркинсона. Дефицит или полное отсутствие фермента аденозиндезаминазы в лимфоцитах наблюдают при врожденном иммунодефиците.
Большинство ферментативных реакций в организме протекает внутри клеток в определенных субклеточных компартментах. В биологические жидкости, в первую очередь в кровь, внутриклеточные ферменты попадают в результате гибели клеток или увеличения проницаемости клеточных мембран. Кроме того, в крови циркулируют секреторные ферменты, уровень которых при различных заболеваниях также может изменяться.
Наиболее информативным для диагностики считают определение активности внутриклеточных ферментов, поскольку в норме их активность в сыворотке (плазме) крови невысока или вообще не определяется (табл. 5-6).
Таблица 5-6. Ферменты, используемые при диагностике заболеваний некоторых органов и тканей
| Орган/заболевание
| Ферменты, определяемые в плазме или сыворотке крови
|
| Инфаркт миокарда
| Креатинкиназа (КК-МВ), аспартатаминотрансфераза (АСТ), лактатдегидрогеназа (ЛДГ1, ЛДГ2)
|
| Заболевание печени
| Лактатдегидрогеназа (ЛДГ4, ЛДГ5), аланинаминотрансфераза (АЛТ), орнитинкарбамоилтрансфераза, уроканиназа, гистидаза, холинэстераза
|
| Заболевания скелетных мышц
| Креатинкиназа (КК-ММ), альдолаза,
лактатдегидрогеназа (ЛДГ4, ЛДГ5)
|
Повышение активности внутриклеточных ферментов в крови могут быть как результатом некроза клеток (КК и АСТ при инфаркте миокарда), так и повышения проницаемости клеточных мембран (АЛТ и АСТ при вирусном гепатите, КК при мышечных дистрофиях).
С медицинской точки зрения знание преимущественной тканевой локализации изоферментов позволяет использовать их в дифференциальной диагностике заболеваний. Увеличение активности ЛДГ1 и ЛДГ2 отмечают в сыворотке крови в течение первых суток после возникновения инфаркта миокарда. Увеличение активности ЛДГ5 наблюдают при поражениях печени (гепатите, интоксикациях, травматических повреждениях, циррозе).
Возможно и снижение активности секреторных ферментов по сравнению с нормальными величинами, которое может быть обусловлено:
• уменьшением числа клеток, секретирующих данный фермент (например, холинэстеразы при циррозе печени);
• недостаточным синтезом конкретного фермента (например, церу-лоплазмина при гепатолентикулярной дегенерации);
• увеличением в крови специфических ингибиторов (например, α1-протеиназного ингибитора, α2-макроглобулина и других плазменных ингибиторов).
В записную книжку врача
Энзимопатии
Нарушение синтеза определенных ферментов обычно приводит к возникновению заболеваний, получивших название энзимопатий. Различают врожденные и приобретенные энзимопатии. Например, тяжелые врожденные заболевания развиваются при отсутствии ферментов, участвующих в обмене гликогена, а примером приобретенных энзимопатий может быть непереносимость лактозы, свойственная взрослым и пожилым людям.
Энзимотерапия
Энзимотерапия - использование ферментов и модуляторов действия ферментов (активаторов и ингибиторов) в качестве лекарственных средств. В одних случаях это может быть заместительная терапия - применение ферментных препаратов, которые восполняют дефицит собственного фермента в организме. Примером такого рода лечения может быть назначение натурального желудочного сока или смеси соляной кислоты с пепсином при гастритах с пониженной секрецией или ферментов поджелудочной железы для улучшения пищеварения в кишечнике при энтероколитах.
В других случаях врачи используют ферментные препараты, основываясь на знании механизмов их действия. Для очистки гнойных ран, например, применяют протеолитические ферменты. Они эффективно расщепляют некротизированные ткани, не влияя на здоровые.
Фермент гиалуронидаза расщепляет гиалуроновую кислоту. Это способствует увеличению проницаемости тканей. Именно поэтому коммерческие препараты гиалуронидазы (лидаза, ронидаза) используют в медицинской практике вместе с антибиотиками при лечении туберкулеза или с противовоспалительными средствами при ревматоидном артрите для повышения концентрации в очагах поражения.
В записную книжку врача
Ферменты
ОПРЕДЕЛЕНИЕ
В клетках человека ежесекундно совершается множество химических превращений, которые осуществляются в мягких условиях (при температуре тела, умеренных значениях рН и атмосферном давлении) с высокой скоростью, благодаря присутствию особых биологических катализаторов. В настоящее время каталитическая активность обнаружена главным образом у ферментов, а также у антител и некоторых видов РНK.
Общие свойства биологических и небиологических катализаторов:
· Действуют в ничтожно малых количествах по сравнению с содержанием регулирующих веществ;
· Катализируют только энергетически возможные реакции;
· Не сдвигают равновесие реакции, но ускоряют его достижение;
· Не расходуются (за редким исключением) в процессе реакции.
Биологические катализаторы, как и катализаторы небиологических систем, ускоряют химические реакции, сжигая энергию активации. В обычном состоянии исходные молекулы субстрата (S) характеризуются стабильной структурой, обладают невысокой свободной энергией и потому химически инертны (рис. 5-1). Для дестабилизации структуры и увеличения реакционной способности молекулы субстрата необходимо перевести в переходное состояние, характеризуемое более высоким значением свободной энергии. Именно в переходном состоянии возможны разрывы старых химических связей и образование новых.
Энергию, необходимую для достижения субстратом переходного состояния, называют энергией активации (Еакт). Для каждой химической реакции характерно свое значение энергии активации. Чем легче достигается переходное состояние, тем больше скорость реакции.

Рис. 5-1. Изменение свободной энергии некатализируемой и катализируемой химической реакции
Катализатор (биологический или небиологический) повышает скорость химической реакции (превращения субстрата S в продукт Р), изменяя ее путь таким образом, что каталитической реакции свойственна более низкая величина энергии активации. При этом общая энергия суммарной реакции не изменяется.
Ферменты – биологические катализаторы белковой природы. Раздел биохимии, изучающий структуру ферментов и катализируемые ими реакции, называют энзимологией. Именно ферменты катализируют тысячи химических реакций, из которых в конечном счете слагается обмен веществ в клетке. Их отличают:
· Высокая каталитическая эффективность – например, фермент карбоангидраза ускоряет реакцию образования угольной кислоты (СО2+Н2О→Н++НСО3-) в 107 раз (в 10 млн!);
· Специфичность действия – каждый фермент катализирует конкретную химическую реакцию, и при этом не образует побочные продукты;
· Регулируемость – разнообразные вещества могут увеличивать или снижать каталитическую активность ферментов.
Исследования структуры и функции ферментов позволили не только охарактеризовать особенности протекания метаболических процессов в клетках, но и использовать накопленные знания в клинической практике для диагностики и лечении многих заболеваний.
Каталитическая активность ферментов
Об активности фермента судят по скорости катализируемой им реакции.
Если фермент Е (от англ. enzyme – фермент) катализирует реакцию превращения субстрата S в продукт Р (S→P), то его каталитическую активность определяют, измеряя убыль S или накопление Р за определенный промежуток времени (рис. 5-2).
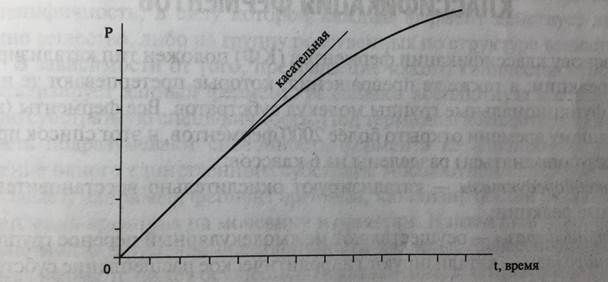 Рис. 5-2. Зависимость накопления продукта реакции (Р) от времени (t)
Рис. 5-2. Зависимость накопления продукта реакции (Р) от времени (t)
На начальном участке кривой зависимости скорости реакции от времени, регистрируемой по накоплению продукта Р, реакция идет с постоянной скоростью. В дальнейшем такая пропорциональность теряется и скорость накопления продукта замедляется. Это может быть следствием разнообразных причин. Снижение скорости реакции, например, происходит по мере приближения химической реакции S→P к положения равновесия. Именно поэтому на практике активность ферментов определяют на начальном участке кривой, который находят, проводя касательную.
В научной и клинико-лабораторной практике активность ферментов чаще всего выражают в международных единицах (сокращенно МЕ или просто ЕД). Международная единица активности фермента – такое его количество, которое катализирует превращение 1 мкмоля субстрата в минуту (мкмоль/мин).
В системе МИ единица активности катал (сокращенно кат) соответствует тому количеству фермента, которое катализирует превращение 1 моля субстрата в секунду. Одна международная единица активности фермента (1 МЕ) равна 16,67 нанокат (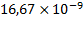 катал), а 1 кат =
катал), а 1 кат = 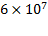 МЕ. Правда, следует отметить, что катал как единица активности фермента не получила широкого применения.
МЕ. Правда, следует отметить, что катал как единица активности фермента не получила широкого применения.
В практической работе часто используют активность фермента, которую выражают в единицах фермента на 1 мг белка того объекта, в котором содержится данный фермент. В жидких средах организма (например, в плазме или сыворотке крови, слюне и десневой жидкости) активность выражают в единицах фермента на 1л.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
В основу классификации ферментов (КФ) положен тип катализируемой реакции, а также те превращения, которые претерпевают те или иные функциональные группы молекул субстратов. Все ферменты (а к настоящему времени открыто более 2000 ферментов, и этот список продолжает пополняться) разделены на 6 классов:
· Оксидоредуктазы – катализируют окислительно-восстановительные реакции;
· Трансферазы – осуществляют межмолекулярный перенос групп;
· Гидролазы – катализируют гидролитическое расщепление субстратов;
· Лиазы – осуществляют негидролитическое отщепление от субстратов различных химических групп (NH₂, CO₂, H₂o, и др.) или присоединение по двойной связи молекул воды, а также других метaболитов без участия энергии АТФ;
· Изомеразы – катализируют реакции изомеризации органических субстратов;
· Лигазы, или синтетазы, - катализируют синтетические реакции, сопровождаемые отщеплением остатков фосфорной кислоты от АТФ или другого нуклеозидтрифосфата.
Каждый из этих классов подразделяют на подклассы, а их, в свою очередь, на более мелкие группы подклассы.
В современной КФ каждому индивидуальному ферменту присвоен свой шифр, состоящий из четырех разделенных точками чисел. Первое число показывает, к какому классу из шести классов принадлежит фермент. Второе число указывает подкласс. Третье обозначает подподкласс, а четвертое – порядковый номер фермента в его подклассе. Например, фермент алкогольдегидрогеназа, катализирующий реакцию дегидрированию спиртов (R – СH₂OH + HAД⁺ → R – CHO + HAДН + Н⁺), имеет шифр КФ 1.1.1.1. это означает, что он относится к 1-му классу ферментов (оксидоредуктаз), действует на –СН–ОН-группу окисляемого субстрата (1-й подкласс), что акцептором, на который переносится атом водорода и электрон, является НАД (1-й подкласс), и, наконец, что фермент алкогольдегидрогеназа стоит первым в списке такого рода ферментов.
Специфичность ферментов
Одним из характерных свойств ферментов является их высокая специфичность, в силу которой каждый фермент действует либо на одно вещество, либо на группу родственных по структуре веществ.
В зависимости от того, превращение какого количества субстратов катализирует данный фермент, различают абсолютную и относительную субстратную специфичность. Под термином абсолю




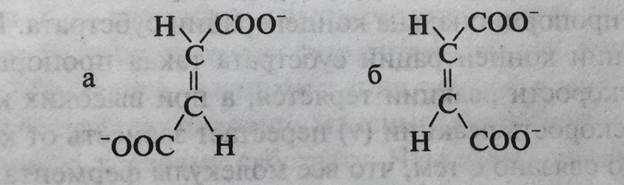 Рис. 5-3. Структурные формулы: а - фумарата; б - малеината
Рис. 5-3. Структурные формулы: а - фумарата; б - малеината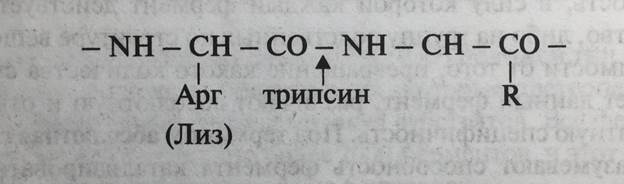
 Рис. 5-6. Молекула фермента, в активном центре которого находится молекула субстрата
Рис. 5-6. Молекула фермента, в активном центре которого находится молекула субстрата
 Рис. 5-9. Роль цинка в реакции гидролиза пептидной связи, катализируемой карбоксипептидазой А. Показаны каталитические аминокислотные остатки (Глу-270 и Тир-248) этого фермента.
Рис. 5-9. Роль цинка в реакции гидролиза пептидной связи, катализируемой карбоксипептидазой А. Показаны каталитические аминокислотные остатки (Глу-270 и Тир-248) этого фермента.
 Рис. 5-27. Реакция фосфорилирования белка
Рис. 5-27. Реакция фосфорилирования белка Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
Рис. 5-28. Аллостерическая активация цАМФ-зависимой протеинкиназы под действием цАМФ (схема): P - регуляторные субъединицы; К - каталитические субъединицы
 Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
Рис. 5-30. Реакция дефосфорилирования белка. Отщепление остатка фосфата возвращает структуру молекулы фермента и его каталитическую активность в исходное состояние
 Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки
Рис. 5-31. Превращение пепсиногена в пепсин. а.о. - аминокислотные остатки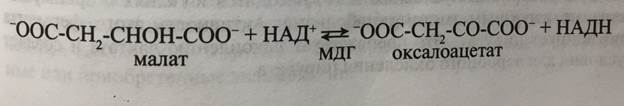
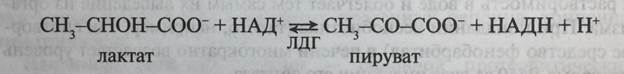

 Рис. 5-2. Зависимость накопления продукта реакции (Р) от времени (t)
Рис. 5-2. Зависимость накопления продукта реакции (Р) от времени (t)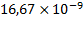 катал), а 1 кат =
катал), а 1 кат = 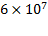 МЕ. Правда, следует отметить, что катал как единица активности фермента не получила широкого применения.
МЕ. Правда, следует отметить, что катал как единица активности фермента не получила широкого применения.


