Сorynebacterium diphtheriae / Дифтерийный токсин | АDФ-рибозил-трансфереза | Фактор элонгации-2 | Дифтерия | Да | ~1.6 мкг (м) ~100 нг (ч)
E. coli / Shigella dysenteriae /Шига-токсин | N-гликозидаза | 28SpPHK | Геморрагический колит, гемолитический уремический синдром | Да | —
Pseudomonas aeruginosa / | Экзотоксин А | ADФ-рибозилтрансфераза | Фактор элонгации-2 | Пневмонияe | (Да) | ~3 мкг (м)
Активация путей вторичных мессенджеров
E. coli: Цитотоксический никротизирующий фактор | Деамидаза | Rho-G-белок | Инфекция уринарного тракта |? | —
Термолабильный токсин | АДФ-рибозилтранс-фераза | G-белки | Диарея | Да | —
Температурно стабильный токсинd | Стимуляция гуанилатциклазы | Гуанилатциклазный рецептор | Тоже | Да | —
Цитолетальный растягивающий токсинd | Блокирование G2 | Неизвестна | Тоже | (Да) | —
EAST | Стимуляция гуанилатциклазы? | Неизвестна | Тоже |? | —
Bacillus anthracis / Отечный фактор | Аденилатциклаза | АТФ | Сибирская язва | Да | —
Bordetella pertussis / Коклюшный токсин | АДФ-рибозилтрансфераза | G-белки | Коклюш | Да | 21 мкг (м)
Дермонекротический токсин | Деамидаза | Rho G-белки | Риниты | (Да) | —
Clostridium botulinum / C2-токсин | АДФ-рибозилтрансфераза | Мономерный G-актин | Ботулизм |? | —
C.botulinim / C3 токсин | Тоже | RhoG-белок | Ботулизм |? | —
Clostridium difficile / | Токсин А | Гликозилтрансфераза | RhoG-белок (и) | Диарея / PC | (Да) | —
Токсин В | Тоже | Тоже | Тоже |? | —
Vibrio cholerae / Холерный токсин | АДФ-рибозилтрансфераза | G-белок (и) | Холера | Да | ~250 мкг (м)
Активаторы иммунного ответа
S.aureus/ Энтеротоксины | Суперантиген | TCR и MHC II | Пищевое отравлениес | Да | 20…50 мкг (о)
Эксфолиативный токсин | Суперантиген (и сериновая протеаза?) | То же | Синдром шелушения кожи | Да | —
S.pyogenes/ Пирогенный экзотоксин | Тоже | То же | Скарлатина / синдром токсического шокаc | Да | 3…6 мг (м)
Токсин синдрома токсического шока | Суперантиген | То же | Синдром токсического шокаc | Да | —
Протеазы
B.anthracis / Летальный фактор | Металлопротеаза | MAPKK1/MAPKK2 | Сибирская язва | Да | <114 мкг (м)
C.botulinum / Нейротоксины А-С | Цинк-металлопротеазы | VAMP /синаптобревин, SNAP-25, синтаксин | Ботулизм | Да | 0.5…1.2 нг (м) |
Clostridium tetani / Столбнячный токсин | Тоже | VAMP / синаптобревин | Столбняк | Да | ~1 нг (м)
СОКРАЩЕНИЯ:
EAST — энтероаггрегативный температуростабильный токсин E.coli; TCR — рецептор Т-клеток;
МНС II — главный комплекс гистосовместимости, класс 2;
МАРКК — митоген активированная протеин киназа киназа;
VAMP — везикуло-ассоциированный мембранный белок;
SNAP-25 — синаптосомал-ассоциированный белок;
PC — антибиотикоассоциированные псевдомембранозные колиты;
Да — строго доказанная связь между токсином и болезнью; (Да) — роль в патогенезе была показана на животных моделях или клеточных культурах;? — неизвестно; с — другие болезни также ассоциированы с этим организмом; d — токсин также продуцируется другими семействами бактерий; (м) — мышь; (к) — кролик; (ч) — человек; (о) — обезьяны.
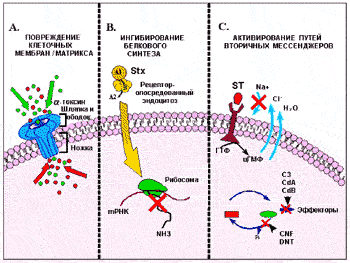
Рис. 17. Механизм действия бактериальных токсинов. А. Повреждение клеточных мембран альфа-токсином S. aureus. После связывания и олигомеризации, ножка похожего на шампиньон гептамера альфа-токсина вставляется в клетку-мишень и вызывает приток, или наоборот, отток из клетки ионов (обозначены как темные и светлые кружки, соответственно). В. Ингибирование белкового синтеза клетки шига-токсином (Stx). Голотоксин, который состоит из энзиматически активной субъединицы (А) и пяти связывающих субъединиц (В), входит в клетку через глоботриазилцерамидный рецептор (Gb3). Затем А-субъединица, обладающая N-гликозидной активностью, отсекает аденозиновый остаток с 28S рвбосомальной РНК, что останавливает белковый синтез. С. Примеры бактериальных токсинов, активирующих пути вторичных мессенджеров. Связывание температурно-стабильного энтеротоксина (ST) с рецептором гуанилатциклазы приводит к увеличению количества ГМФ (цГМФ), который обращает в обратную сторону ток электролитов. Посредством АДФ-рибозилирования или гликозилирования (соответственно), экзоэнзим С3 C. botulinum и токсины A (CdA) и В (CdB) C. difficile, инактивируют небольшие Rho ГТФ-связывающие белки. Цитотоксический некротизирующий фактор (CNF) E. coli и дермонекротический токсин (DNT) рода Bordetella, активируют Rho через дезаминирование [Smitt С. et al., 1999]. Механизм их действия, а также протеолитических токсинов и активаторов иммунного ответа, приведен в тексте
Порообразующие токсины. К ним относят бактериальные токсины, функционирующие посредством вставки в плазматическую мембрану хозяина и формирующие в ней трансмембранные поры, приводящие клетку к лизису. Такие токсины еще называют RTX-семейством из-за наличия в их молекулах большого количества повторов [Finlay В., Falkow S., 1997]. Механизм их действия хорошо прослеживается на примере альфа-токсина S.aureus, рассматриваемого как прототип олигомеризующегося пороформирующегося цитотоксина [Smitt C.K et al., 1999]. Альфа-токсин синтезируется как прекурсорная молекула из 319 аминокислот, содержащая N-терминальную последовательность из 26 аминокислот. Секретируемый бактерией «зрелый» токсин (протомер), является гидрофильной молекулой с массой 33 кд, утратившей цистеиновые остатки [Bhakdi S., Tranum-Jensen J., 1991]. Протомер «узнает» клетку-мишень по высокоаффинным рецепторам или не специфически сорбируется в участках плазматической мембраны, содержащих фосфатидилхолин или холестерин. На мембране семь протомерных токсинов собираются в пору, формируя грибоподобный гептамер (232 кд), включающий три различных домена [Song L. et al., 1996]. Шляпка и ободочная область гептамера альфа-токсина располагаются на поверхности плазматической мембраны, в то время как ножка служит трансмембранным каналом. Образовавшаяся пора позволяет маленьким молекулам и ионам двухстороннее движение, что, в конечном итоге, приводит клетку к вздутию и гибели от осмотического шока [Smitt С. et al., 1999].
Альфа-токсин является цитолитическим в отношении различных типов клеток. У человека он способен лизировать моноциты, клетки, но точная его роль в стафилококковом заболевании людей, неизвестна [Bhakdi S. et al., 1996].
К другим членам RTX-семейства относят гемолизин E.coli (HlyA), аденилатциклазу В. pertussis, лейкотоксин Pasterella haemolitica. Это семейство токсинов является также частью консервативного механизма секреции I типа, который отвечает за их транспорт из бактериальной клетки [Finlay В., Falkow S., 1997]. Образование поры включает целый каскад вторичных реакций, приводящих к другим патологическим последствиям. Среди них активация эндонуклеаз, высвобождение цитокинов и медиаторов вое паления, синтез эйкозаноидов [Bhakdi S. et al., 1996].
Токсины, ингибирующие синтез белка. Субстратами для этих токсинов служат факторы элонгации и рибосомальная РНК [Езепчук Ю.В., 1985]. Дифтерийный токсин и экзотоксин А псевдомонад являются дифтамид специфическими АДФ-рибозилтрансферазами, которые рибозилируют фактор элонгации 2 и, таким образом, инактивируя его, подавляют синтез белка в клетках. Шига-токсин (Stx-токсин), так же называемый веротоксином, продуцируется S. disenteriae первого серотипа и недавно появившимися Stx-продуцирующими штаммами E. coli (STEC) [Вертиев Ю.И., 1996]. Рассмотрим на его примере механизм действия таких токсинов.
Stx-токсины имеют типичную АВ структуру. Энзиматически активная А-субъединица (35 кд) нековалентно связана с В-субъединицей (7,5 кд). Голотоксин содержит 5 В-субъединиц. В-субъединичный пентамер связывает голотоксин с эукариотической клеткой через специфические гликолипидные рецепторы. После интернализации, полипептид А расщепляется на энзиматическую часть (А1) и фрагмент А2, остающиеся связанными через дисульфидный мостик. А2-фрагмент связывает A1 с В-пентамером [Smitt С. et al., 1999]. A1 проявляет N-гликозидазную активность и расщепляет N-гликозидную связь у аденина в положении 4324 на 28S рибосомальной РНК. В результате происходит отщепление 400 нуклеотидов с 3-конца рРНК, что служит препятствием для присоединения аминоацил-тРНК, синтез белка прекращается и клетка гибнет [Вертиев Ю.И., 1996].
Токсины, генерирующие образование вторичных мессенджеров (посредников). Бактериальные токсины могут влиять на функцию; отдельных белков эукариотической клетки, не приводя ее к гибели. Для этого они активируют так называемых вторичных посредников, которые способны в большой степени усиливать и искажать клеточную реакцию на внеклеточные сигналы [Smitt С. et al., 1999]. Рассмотрим механизм действия таких токсинов на примере цитотоксического некротического фактора (CNF).
CNF первого и второго типов (CNF1/2) относятся к группе бактериальных, токсинов, модифицирующих Rho — субсемейство маленьких ГТФ-связывающих белков, участвующих в модификации регуляторов актина цитоскелета [Aktories К., 1997]. Ген CNF1 у E. coli закодирован на хромосоме и располагается на «острове патогенности» [Blum G. et al., 1995]. Токсин синтезируется как гидрфильный полипептид (115 кд). Он остается цитоплазматическим из-за отсутствия сигнальной последовательности и имеет связывающий (N-терминальная половина CNF1) и ферментативный (С-терминальная половина CNF1) домены [Lemichez E. et al., 1997]. Видимо в клетки хозяина он попадает с помощью секреторного механизма III типа. Недавно было показано, что CNF1 деаминирует глутаминовый остаток Rho в положении 64. Такая модификация приводит к преобладанию активности Rho, неспособного гидролизовать связанный с ним ГТФ. Эукариотические клетки, подвергнутые воздействию CNF1, приобретают характерный вид. У них наблюдается «рифление» мембраны, формируется локальное сжатие актиновых нитей. Репликация ДНК при отсутствии клеточного деления, приводит к образованию многоядерных клеток. Внутрикожное введение CNF1 вызывает длительное воспаление и образование некротического очага [Smitt С. et al., 1999].
Установлена критическая роль небольших ГТФ-связывающих белков не только в регуляции цитоскелета (семейство белков Rho), но и в везикулярном транспорте (семейство Rab), и в регуляции роста и дифференциации клеток (семейство Ras). Поэтому не исключено, что существуют пока еще неизвестные нам токсины, способные воздействовать на основные клеточные процессы через эти белки [Finlay В., Falkow S., 1997].
Протеолитические токсины. Ботулинический и столбнячный (оба цинк-металлоэндопротеазы), в опытах на животных обнаруживают наименьшую из известных LD50. Удивительно, насколько различную клиническую картину дают поражения этими токсинами, имеющими столь значительное сходство в структуре, энзиматической активности и мишенях среди клеток нервной системы, но при различающиеся путями проникновения в макроорганизм. Например, ботулинический токсин проникает в организм энтерально и вызывает вялые параличи периферических нервов. Столбнячный же токсин, образуясь на поверхностях ран, колонизированных C. tetani, приводит к спастическим параличам через поражение ЦНС [Finlay В., Falkow S., 1997].
Эти самые токсичные токсины имеют и наиболее сложную молекулу. Оба синтезируются в виде неактивных полипептидов массой 150 Кд и высвобождаются из лизировавшихся клеток. Затем они активируются посредством протеолитического расщепления открытой петли в структуре своей молекулы. Каждая активная молекула нейротоксина включает тяжелую (100 кд) и легкую (50 кд) цепи, связанные посредством межцепочечной дисульфидной связи. Тяжелые цепи обоих токсинов содержат два домена — регион, необходимый для транслокации токсина (N-терминальная последовательность) и регион, необходимый для связывания с клеткой (С-терминальная последовательность). Легкие цепи обоих токсинов содержат цинк-связывающий мотив, необходимый для цинк-зависимой протеазы, активирующей молекулу [Schiavo G., Montecucco С, 1997].
Ботулинические токсины связываются с рецепторами на поверхности пресинаптической мембраны двигательных нейронов периферической нервной системы и вызывают протеолиз белков в нейронах. Это приводит к ингибированию высвобождения ацетилхолина и к предотвращению мышечных сокращений — возникает вялый паралич [Halpern J., Neale E., 1995]. Столбнячный токсин сначала связывается с рецепторами на пресинаптической мембране моторных нейронов, но затем, с помощью ретроградного везикулярного транспорта, он перемещается в нейроны спинного мозга. Спастический паралич возникает из-за того, что рассечение везикуло-ассоциированных белков и синаптобревина в нейронах, нарушает высвобождение глицина и гамма-амино-битуриковой кислоты, прекращающих мышечное сокращение [Arnon S., 1997].
Активаторы иммунного ответа. Отдельные бактериальные токсины могут действовать непосредственно на Т-клетки и антигенпрезентирующие клетки иммунной системы. Самое большое семейство токсинов данного типа называют токсинами-суперантигенами (PTSAg).
Как правило, иммуностимулирующий потенциал таких токсинов является следствием их способности связывать различные участки белков главного комплекса гистосовместимости II типа, экспрессированных на поверхности антигенпрезентирующих клеток и Vбета-элементы на Т-клеточном рецепторе [Smitt С. et al., 1999]. В частности, В-домен стафилококкового TSST-1, связывает альфа-цепь антигена DR1 человеческого лейкоцита, одновременно его А-домен специфически связывается с Vбета-элементами Т-клеточного рецептора [Schlievert P., 1997]. Связывание TSST-1 с Vбета2 приводит к массивной пролиферации более 20 % периферических Т-клеток. Следствием Т-клеточной экспансии является массивное высвобождение интерлейкинов (1, 2 и 6 типов), гамма-интерферона, факторов некроза опухолей (альфа и бета) и др. [Schlievert P., 1997]. Совместно эти цитокины вызывают гипотензию, высокую температуру и диффузные эритематозные высыпания [Smitt С. et al., 1999]. Токсины данного типа характерны для случайных и факультативных паразитов.
Трехсоставные токсины. К ним мы относим структуры типа A1-B-A2, где В — это субъединица, участвующая в связывании токсина с рецептором, А1 — и А2 — субъединицы, проявляющие различную энзиматическую (токсическую) активность в клетке хозяина. Наиболее изученным токсином данного типа является сибиреязвенный. Он состоит из В-субъединицы, называемой протективным антигеном (ее используют для иммунизации против B. anthracis) и двух ферментативных субъединиц (А-субъединиц), одна из которых — отечный фактор (кальмодулинзависимая аденилатциклаза), индуцирует образование вторичных мессенджеров (цАМФ); другая — летальный фактор, является металлопротеазой (см. табл. 3).
Введение чувствительным животным любой из этих субъединиц по отдельности, не приводило ни к каким патологическим последствиям. Внутрикожное введение комбинации В-субъединицы и отечного фактора, приводило к развитию кожных отеков у морских свинок и кроликов. Смесь В-субъединицы и летального фактора при внутривенном введении вызывала гибель мышей и крыс, но не давала образования отеков при внутрикожном введении. При введении смеси трех компонентов токсина, они действовали синергически в тестах проверки летальности на мышах [Бургасов П.Н., Рожков Г.И., 1984]. В более поздних исследованиях было показано: что отечный фактор вызывает только кратковременное повышение внутриклеточного уровня цАМФ, поскольку он быстро разрушается Клеточными протеазами [Motecucco С. et al., 1994]. Т. е. развитие сибиреязвенной интоксикации предполагает обязательное участие всех трех компонентов сибиреязвенного токсина.
С. Petosa и соавт. (1997), выявили тонкие механизмы этого процесса. В-субъединица (протективный антиген — ПА, РА) сибиреязвенного токсина представляет длинную плоскую молекулу, размером 100х50х30 ангстрем, состоящую из 4 доменов. Связывание ПА с рецептором клетки-мишени начинается с домена 4. Этот домен (остатки 596–735) имеет первичную шпильку и спираль, за которыми следует бета-сендвич с иммуноглобулиновой складкой. Домены 1, 2 и 3 тесно связаны между собой, но домен 4 имеет с ними ограниченный контакт. Внутри иммуноглобулиновой складки домена 4 содержится доступная петля из 19 аминокислотных остатков, аналогичная антигенсвязывающей CDRS-петле антител и рецепторсвязывающей петле дифтерийного токсина. Протеолитическая активация происходит на клеточной поверхности. Протеаза фурин (она же используется для протеолитическои активации дифтерийного токсина, экзотоксина А псевдомонад и некоторых вирусов) расщепляет поверхностную петлю внутри домена 1. В результате высвобождается N-терминальный 20 кд фрагмент (ПА20). Этот фрагмент не играет какой-либо дополнительной роли в интоксикации. Однако его удаление приводит к образованию большой гидрофобной поверхности на оставшемся фрагменте ПА (ПАб3). Остальная часть домена 1, называемого теперь домен 1', образует N-окончание активного ПАб3. После утраты ПА20. ПАб3 формирует гептамер, который вставляется в мембраны при кислых значениях рН, формируя катионселективные каналы как в искусственных липидных бислоях, так и в клетках. Новая гидрофобная поверхность домена 1' полностью обнажается, формируя часть большого, плоского гидрофобного пятна на «вершине» гептамера. Эта поверхность обеспечивает открытый сайт для связывания фактора отека и летального фактора, которые теперь связывают ПАб3 с высоким аффинитетом (рис. 18).
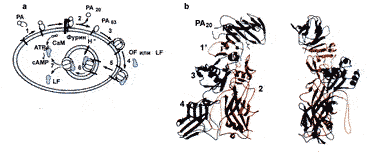
Рис. 18. Стадии сибиреязвенной интоксикации. a.1 — РА связывается с рецептором клетки хозяина; 2 — фурин расщепляет и высвобождает ПА20; 3 — ПАб3 формирует гептамер; 4 — токсические ферменты связываются с ПАбз; 5 — опосредованный рецептором эндоцитоз; 6 — подкисление эндосомы приводит к мембранной вставке ПАб3; 7 — транслокация токсических ферментов в цитозоль. LF — летальный фактор; EF — фактор отека. b. Ортогональные проекции РА, окрашенного по доменам. Домен 1 включает РА плюс домен 1' и два иона Са2+. ПА20 отщепляясь, больше не играет роли в процессе интоксикации. Образовавшаяся гидрофобная поверхность домена 1' формирует участок связывания для LF и EF [Petosaet al., 1997]
Т.е. трехкомпонентные токсины используют общую В-субъединицу, обеспечивающую ферментативным субъединицам единый механизм проникновения в цитозоль. Видимо это необходимо для проявления синергидного эффекта токсического действия ферментативных субъединиц.
Происхождение токсинов. С момента открытия Roux и Yersin в 1888 г. дифтерийного токсина, этот вопрос вызывает много споров. В последние годы появилась возможность проведения тонких молекулярных сравнений между структурами отдельных токсинов. Результаты этих сравнений оказались неожиданными для ученых [Finlay В., Falkow S., 1997]. Токсины микроорганизмов из отдаленных семейств и даже родов, занимающих различные экологические ниши и вызывающие совершенно не похожие инфекционные болезни, оказались весьма сходными по механизму действия и по критическим для проявления токсичности структурам (например, шигатоксин, коклюшный и холерный токсины). Было обнаружено сходство между токсинами и ферментами эукариотических клеток (например, отечный фактор B. anthracis и аденилатциклаза человека). По этим данным создается впечатление не только широкого эволюционного родства токсинов между собой. Но, как заметил Ю. Вертиев (1996), у некоторых исследователей даже возникает мысль, что токсины возникли путем захвата из эукариотической клетки генетического материала, кодирующего токсин. Накопление экспериментального материала по тонкой структуре и механизму действия токсинов создало условия для выдвижения интересных гипотез об их происхождении. Но, видимо, трудно рассчитывать на то, что этот вопрос будет однозначно решен для каждого бактериального токсина в рамках какой-то общей гипотезы.
По нашему мнению, очень серьезное влияние на его решение в будущем окажут экспериментальные данные по участию токсинов в функциях микробной клетки, которые не имеют прямого отношения к проявлению бактерией патогенных свойств, но используют консервативные механизмы, сходные как в эукариотических, так и прокариотических организмах.
На этот аспект проблемы ранее обратил внимание Ю. Вертиев (1996). Он считает, что бактериальные токсины, интерфероны, бактериоцины и гормоны обнаруживают сходство в отношении целого ряда важных свойств. Эти вещества синтезируются одним типом клеток, в то время как воздействуют на другие типы клеток: они действуют на клетки в чрезвычайно низкой концентрации (Ю-11–10-14 М); обладают сходной молекулярной организацией состоят как минимум из двух функционально и структурно различных белков: энзиматического и рецепторного; имеют сходные звенья молекулярного механизма действия (связывание с рецепторами, активация, транслокация внутрь клетки и модификация клеточных мишеней); обладают сходной кинетикой биологического эффекта — одноударный эффект; и, наконец, все эти вещества токсичны.
Мы еще только начинаем понимать первичную функцию биологических токсинов в природе. Если предположить, что способность бактерией синтезировать токсины закрепляло какую-то неизвестную сегодня сигнальную функцию в образуемом ими биоценозе, то понятен и двухкомпонентный состав, и одноударность их действия. Преимущество такой структуры для передачи сигналов в том, что при ее распространении из центра, сигнал не ослабляется на большом расстоянии. Если бы передача сигнала осуществлялась структурами, не способными к лиганд-специфическому взаимодействию, то сигнал ослабевал бы по мере диффузии сигнальных молекул. Отсюда, как следствие, способность воздействовать на другие типы клеток в чрезвычайно низких концентрациях.
Сопоставляя структурные особенности молекул различных бактериальных токсинов с механизмами их функционирования, нельзя не заметить, что сходство между ними обусловлено сходно направленным действием естественного отбора.
Так, способность В-субъединиц к узнаванию клетки-мишени, сопровождается закреплением за ними и других свойств. Например, кроме взаимодействия с рецептором, В-субъединица экранирует ферментативную субъединицу, предотвращая ее взаимодействие с субстратом, как в собственной клетке, так и за пределами клетки-мишени [Вертиев Ю.В., 1996]. Она служит и своего рода предохранителем, предотвращающим «случайный выстрел». Для активации токсической субъединицы необходимо протеолитическое расщепление В-субъединицы после ее взаимодействия с клеткой, мишенью. Это исключает действие токсической субъединицы на другие клетки [см., например, действие сибиреязвенного токсина). И, как мы убедились на примере протективного антигена, она способна «вводить» клетку несколько токсических ферментов, действующих синергидно. Плейротропность функций В-субъединиц находится в соответствии с «принципом экономии генов».
Механизм лиганд-рецепторного взаимодействия исключает бесконечное разнообразие структур В-субъединиц, взаимодействующих с лигандом. В основе этого явления лежит то обстоятельство, что токсины в организме хозяина используют уже готовые структуры, участвующие в эндокринной, паракринной и синаптическои сигнализации, а, следовательно, жестко поддерживаемых естественным отбором. То, что эти структуры не являются абсолютно консервативными, свидетельствуют внутривидовые различия в чувствительности к отдельным токсинам, но их консервативности хватает на выход аналогий в структуре рецепторсвязывающих участков, за пределы В-субъединиц токсинов. Например, иммуноглобулин-подобная складка домена 4 протективного антигена аналогична не только рецепторсвязывающей петле дифтерийного токсина, но и антигенсвязывающей CDR3 петле антител [Petosa et al., 1997].
Формирование белкового канала (поры) также не является уникальным свойством токсинов. Посредством поры осуществляется транспорт специфических ионов через мембраны эукариотических и прокариотических организмов (пориновые белки грамотрицательных бактерий). К образованию пор способны не только токсины бактерий, но и зоотоксины [Орлов Б.Н., Гелашвили Д.Б., 1985] и даже белки слияния вирусов [Филдс Б., Найп Д., 1989]. Сама же пора формируется в определенной цитоплазматической мембране и предназначена для определенной функции, т. е. она не может не быть консервативной. Это предопределяет консервативность выполняющих одну функцию доменов образующих пору белков (рис. 19). Большая петля домена 2 ПА B. anthracis (ответственна за вставку гептамера в цитоплазматическую мембрану), демонстрирует консервативный характер чередующихся гидрофильных и гидрофобных остатков, аналогичный таковому у поринов бактерии Rhodopseudomonas blastica, а также, у выполняющих ту же функцию структур токсина VIP1 инсектицидного белка Bacillus thuringiensis [Petosa et al., 1997] и йота-b-токсина Clostridium perfringens [Perelle S. et al., 1993]. Аминокислотная последовательность связывающего клетку домена CNF1 уропатогенной E. coli, имеет обширную гомологию с аналогичной последовательностью митогенного токсина Pasteurella multicoda — бактерии, вызывающей атрофический ринит у свиней [Falbo V. et al., 1993].
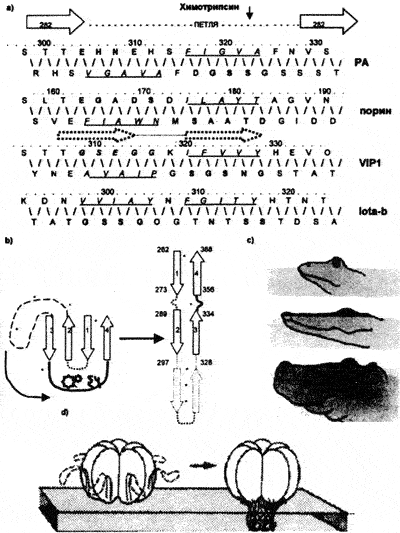
Рис. 19. Конвергентное сходство каналообразующих структур токсинов-гомологов ПА и пориновых белков бактерий. а) консервативные чередующиеся гидрофильные (подчеркнуты) и гидрофобные (выделены полужирным) остатки большой петли домена 2 ПА аналогичны таковым у поринов и токсинов-гомологов, что предполагает одинаковый и наиболее оптимальный характер формирования перекрывающих мембрану шпилек (b) и мембранной вставки (d); с) аналогичное явление в природе — положение глаз у таких полуводных животных в высшей степени сходно: оно оптимально для наблюдения под водой при погружении в воду тела. На основе рисунков Б.М. Медникова (1975) и Petosa et al. 1997)
Неожиданное сходство было найдено и на макромолекулярном уровне, т. е., между В-олигомерами. Оказалось, что хотя холерный и температуролабильный токсины имеют по 5 идентичных В-субъединиц, а коклюшный токсин имеет 4, но различные В-субъединицы, 2 субъединицы коклюшного токсина обладают складчатыми структурами, сходными с таковыми у В-субъединиц холерного токсина и шига-токсина [Finlay В., Falkow S., 1997].
Такая же ситуация сходства и между ферментативными субъединицами токсинов. Отечный фактор сибиреязвенного микроба представляет собой аденилатциклазу, которая не только по кинетическим, но и по антигенным свойствам имеет сходство с действующей на ту же мишень кальмодулинзависимой аденилатциклазой эукариотических клеток [Petosa et al., 1997]. По крайней мере 5 АДФ-рибозилирующих токсинов (коклюшный, холерный и дифтерийный токсины, температуролабильный токсин кишечной палочки и экзотоксин А псевдомонад) имеют общий НАД-связывающий сайт [Finlay В., Falkow S., 1997]. Участок протяженностью в 100 аминокислот ферментативного домена CNF1, гомологичен участку ферментативного домена дермонекротического токсина бордетелл. Оба одинаковых участка выполняют одинаковую функцию — активируют Rho и являются активными сайтами токсинов [Lemichez E. et al., 1997]. Таким образом, нельзя объяснить только генетическим обменом и «общностью происхождения» сходство структур токсинов микроорганизмов различных видов, семейств и родов, к тому же занимающих разные экологические ниши и вызывающих различную инфекционную патологию. В эволюции возможно повторное возникновение отдельных признаков, вызванное сходно направленным действием естественного отбора (эволюционная конвергенция), но невозможно возникновение не родственных форм, одинаковых по всей своей организации — правило необратимой эволюции [Медников Б.М., 1975]. По этой причине нельзя рассматривать, эволюцию токсинов отдельно от эволюции синтезирующих их микроорганизмов. Конвергентное сходство по одному признаку, например, по способности В-субъединицы токсина образовывать поры, не затрагивает большинства других черт организации бактерии. Как бегемот остается типичным млекопитающим, а крокодил — рептилией при сходном положении глаз, так и кишечная палочка не становится бордетеллой или псевдомонадой из-за наличия гомологичных последовательностей в структурах их токсинов, выполняющих одинаковую функцию (см. рис. 19).
Однако при изменении направления отбора в разных условиях происходит дивергенция (расхождение) сначала структуры, а потом и биологических свойств токсинов. Так, Stx-цитотоксины могут быть разделены на две антигенно различные группы, имеющие от 50 % до 60 % гомологии: Stx/ Stx1 и Stx2 [Tesh V., O'Brien A., 1991]. Stx и Stxl различаются только одной аминокислотной последовательностью и встречаются преимущественно в S. disenteriae. Stx2-цитотоксин обнаружен недавно у кишечных палочек, т. е. его образование может быть результатом действия длительной изоляции в другой экологической нише. Любопытны и оцениваемые сроки такой дивергенции. Анализ молчащих замещений нуклеотидных последовательностей генов холерного, LT- и ST-токсинов показал, что эти гены дивергировали не менее чем 130 млн. лет назад [Вертиев Ю.В.,1996]. Т. е. в эпоху расцвета пресмыкающихся и уже в знакомом нам виде они пережили не только их вымирание, но и расцвет млекопитающих в миоцене, и их массовое вымирание и юнце плиоцена. Если это так, то тогда появление прототипного холерного токсина теряется где-то в глубине геологического времени. С антропоцентрической точки зрения, какая-то есть в этом нецелесообразность. Мы явно переоцениваем свое значение в природе, когда утверждаем, что человек является единственным хозяином холерного вибриона.
Образование молекул токсинов. Использование методов точечного мутагенеза для модификации структуры бактериальных токсинов, выявило удивительно точную «пригнанность» их структур к выполняемой ими функции. Оказалось, что они построены настолько точно, что даже замена одной аминокислоты может привести к катастрофическим изменениям функции. Так одиночные замены в S1-субъединице коклюшного токсина снижают ее ферментативную активность и токсичность в 1000 раз, множественные — в 106 раз. Одновременно резко снижается ее иммуногенность [Loosmore S. et al., 1990], нарушается пространственная структура и способность взаимодействовать с олигомером [Lobet Y. et al., 1989].
Как мы убедились на примере порообразующих доменов, сходность функциональных структур токсинов между собой и с отдельными ферментами клеток хозяина обусловлена тем, что различные белки с родственными функциями имеют схожую последовательность аминокислот. Полагают, что такие семейства белков возникли путем дупликации одного предкового гена и последующего накопления в процессе эволюции мутаций, постепенно обусловивших появление родственных белков с новыми функциями [Альберте Б. с соав., 1994]. Наличие А и В субъединиц (доменов) в структурах молекул подавляющего большинства белковых токсинов, свидетельствует о том, что они, как правило, являются крупными функциональными белковыми агрегатами. Образование таких агрегатов стало возможным путем объединения двух или более белков в результате как нековалентных взаимодействий (сибиреязвенный, коклюшный и другие токсины), так и путем образования ковалентной связи между ними (ботулинический и столбнячный токсины). В свою очередь отдельные субъединицы токсинов так же состоят из некогда различных белков, объединенных в пептид, проявляющий несколько активностей сразу. Например, тяжелые цепи ботулинического и столбнячного токсина содержат два домена — регион, необходимый для транслокации токсина и регион, необходимый для взывания с клеткой. Белки такого типа образуются слиянием соответствующих генов в один ген, кодирующий большую полипептидную цепь. Для всех токсинов характерна «мультидоменная» структура. Это означает, что разные их части состоят из некогда отдельных глобулярных белков, объединенных естественным отбором ходе эволюции (рис. 20).

Рис. 20. «Мультидоменная» структура бактериальных токсинов. А. Общий принцип, по которому наложение двух различных белковых поверхностей в процессе эволюции приводит к появлению белков, содержащих новые центры связывания для других молекул — лигандсвязывающие центры часто располагаются в месте соприкосновения двух белковых доменов [Альберте Б. с соавт., 1994]. Б. Пространственные ленточные модели кристаллов шига-токсина S. dysenteriae [Frasier M. et al., 1994], температуро-лабильного токсина кишечной палочки [Sixma Т. et al., 1993] и коклюшного токсина [Stein P. et al., 1994]. Несмотря на выраженное конформационное сходство, каждый из этих белков имеет собственную эволюционную историю. Наличие большого количества доменов, независимо свертывающихся в разных частях молекул, свидетельствует о происхождении этих токсинов путем объединения генов различных глобулярных белков
Если, не ввязываясь в спор о том, что прогрессивно в эволюции, что нет, подойти к эволюции токсинов только исходя из сложности их молекул, то можно построить своего рода эволюционную «лестницу». На ее нижнюю ступеньку, видимо, можно поместить порообразующие токсины, типа альфа-токсина стафилококка. Они способны лигандрецепторному узнаванию и образуют поры, через которые могут быть введены ферментативные молекулы, однако такие молекулы появляются уже на следующей эволюционной ступеньке. Ее занимают двухкомпонентные токсины, А- и В-субъединицы которых взаимодействуют без образования ковалентной связи, т. е. либо клетка еще не способна образовывать дисульфидные связи между субъединицами, либо еще не произошло слияния их генов. Последней ступенькой можно считать крупномолекулярные токсины, состоящие из тяжелых и легких цепей, объединенных ковалентными связями. Такие токсины имеют максимально возможную для белков молекулярную массу и, видимо, токсичность (супертоксины — ботулинический и столбнячный). Трехсоставные токсины типа сибиреязвенного и двухсоставные, объединенные ковалентной связью, занимают промежуточную ступеньку между крупномолекулярными супертоксинами, а так же двухсоставными, компоненты которых взаимодействуют без образования ковалентных связей. Видимо оба типа токсинов являются альтернативами эффективных структур, выбор между которыми в конкретных обстоятельствах остается за естественным отбором.
Максимально возможная токсичность. Такая постановка вопроса не имеет смысла при исследовании патогенности бактерий, так как токсины — это только часть механизма их паразитирования, устроенного невероятно сложно и имеющего много альтернативных, взаимодополняющих элементов. Однако ответ на него чрезвычайно интересует зарубежных военных токсикологов, рассматривающих токсины как опасное средства поражения.
Незнание условий, которые в процессе эволюции способствовали естественному отбору биологических токсинов, привело к формированию у таких исследователей представления о возможности снижения летальных доз биологических токсинов с помощью методов генной инженерии и породило множество спекуляций на эту тему [Tucker J.B., 1985; Гайслер Э., 1986].
Выше мы уже приводили примеры последствий вмешательства в структуру токсина. Н.С. Антонов (1994), используя элементарные приемы математической статистики, установил любопытную закономерность (рис. 21). Если на эвклидовой поверхности в логарифмических координатах «LD50 — молекулярная масса» отобразить весь массив веществ, для которых летальные дозы экспериментально установлены, то плоскость графика оказывается разделенной на две части: на одной из них сосредоточены отображения всех взятых веществ, в то время как другая часть плоскости графика остается свободной, ибо в природе не существует веществ, которые по величине летальной дозы и молекулярной массы соответствовали бы той части плоскости графика. Между указанными частями плоскости графика отчетливо прослеживается граница (токсоида), формируемая отображениями наиболее токсичных веществ в соответствующих интервалах изменения величины молекулярной массы. Наиболее токсичному веществу — ботулиническому токсину, соответствует и наибольшая молекулярная масса.
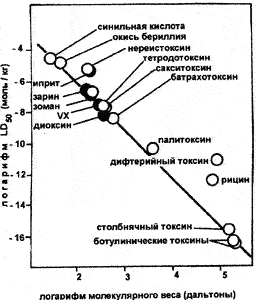
Рис. 21. График токсоиды по Н.С. Антонову. Максимальная токсичность супертоксинов достигается за счет предельного увеличения размеров и сложности их молекул
Эффект возрастания биологической активности по мере увеличения молекулярной массы отмечался ранее Н.И. Кобозевым у алкалоидов, гликозидов, гормонов, витаминов и синтетических лекарственных веществ. Им было показано, что путем вариации состава и строения молекул можно добиться некоторого увеличения активности веществ. Но если требуется добиться увеличения активности в десятки и более раз, од<










