| Морфологи-ческие и биологичес-кие признаки
| E.
coli
| Citrobac-ter
| Kleb-siella
| Entrobacter
| Proteus
| Sal-mo-nella
|
| E. cloa-sae
| E. aere-ge-nes
| E. lique faci-lus
| P.vul-garis
| P. mira-bilis
|
| Подвижность
| + или -
| + реже-
| -
| +
| +
| +
| +
| +
| + реже -
|
| Глюкоза
| +
| +
| +
| +
| +
| +
| +
| +
| + кг (си-няя)
|
| Лактоза
| + или -
| + или -
| +
| +
| +
| (+)
| -
| -
| - (сл. розо-вая)
|
| Сахароза
| + или -
| + или -
| -
| +
| +
| +
| +
| + или -
| - (сл. розо-вая)
|
| Маннит
| +
| +
| +
| +
| +
| +
| -
| -
| + кг (си-няя)
|
| Дульцит
| + или -
| + или -
| + или -
| -
| -
| -
| -
| -
| + или -
|
| Адонит
| -
| -
| +
| +или-
| +
| -
| -
| -
| -
|
| Инозит
| -
| + или -
| +
| -
| +
| (+)
| -
| -
| + или -
|
| Индол
| + реже-
| + или -
| -
| -
| -
| -
| +
| -
| -
|
| Сероводород
| + реже-
| + или -
| -
| -
| -
| -
| +
| +
| + реже-
|
| Реакция с метилротом
| +
| +
| -
| -
| -
| + или -
| +
| +
| +
|
| Реакция Фогес-Проскауэра
| -
| -
| +
| +
| +
| + или -
| -
| + или -
| -
|
| Усвоение цитратных и аммонийных солей
| -
| +
| +
| +
| +
| +
| + или -
| + или -
| +
|
| Разложение мочевины
| -
| + или -
| (+)
| -
| -
| -
| +
| +
| -
|
| Разжижение желатины
| -
| -
| -
| (+)
| + или -
| +
| +
| +
| + или -
|
| Мальтоза
| +
|
|
|
|
|
|
|
|
|
E. coli чаще изолируют из паренхиматозных органов (печень, легкие, почки), костного мозга, кишечника, желчного пузыря, крови, яичных фолликул и т.д. отобранных не позднее 6 часов после гибели уток. При отсутствии возможности быстрой доставки отдельных органов или их частей материалы консервируют, помещая в стерильный раствор глицерина или 10% раствор хлористого натрия.
Патологический материал отбирают не ранее, чем через 5 суток после обработки птицы антибиотиками или другими антибактериальными препаратами.
Выделение и идентификацию кишечной палочки проводят в следующем порядке:
1. Посев материала на жидкие (МПБ, ТСБ, ТГС) и плотные - МПА, Эндо или Левина среды, а также среды обогащения.
Из плотных сред чаще используют агар Эндо, агар Плоскирева, агар виспут-сульфитный, агар с эозинметиловым синим. Содержимое кишечника или фецес разводят 1:100 и вносят в селективно-дифференциальные среды – среды Эндо, Плоскирева и эозин-метиловый синий.
Отмечено, что кровь более пригодна для высева E. coli только при висцеральном колибактериозе с первых часов болезни. При септической форме концентрация бактерий может достигать 100 клеток в 1 мл крови.
Посевы выращивают при 37°C в течение 18-20 часов (на висмут-сульфитном агаре – 48 часов).
На МПБ рост E. coli вызывает равномерное помутнение с образованием рыхлого осадка. Типичные колонии эшерихий на плотной среде имеют округлую форму (S-форму) с выпуклой поверхностью. На среде Эндо колонии гладкие, с ровными краями, малинового цвета, на среде Левина – черного или фиолетового цвета.
2. Выделение чистых культур E.coli, изучение морфологических и тинкториальных свойств.
Две типичные S-формы колоний пересевают в МПБ, откуда через 4-6 часов бактерии переносят:
· в среды Гисса для изучения биохимических свойств и определения родовой принадлежности микроорганизма;
· 0,2-0,3% полужидкий МПА для выявления подвижности и дифференциальные среды;
3. Определение патогенности E. coli.
Готовят взвеси бактерий на ЗФР рН 7,2-7,6 для заражения белых мышей, морских свинок, утят восприимчивого возраста (1-3 и 40-50 суток), в аллантоисную полость утиных и куриных эмбрионов 11-13-суточной инкубации. Гибель подопытных животных и эмбрионов происходит на 2-5 сутки.
4. Идентификация Е. coli.
Получение бактериальных клеточных культур для реакции агглютинации (РА) с целью обнаружения К-, L-, B-антигенов проводят кипячением эшерихий при температуре 100°С в течение 60 минут, тогда как А-антиген - путём автоклавирования при 100 кПа (1 атм.) в течение 2 часов.
Методы постановки РА с поли- и моновалентными сыворотками, а также учет результатов описаны в соответствующих наставлениях.
Энтеропатогенные E. сoli серогрупп О111 содержат десять фаготипов, серогрупп О55 - восемь. Фаготип культуры бактерий не меняется при хранении. Существуют наборы, при помощи которых проводят фаготипирование изолятов.
Колибактериоз необходимо дифференцировать от сальмонеллеза, пастереллеза, вирусного гепатита утят, гриппа, коронавирусной болезни, парвовирусного энтерита мускусных уток и гусей, чумы, астровирусной инфекции и хламидиоза.
Иммунитет. При колибактериозе иммунитет у уток непродолжительный и ненапряженный.
Секреторные иммуноглобулины(Ig), подобные IgG, вместе с IgA и другими веществами предотвращают развитие и размножение E. coli на слизистой оболочке кишечника. Названные глобулины образуются после IgM на более поздней стадии инфекции или после вакцинации. IgG обладают лизирующей, нейтрализующей, агглютинирующей, преципитирующей активностью, фиксируют комплемент, а также участвуют в опсонизации. Например, низкий уровень неспецифических иммуноглобулинов в крови цыплят первых дней жизни служит одной из причин массового заболевания энтеротоксическим колибактериозом и другими желудочно-кишечными болезнями.
Лечение. После установления диагноза больную и подозреваемую птицу подвергают лечению. Рекомендуют применять синтомицин, колимицин, фурозалидон и формалин согласно разработанным схемам. Выбор лекарственного препарата проводят с учетом чувствительности к ним возбудителя. Фурозалидон, например, дают с кормом в дозе 3-5 мг на 1 кг живой массы утятам и 15-20 мг - уткам. Формалин, растворённый в воде (1:1000), обладает высокой эффективностью в дозе 0,1 мл на 1 кг живой массы 1 раз в сутки в течение 1-3 дней. Высокими лечебными свойствами обладают энтеросептол, окситетрациклин, стрептомицин, полимиксин М-сульфат и другие.
При колибактериозе активны и малотоксичны норсульфазол натрия, сульфазин натрия, сульфацил натрия, этазол натрия, сульфапиридазин натрия, сульфантрол, дисульформин, суметролим, сульфахлорпиридазин (Cosimix), тримеразин. Для превентивной терапии их назначают перорально в дозах 50-100 мг/кг на протяжении трех-пяти суток. Аэрозольно сульфамиды не применяют из-за высокой щелочной реакции. E. coli чувствительны к клиндамицину, левомицитину, ампициллину и другим антибиотикам.
При колибактериозе используют следующие лучшие сочетания препаратов: тилозин+эритромицин или хлорамфеникол, олеандомицин, тетрациклин. Затем хлорамфеникол+олеандомицин или спектимицин. Наименьший синергизм у тилозина и гентамицина.
E. coli, выделенные из проб патологического материала (желательно, крови), необходимо определить на чувствительность к наиболее широко используемым антибиотикам. Каждый вид или близкая группа бактерий обладает характерным спектром и уровнем чувствительности. Необходимо учитывать, что E. coli в результате мутации, рекомбинации или иммиграции могут даже во время инфекционного процесса приобретать измененную устойчивость к антибиотикам. В связи с этим чувствительность необходимо определять через каждые 5-7 суток. В настоящее время рекомендовано несколько методов: серийных разведений в бульоне или плотных питательных средах, «укола» или диффузии препарата в агар из бумажных дисков, а также исследование на куриных (вероятно, и на утиных) эмбрионах.
Для определения чувствительности E. coli методом серийных разведений используют МПБ с рН 7,2-7,6 с конечной концентрацией антибиотиков от 100 мкг до 1 мкг, а микроорганизмов 200 тыс. в 2 см3 бульона. Основной раствор готовят из 1000 мкг (ED) препарата в 1 см3. Необходимо учитывать, что антибиотики тетрациклинового ряда (вес указан в наставлении) предварительно разводят в 0,01 Н растворе соляной кислоты, 10 г левомицетина - в 1 см3 96° этилового спирта, тогда как стрептомицин сернокислый, полимиксин, неомицин - в ФБР рН 6,0-6,2, 10 г сульфаниламидных препаратов в 1 см3 0,1 Н раствора NaOH с последующим добавлением 49 см3 дистиллированной воды, чтобы получить конечную концентрацию 200 мкг/см3. После смешивания рабочих разведений антибиотиков и исследуемой культуры E. coli результаты учитывают через 18-24 часа при 37°С. Микроорганизм считается чувствительным, если антибиотик в концентрации до 25 мкг/см3 бульона подавляет рост культуры. Метод серийных разведений в плотной среде базируется на способности растворенного в МПА антибиотика ингибировать культуры E. coli. В лунки агара с каждой из трех концентраций антибиотика вносят по 5 капель 3-4-суточной культуры. Посевы инкубируют при 37°С до появления роста бактерий в контроле. Задержка роста в присутствии трех концентраций антибиотика определяет его высокую, среднюю и умеренную активность.
Метод «укола» основан на внесении сухого антибиотика в слой МПА или среды Хоттингера спустя 20-30 минут после нанесения на поверхности 1 см3 4-5-суточной бульонной культуры или взвеси колоний в концентрации 1 млрд/см3. Укол проводят пастеровской пипеткой, предварительно смоченной ЗФР рН 7,2-7,4. Оценку результатов проводят по диаметру зон задержки: до 10 мм – малая чувствительность, более 10 мм – чувствительная, нет зоны - бактерии устойчивые.
Исследования методом бумажных дисков проводят с применением МПА и двухмиллиардной взвеси бактерий на МПА. После нанесения бактерий на поверхность агара в чашке Петри размещают стандартные 5 дисков с интервалом более 2 см. Результаты учитывают по диаметру задержки роста: менее 15 мм – малочувствительные, 15-25 мм – чувствительные и более 25 мм – высокочувствительные.
Во ВНИВИП разработан метод определения активности препаратов на КЭ 9-11-суточной инкубации, которым вводят в разведениях антибиотики в аллантоисную полость или на ХАО. Затем через 6 часов в то же место вносят культуру E. coli.
На каждое разведение препарата (5, 10, 50, 100 мг/кг массы эмбриона) используют не менее 4 эмбрионов.
Оценку проводят через 2-3 суток. Определено, что в дозе 10мг/кг препарат высокоэффективен, 25 - достаточно эффективен, 50 мг/кг – эффективен.
Исследования, проведенные во многих странах, показывают, что большинство штаммов E. coli обладает множественной лекарственной устойчивостью, обусловленной наличием К-плазмид бактерий.
Во время лечения проводят мероприятия, направленные на укрепление резистентности организма птицы.
В России производят препарат «Ромакол», полученный методом генной инженерии в Институте молекулярной генетики РАН и ВИЭВ с использованием штамма E. coli М17 (р74). Биотехнологически производят полипептидное вещество – микроцин, ингибирующий развитие энтеробактерий (эшерихии, сальмонеллы и т.д.). Применение препарата «Ромакол» с 1994 года показало его высокую лечебную и профилактическую эффективность (4).
Изучено лечебно-профилактическое действие гипохлората натрия при колибактериозе утят. Установлено, что вещество является малотоксичным препаратом при выпаивании 600 мг/л в течение 7 суток. Препарат обладает слабой антимикробной активностью.
Профилактика и меры борьбы. Опыты, проведенные в СССР и России, показали возможность использования формол-вакцины из штамма E. coli серогруппы 02 для профилактики колибактериоза птиц. Данный препарат обладает эффективностью и при болезни, обусловленной кишечной палочкой других серогрупп - 08, 01, 0128. Профилактика колибактериоза заключается в постоянном сохранении естественной резистентности организма уток. Важными факторами для предотвращения болезни являются: полноценное кормление птицы, использование корма, свободного от патогенной E. coli; отдельное содержание возрастных групп уток; строгое соблюдение занятости помещений по принципу - "все пусто, все занято"; тщательная уборка помещений от помета и подстилки после сдачи каждой партии птицы; создание оптимальных режимов вентиляции воздуха; проведение механической очистки, мойки и дезинфекции оборудования, стен и пола, а также бактериологический контроль во время санитарных разрывов, которые должны быть не менее 14 суток. Дезинфекцию можно проводить 2-3% растворами едкого натрия, 1% раствором формальдегида, 20% взвесью свежегашеной извести при экспозиции от 2 до 3 часов, хлорамином, гипохлоридом натрия и т.д.
Важным фактором в профилактике колибактериоза является прединкубационная двукратная дезинфекция яиц и обработка инкубаторов после вывода каждой партии утят.
В неблагополучном по колибактериозу хозяйстве проводят следующие мероприятия: больных, подозрительных по заболеванию и слабых уток уничтожают и утилизируют внутри хозяйства, тогда как клинически здоровую птицу обрабатывают антибиотиками или другими бактерицидными препаратами.
При массовом заболевании молодняк и взрослое поголовье подвергают убою и утилизации на мясоперерабатывающих комбинатах с соблюдением установленных правил, исключающих распространение инфекции.
Завоз новых уток и яиц проводят из благополучных хозяйств, размещают их в заведомо подготовленные помещения.
Во ВНИВИП выпускают вакцину против колибактериоза птиц инактивированную сорбированную, а также вакцину против колибактериоза и пастереллеза птиц ассоциированную инактивированную и тоже сорбированную.
НПП «АВИВАК» производит вакцину против сальмонеллеза, колибактериоза и пастереллеза инактивированную «АВИВАК – САЛЬМО – КОЛИ – ПАСТОВАК». Вакцина изготовлена на основе поверхностных антигенов вирулентных штаммов Р.мультоцида, Салм. ентеритидис С – 5 – АТ и адгезивных антигенов токсигенных штаммов Е коли в смеси с масляным адъювантом. Биопрепарат предназначен для уток, гусей, кур и индеек.
Список литературы
Артемьева, С.А. Колибактериоз птиц / С.А. Артемьева. - Л.: Колос, 1977. - 96 с.
1. Виноходов, В.О. Колибактериоз водоплавающих. Биотехнология профилактики колибактериоза птиц / В.О. Виноходов // Архив вет. наук. - СПб, Ломоносов, 2000. - Т. 2 (49). - С. 314-320.
2. Жолобова, И.С. Эффективность применения раствора гипохлората натрия при диарейных заболеваниях птиц (колибактериоз, сальмонеллёз и микоплазмоз) / И.С. Жолобова // Тр. Куб. гос. аграр. ун-та. – 1999. – Вып. 375. – С. 157-161.
3. Промышленное изготовление лиофилизированного бактерийного препарата "Ромакол" для профилактики колибактериоза сельскохозяйственных животных и птицы / Н.И. Зенов, Н.Д. Скичко, Э.А. Шигидевич [и др.] // Пробл. инфекц. патол. с.-х. ж-ных: тез. докл. конф., посвящ. 100-летию открытия ящура. - Владимир, 1997. - С. 208-209.
4. Шагинян, И.А. Идентификация и типирование патогенных бактерий: современные подходы / И.А. Шагинян // Вестник РАМН. – М., 2000. – С. 22-28.
5. Шахов, А.Г. Системно-экологический подход к защите животных от инфекций, вызываемых условно-патогенными возбудителями / А.Г. Шахов, В.С. Бузламова // 100 лет Курской биофабрике и агробиол. пром-сти России: тез. докл. науч.-произв. конф. - Курск, 1996. - С. 348-352.
КОРОНАВИРУСНАЯ БОЛЕЗНЬ УТОК
Коронавирусная болезнь (инфекционный гепатонефрит утят, энтерогепатит утят, коронавирусный энтерит уток) – контагиозная инфекция, характеризующаяся асфиксией и параличом ног, признаками энтерита, гепатита, нефрита, воспалением железистого желудка и легких с проявлением генерализованного расстройства гемодинамики паренхиматозных органов.
Историческая справка. Болезнь зарегистрирована в феврале 1987 г. Князевым В.П. в Московской области РФ. Первые сообщения о болезни опубликованы в 1987 году Князевым В.П., Карасевой Е.М., Лагуткиным Н.А., Вишняковым И.Ф., Ерохиной Л.М. и др. Они описали болезнь и установили ее распространенность в России, Украине и Белоруссии. С 1987 по 1999 гг. болезнь зарегистрирована в большинстве крупных утководческих хозяйств стран СНГ: России – Ставропольский край (1987), Омская (1988), Московская (1989, 1991-1999), Астраханская (1991-1992), Владимирская (1991), Липецкая (1991-1992), Оренбургская (1999) области; Украине – Ивано-Франковская (1987, 1989), Черниговская (1988-1990), Черкасская (1989, 1990, 1995), Николаевская (1989), Сумская (1991, 1992), Луганская (1992) и Крымская (1992) области и Белоруссии – Брестская область (1991) (3,4, 9, 10, 12, 15).
Экономический ущерб, причиняемый болезнью, значителен. Он определяется снижением продуктивности птицы, в том числе: яйцекладки - до 40%, выводимости утят - с 87 до 50%, возрастанием неоплодотворенности яиц - с 3 до 52%, летальностью утят - до 90%, а также затратами на проведение ветеринарно-санитарных мероприятий по ограничению распространения и ликвидации инфекции (1, 4, 8, 10).
Возбудитель. Коронавирус (Coronavirus). Этиологическая роль установлена Князевым В.П. Патоген впервые изолирован в октябре 1987 г. из проб органов павших утят, принадлежащих хозяйствам Ивано-Франковской области Украины и Ставропольского края РФ. Предварительно он классифицирован как представитель рода Coronavirus семейства Coronaviridae. Вирионы полиморфные: шаровидной, вытянутой или изогнутой формы. Размеры вирусных частиц сферической формы от 80 до 200 нм, вытянутой - 70-300 нм. На оболочке по всей поверхности расположены пепломеры длиной от 7 до 12 нм, образующие корону. Плавучая плотность в сахарозе - 1,19-1,20 г/см3, хлористом цезии - 1,20-1,26 г/см3 (3, 9, 11).
Вирус чувствителен к воздействию хлороформа, эфира, формальдегида (в конечной концентрации не менее 0,15%), бета-пропиолактона (1:750), перекиси водорода, температуры 58±2оC в течение 30 минут и лиофилизации без стабилизаторов под вакуумом. Пяти-семикратное замораживание при минус 35-40оС с последующим оттаиванием при плюс 22-35оС снижает активность с lg 6,0 до 2,0 ЭЛД50 /см3. Он не обладает гемагглютинирующей активностью к эритроцитам уток, цыплят, кур, овец, морских свинок, кроликов, крыс и человека с 0(I) группой крови. Вирус агглютинирует эритроциты самцов белых мышей (Мусукаева Ф.Б. и др., 1996) (10).
Антигенная структура не изучена. Изоляты вируса, выделенные с 1987 по 1999 год, в антигенном отношении идентичны между собой. С антигенами коронавируса реагируют два вида моноклональных антител к нуклеопротеину и белку Е возбудителя трансмиссивного гастроэнтерита свиней(14). Установлено перекрестное антигенное родство между гемагглютининами коронавируса уток и возбудителя коронавирусного энтерита крупного рогатого скота (10). Автор статьи неоднократно получал положительные результаты в РДП при использовании САТ гипериммунной сыворотки морской свинки (на КВУ из УЭ) и САГ КВ штамма Массачусетс 41 из набора для диагностики ИБК. Контроли реакции были действительными (1990 – 1994гг).
В мае 2003 г. на канале НТВ телевидения России высказана версия о том, что коронавирус уток является предшественником возбудителя атипичной пневмонии человека (SARS), изолированного от жителей Китая, Канады и других стран в зимний период 2002-2003 гг.Филогенетические тесты, проведённые в более10 странах показали следующие результаты, отбражённые на рисунке. 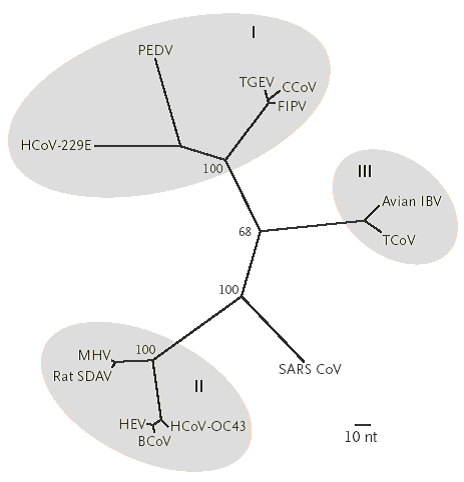
Филогенетическое дерево с максимально возможной достоверностью, построенное на основе выравненных последовательностей 405 нуклеотидов открытой рамки считывания 1b гена полимеразы коронавируса (номера нуклеотидов с 15173 по 15578 на основе полного генома коронавируса крупного рогатого скота инвентарный номер NC_003045), для сравнения коронавируса SARS с другими коронавирусами человека и животных.
На дереве видны три основные антигенные группы в Роду коронавирусов (I, II и III), представленные человеческим коронавирусом 229E (HcoV-229E), собачьим коронавирусом (CcoV), вирусом инфекционного кошачьего перитонита (FIPV), вирусом инфекционного гастроэнтерита свиней (TGEV), вирусом эпидемической диареи свиней (TGEV), человеческим коронавирусом OC43 (HcoV-OC43), коронавирусом крупного рогатого скота (BcoV), гемагглютинирующим вирусом энцефаломиелита свиней (HEV), вирусом крысиного сиалодакриоаденита (SDAV), вирусом гепатита мышей (MHV), коронавирусом индюков (TcoV) и вирусом инфекционного бронхита птиц (IBV). КВ уток, выявленный в России, не был использован для исследований.Значения бутстрепов для автоматической компенсации погрешностей (на основе 100 повторов), полученные из дерева консенсуса на основе 50 % принципа большинства, показаны на основных внутренних ветвях филограммы. Длины ветвей пропорциональны количеству нуклеотидных замен.
Cравнение полных геномов коронавирусов не позволяет выявить наиболее близкий к вирусу SARS геном, хотя наибольшее число совпадающих линий наблюдается между SARS и бычьим коронавирусом 2-ого типа. Поэтому эволюционные сравнения необходимо проводить по кластерам генов. Хотя и здесь разбиение на кластеры также сопряжено с трудностями. В некоторых участках генома вируса SARS наблюдается наибольшее сходство с бычьим коронавирусом, в других участках генома вируса SARS, наоборот, сходство между птичьим коронавирусом и вирусом SARS выше. Правда, при этом степень гомологии очень низка со всеми известными коронавирусами. Блочный тип эволюции (и возможные точки рекомбинации) можно просчитать более точно, но для этого необходимо время и информация по структуре большего числа штаммов коронавирусов. Возбудитель SARS (ТОРС) наиболее близок к бычьему коронавирусу. Известно, что так называемые «бычьи» вирусы, как правило, оказываются также и вирусами мелких грызунов и даже кошек, живущих вместе или рядов с коровами. Поэтому гипотеза о кошачьей природе возбудителя ТОРС (SARS), а не утиной (птичьей), имеет законные права на существование.
Однако, все КВ, в том числе и SARS вирус, очень быстро мутируют, поэтому необходимы тщательные изучения многих штаммоввозбудителей, чтобы создать точные диагностические тесты и эффективные способы лечения. Коронавирусы обладают потенциалом изменяться больше, чем другие РНК-вирусы, главным образом, потому, что их геном значительно больше и высокая частота рекомбинации является их особенностью. Рекомбинация, вероятно, ограничивается лишь обменом фрагментами генома с близкородственными вирусами животных.
Выделение КВУ п роводили с учетом постулатов Коха: возбудитель должен обнаруживаться у всех больных с данным заболеванием; он должен быть выделен из хозяина и культивирован в чистой культуре; и культура, выделенная таким образом должна воспроизводить болезнь у других организмов, с подъемом уровня специфических антител после заражения.
Оптимальной биологической системой для выделения и культивирования вируса являются развивающиеся утиные эмбрионы 9-12-суточной инкубации. Вирус максимально накапливается в хориоаллантоисной оболочке (ХАО) и печени эмбриона (до 6,0 lg ЭЛД50), аллантоисной жидкости (lg 3,0), тушке и головном мозге (до lg 2,0). Последовательные 3 - 5 пассажей (при введении изолятов вируса в аллантоисную полость или наслоении на ХАО) способствуют повышению активности возбудителя с lg 2,0 до 4,0-6,0 ЭЛД50/см3. Куриные эмбрионы менее пригодны для культивирования: исходная летальность снижается с lg 5,0-6,0 ЭЛД50/см3 до 2,0 в первых двух пассажах и остаётся на таком уровне в последующих десяти, сохраняя патогенность для УЭ и утят.
В первично трипсинизированных культурах клеток ХАО, фибробластов УЭ и КЭ, а также перевиваемых – ПСГК, МДВК, РК-15, ПЭЛ, ПС, CV-1 и VERO коронавирус не вызывает цитопатического действия, трех-четырехкратное пассирование в этих культурах снижает концентрацию вируса и его патогенность для УЭ.
Парентеральное введение концентрированного, очищенного в градиенте плотности сахарозы вируса индуцирует образование специфических антител у белых крыс, кроликов, морских свинок и свиней.
Князевым В.П. разработан метод получения специфичных сывороток крови животных, включающий следующие этапы:
1. Репродукция вируса в УЭ 10-12-суточной инкубации.
2. Сбор вируссодержащей аллантоисной жидкости с активностью не менее lg 5,5 ЭЛД50. Хранение супернатанта при температуре от плюс 40 до минус 70ºС.
3. Получение надосадка аллантоисной жидкости при 10000-13000 об/мин. Хранение при плюс 4-8ºС.
4. Очистка вируса путём осаждения его через раствор сахарозы при 40000-90000 об/мин в течение 60-120 минут. Ресуспендирование осадка вируса в 3ФР рН 7,2-7,4. Отбор проб вируса для определения биологической активности.
5. Смешивание 1:1 иммуногена (коронавируса) с полным адъювантом Фрейнда для четырёхкратного парентерального введения по 0,5 см3 крысам, кроликам и морским свинкам. Уткам вводят осветлённую аллантоисную жидкость, содержащую коронавирус с активностью не менее 6,0 lg ЭЛД50.
6. Испытание полученных специфических сывороток в РДП, РСК, ИФА и РН. Для обнаружения антигена в печени павших утят были пригодны РДП и непрямой ИФА. Антитела сывороток всех животных не обладали комплементсвязывающей и вируснейтрализующей активностью.
Эпизоотологические данные. Сезонность проявления болезни не отмечена. В естественных условиях к коронавирусной болезни восприимчивы утки пекинской и мускусной пород с 3-суточного возраста. Заболевание других видов птиц, млекопитающих и человека не выявлено. Источником возбудителя инфекции является больная птица. У уток-вирусоносителей, больных и переболевших особей в содержимом кишечника и фецесе патогенный коронавирус содержится в концентрации до 1х108 вирионов/см3. Установлена прямая корреляция между концентрацией возбудителя в кишечнике, летальностью и результатами обнаружения специфического антигена вируса в пробах паренхиматозных органов павших уток.
Возбудитель болезни выделяется во внешнюю среду из желудочно-кишечного тракта. Установлен трансовариальный путь передачи вируса и заболевание утят в 3-суточном возрасте в изолированных условиях.
Проявлению инфекции в клинически выраженной форме способствует некачественное и ограниченное кормление, а также низкий уровень зоогигиенических условий содержания птицы. Практическими ветеринарными специалистами утководческих хозяйств Московской и Оренбургской областей Калашниковым В.А. и Будкиным Ю.Е. в 1991 –1999 гг. было замечено влияние качества корма на возникновение, проявление коронавирусной болезни уток и повышение уровня летальности. Наблюдения свидетельствуют о том, что использование в качестве основного корма для утят комбикормов ПК 1 - (3 Ф) – 3150.01 – 97 – 211 и ПК 1 – (3 Ф) – 3189. 98 – 99 – 220, предназначенных для кур-несушек 15–18-месячного возраста, с содержанием в рецептуре 7,5–9,5% соевых шрот и до 8,5% известковой муки может провоцировать острое течение коронавирусной болезни уток на фоне неконтролируемого латентного вирусоносительства. В зависимости от физиологического состояния уток и вирулентности вируса течение болезни в отдельных группах продолжается от 4 до 35 суток с летальностью от 5 до 90%; пик массовой гибели чаще отмечают у 12-30-суточного молодняка.
В естественных условиях определена ассоциация коронавирусной болезни с колибактериозом и сальмонеллезом.
Течение и симптомы болезни. Коронавирусная болезнь протекает в острой, подострой и хронической формах. Первые две чаще наблюдают у молодняка, тогда как хроническую – у уток маточного поголовья.
Острая форма более отчетливо выражена у утят 5-30-суточного возраста. Продолжительность инкубационного периода и время проявления симптомов составляют от 1 до 7, реже 10 суток. Внезапно, сначала у отдельных особей, обнаруживают полупараличи и параличи ног (основной клинический признак). Затем количество больных увеличивается, и процент заболевших составляет 5-20% от общего поголовья птицы. Утята медленно передвигаются на полусогнутых конечностях или ползают на плюснах. Перед гибелью становятся апатичными, малоподвижными, ограниченно принимают корм и воду. У большинства заболевших утят отмечают серозно-катаральный коньюнктивит, ринит, синусит и диарею. В некоторых случаях регистрируют круговые движения головой и периодическое вытягивание крыльев. Затем наступает коматозное состояние и гибель. При острой форме погибает от 8 до 40% утят (1, 3, 6, 9, 10,12, 14, и 15).
Подострая форма. Угнетенное состояние, полупараличи и параличи ног, ограниченный прием корма и воды, прогрессирующее исхудание и диарею у больного молодняка регистрируют в течение 8-15 суток. Одновременно в неблагополучных группах можно выявить здоровых, больных и переболевших (маловесных) утят. Период гибели продолжается до 1-3 месяцев, летальность составляет от 30 до 90%. В связи с отсутствием напряженного иммунитета у утят-реконвалесцентов нередко наблюдали повторное проявление болезни с летальностью до 100%.
В хозяйствах, где ежегодно регистрировали болезнь молодняка, постоянно отмечали хроническую форму течения болезни у маточного поголовья, проявляющуюся, в основном, снижением уровня яйценоскости на 25-30%. У некоторых уток родительского стада развивались серозно-катаральный сальпингит и клоацит.
При нарушении зоогигиенических условий и ограничении в кормлении в группах уток-вирусоносителей возможно выявить птицу с острой и подострой формами течения болезни. При катарах летальность достигает 12%.
В экспериментальных условиях инкубационный период продолжается от 6 до 30 суток. После парентерального введения вируса с активностью не менее lg 3,0 ЭЛД50/см3 у утят и взрослых уток в 10-20% случаев развивались острая или подострая формы болезни, идентичные наблюдаемым в естественных условиях. Ассоциированное трех-четырехкратное внутримышечное и пероральное введение с интервалом 24-48 часов повышает вероятность заболевания, сокращает инкубационный период до 4-10 суток, способствует проявлению острой формы болезни и более высокому уровню летальности. В ранней стадии острой формы у уток отмечали неустойчивость походки и медленное передвижение на полусогнутых конечностях или плюснах. В дальнейшем из-за паралича ног птица лежит и ограниченно принимает корм. У некоторых особей наблюдается серозно-катаральный коньюнктивит, катаральный или катарально-геморрагический ринит, диарея с эвакуацией фекалий темно-зеленого цвета. В состоянии выраженного угнетения птица погибает на 3-10 сутки после начала проявления клинических признаков.
Многолетние наблюдения показали, что в естественных условиях доминирует форма болезни с поражением желудочно-кишечного тракта, тогда как в экспериментальных дополнительно раскрывается лёгочная, характерная для искусственного многоразового заражения птицы (Князев В.П., 1987-1992 гг.).
При подострой форме в течение 5-12 суток дополнительно отмечают прогрессирующее исхудание, задержку роста и отсутствие блеска перьевого покрова, вогнутость поверхности кожи над синусами. Вокруг глаз образуется ореол из влажного или высохшего пера. Из носовых отверстий выделяется серая мутная слизистая масса, в 5-10% случаев (перед гибелью) с примесью крови.
Переболевшие утки длительное время (20-60 дней) восстанавливают свой кондиционный вес. При этом до 10-20% реконвалесцентов в течение данного периода погибают из-за деструкции и нарушения функций внутренних органов. Искусственное заражение переболевших уток вызывает повторное их заболевание после инкубационного периода в 4-7 суток с последующим проявлением острой формы болезни и летальностью до 100%. Заражение цыплят с 5-суточного и старше возраста, а также взрослых кур, не вызывает развития коронавирусной болезни.
Патогенез. Изучен недостаточно. Трансовариальным и, предположительно, алиментарным путем коронавирус попадает в кишечник, адсорбируется на клетках эпителия ворсинок и репродуцируется в них, что сопровождается их истончением, фрагментацией и отторжением. Активное воспроизводство вирусных частиц и распад энтероцитов приводит к интенсивному возрастанию концентрации возбудителя в содержимом кишечника. Коронавирус проникает в кровеносные сосуды, депонируется в печени, селезенке, почках и легких, где индуцирует воспалительный процесс и резкое расстройство гемодинамики (Князев В.П., 1990 г.).
Патологоанатомические изменения. После 1-2-суточного периода болезни внешний вид павших утят чаще не имеет изменений. Трупы утят и уток не истощены, с тусклым, загрязненным перьевым покровом. У многих отмечается цианотичное окрашивание клюва и нижних частей ног (лап). В носовых полостях содержится прозрачная слизистая жидкость или густая серозная масса. В 20-60% случаев регистрируют катаральный или катарально-геморрагический ринит, синусит и коньюнктивит. Цвет мышц бледно-розовый, объем их меньше, чем у контрольных особей. Веретенообразное расширение пищевода некоторых утят переполнено кормом.
При острой форме на слизистой оболочке трахеи видимых изменений не отмечают, тогда как при подострой – катар или, реже (на 10-15 сутки течения болезни), дифтеритическое наложение фибрина на верхней 1/3 части органа.
Легкие интенсивно-розового или темно-красного цвета. В 20-30% случаев регистрируют катаральную пневмонию.
В железистом желудке отмечают катаральное воспаление и обильное содержание серо-белой слизи. В 40-80% наблюдают катарально-геморрагический энтерит, чаще 12-перстной кишки и тонкого отдела кишечника. На слизистой оболочке клоаки и прямой кишки постоянно присутствуют






