В предыдущем разделе были рассмотрены особенности вну- тримолекулярных связей атома кислорода, объясненные с помо- щью представления о дипольной структуре атома и её взаимодей- ствии с небесным эфиром. Они помогают показать, что различные состояния молекулы кислорода должны отличаться разными ди- польными структурами, функционально определяющими особен- ности состояния. Известны триплетное и два синглетных состояния молекулы О2 [38]. Согласно классификации молекулярных частиц [32, с. 8] и выводам настоящей работы, им отвечают дипольные структуры – в первом случае молекулярного бирадикала О2. В двух других случаях – это молекулы, состоящие из временных ионных
112
М. Г. Виноградова. Ростки истины на пути познания
конфигураций О+ и О– атомных ионов, разных для каждого из двух атомов.
Без знания дипольной структуры атома и молекулы кислорода [13, 46] трудно объяснить структурные особенности разных состо- яний кислорода и их неустойчивость как причину их перехода из одного состояния в другое [38]. Синглетный кислород – это не про- сто возбуждённое состояние О2 с повышенным уровнем энергии,
определяемым размахом колебаний диполей, это – что-то ещё,
связанное со структурой. А что именно? Из общих представлений известно, что синглетное состояние кислорода – это разновидность аэроионов, образующихся из молекулярного бирадикала кислоро- да при его активации под действием внешнего источника энергии, оставляющим неповреждённой центральную связь О–О, но с воз- можной потерей атомами нейтральности, другим и словами, при ионизации. Чаще всего это ударная ионизация электрическими разрядами или радиоактивным излучением, термическая иониза- ция, фотоионизация (ультрафиолетовым излучением).
В обычном состоянии молекула кислорода представляет собой молекулярный бирадикал как имеющий с точки зрения квантовой химии два неспаренных электрона на валентном уровне. С точки зрения представлений о дипольной структуре атомов молекула О2
имеет два свободно пульсирующих диполя, почти параллельных
друг другу [13], дающих молекуле парамагнитность. Молекуляр- ный бирадикал кислорода О2 показан на рис. 4.7.
Потеря нейтральности молекулярной структурой – это есте-
ственный результат её ионизации. Так, ударная ионизация с от- рывом электрона от одного пульсирующего диполя приводит к образованию положительного молекулярного иона О2 – е = О2+.
Показано на рис. 4.8. При этом образуется промежуточный ди-
поль-II’, не участвующий во взаимодействии молекулы с эфиром. При ионизации молекулы О2 за счёт разрушения одного холостого диполя-II процесс изменения её состояния связан с потерей моле-
кулой нейтральности, при котором происходит частичная потеря взаимодействия молекулы с эфиром. В связи с последним обсто- ятельством второй холостой диполь-I, как и при ионизации атома [6, с. 101–104], увеличивает частоту пульсации, поддерживая «за
4. От космических глубин – к атому 113
Рис. 4.8. Дипольная структура молекулярного иона О +: О+ – О
двоих» взаимодействие молекулы с эфиром. Согласно данным ра- боты [13], целостность всей молекулы О2 обеспечивается пульсаци- ей валентных диполей с частотой, зависящей от энергии ионизации Wион. = 12,077 эВ.
Если перед ионизацией частота их пульсации имеет величину:
ωо2 = Wион о2 /h = 12,077 эВ/4,1359.10–15 эВ.с = 2,92.1015 с–1,
то оставшийся в молекуле диполь-I должен пульсировать с часто- той ≈ 2ωо2 1/с. Взаимодействие с эфиром учащенно пульсирующего оставшегося диполя- I могут компенсировать 2 диполя, пульсирую- щих с разностью фаз по частоте колебания на полпериода (рис. 4.8). Это диполь-I и рядом с ним справа расположенный более глубоко погружённый диполь-I’: 2 спаренных попеременно пульсирующих электрона.
Эта картина показывает перспективу двойной связи, образуе- мой парой разнофазных осцилляций электронов, пульсирующих с частотой ωо+2 =11,5 эВ / 4,1359.10–15 эВ.с = 2,78.1015 1/с с разностью фаз по частоте на половину периода. В этом и есть особенность вза- имодействия с эфиром дипольной структуры молекулярного иона О2+. Ионизованный кислород в большом количестве наблюдают в
114
М. Г. Виноградова. Ростки истины на пути познания
атмосферах горячих звёзд, чаще у звёзд спектрального типа В1, где есть условия для температурной ударной ионизации [10, с. 368].
Однако ударная ионизация не единственная возможность ио- низации молекулы О2, вернее, составляющих её отдельных атомов. Потеря нейтральности атомом кислорода, входящем в состав пе- роксида водорода Н2О2, может наступить при разложении Н2О2 в щелочной среде: приобретением электрона структурой молекулы, содержащей в нейтральной среде неповреждённую связь с эфи-
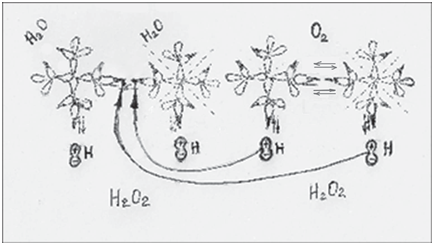
ром. Разложение пероксида водорода в нейтральной среде при- водит к образованию молекул воды и бирадикала молекулярного кислорода О2. Из двух молекул Н2О2 образуется 2 молекулы воды и одна молекула О2, что в виде дипольных структур показано на рис. 4.9.
Рис. 4.9. Разложение 2-х молекул Н2О2. Другой цвет относится к происхо- дящим перемещениям атома водорода Н и продуктам реакции
Что же происходит с молекулой пероксида при его разложении в щелочной водной среде, например, в присутствии едкого натра? А происходит следующее: H2O2 + Na+ OH– = HO2– + Н+ + ОН– + Na+ + n ккал/моль.
4. От космических глубин – к атому 115
Рис. 4.10. Разложение пероксида водорода в щелочной среде
Щёлочь отнимает протон у одного из атомов водорода, так что
от пероксида остаётся асимметричная молекулярная частица НО –
О–. Как изменится дипольная структура взаимодействия с эфиром
пероксида водорода после потери им протона от правого атома во- дорода, показана на рис. 4.10.
В следующий момент за показанным на рис. 4.10 правая часть
структуры остаётся без водорода: освободившийся электрон во- дородного диполя образует новый диполь I’’ слева от диполя I, до
этого связанного с водородом. Наступает рассинхронизация левых
и правых пульсаций пульсирующих диполей бирадикала с соответ- ствующим снижением частоты. Эти два диполя могут пульсировать
в разных фазах и обмениваются с эфиром частицами нейтрино с неизвестной частотой. Перекисный ион O
– (супероксид-анион) яв- ляется потенциальным источником другого состояния кислорода,
например, синглетного, имеющего 2 спаренных диполя в одном и том же атоме (одном из двух атомов) [38]. Действительно, к этому
состоянию структуры, когда два спаренных диполя оказываются в одном из атомов, а во втором нет пульсирующих диполей, может
привести взаимодействие с сильнейшим окислителем, например,
Cl2:
116
М. Г. Виноградова. Ростки истины на пути познания
HO – + Cl + H O + Na+ = O – О– + Н + Cl + Сl– + H O + Na+ =
2 2 2 2
= O
+ О
– + H O + NaCl + HCl.
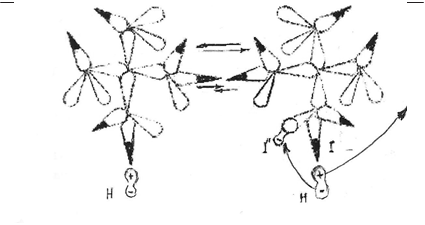
Водород в виде гидрид-иона Н- покидает диполь-II (рис.4.11а), чтобы вступить в реакцию с хлором, переводя Cl в состояние Cl
+ Сl
–, так что от диполя-II остаётся только положительный заряд. Послед- ний образует промежуточный диполь-II” вместо пульсирующего диполя-II (рис. 4.11б).
Рис. 4.11а
Рис. 4.11б.
4. От космических глубин – к атому 117
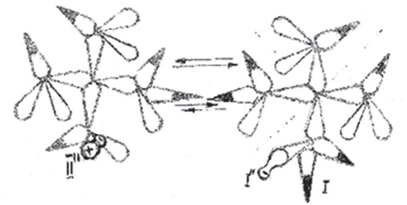
Таким путём молекула оказывается дважды ионизирована, в связи с чем наступает полная рассинхронизация пульсируюших диполей бирадикала – он перестаёт существовать. Вместо двух пульсирующих диполей двух атомов пульсирующий диполь-I либо удваивает частоту своей пульсации по взаимодействию с эфиром, либо распределяет удвоенную «нагрузку» на двоих: на диполь- I и соседний слева диполь- I’’, вновь образовавшийся после потери протона атомом водорода (рис. 4.11б).
Два диполя рядом, пульсирующих попеременно, в двух состо- яниях: рис. 4.8 и рис. 4.11б – не в этом ли причина особой актив- ности кислорода в таких его особых состояниях? Один из атомов кислорода в анализируемом состоянии (рис. 4.11б) оказывается положительным атомным ионом, второй – отрицательным атом- ным ионом: О+ – О–. Положение очевидно – весьма неустойчивое, так как в следующий момент времени электрон может сорваться от промежуточного диполя-I’’ и восстановить пульсирующий диполь- II из промежуточного состояния II’’ и восстановить весь молекуляр- ный бирадикал кислорода. Этим можно объяснить весьма малое время жизни обеих кратковременных синглетных форм состояний молекулярного кислорода.
Представление о дипольной структуре атомов, полученной ими в процессе звёздного синтеза, открывает новые возможности для изучения связи с эфиром атомных и молекулярных структур. Пути конкретных решений, показанных на примере углерода для 3-х его разновидностей [12], как оказалось – не менее перспектив- ны для рассмотренных в настоящем разделе реальных состояний кислорода.