

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Ранее с этих позиций были рассмотрены дипольные структуры атомов водорода, гелия, углерода, а также природа водородных связей как межмолекулярных связей. При рассмотрении молекулы кислорода приходится сталкиваться с особенностями внутримоле- кулярных связей. С помощью метода электронных орбиталей кван- тово-механической модели атома трудно объяснимы такие свой- ства кислорода, которые обусловливают разное поведение атома и молекулы. Среди этих свойств кислорода его парамагнитность является необычной, отличающей его от всех прочих газообразных (при обычных условиях) элементов.
Видимое проявление парамагнетизма – способность вещества втягиваться в магнитное поле – объясняется тем, что у молекул, ориентирующихся в направлении магнитного поля, есть собствен- ный магнитный момент. Есть он и у молекул кислорода, но откуда он берётся? Ведь его нет в атоме. Внешняя электронная оболочка кислородного атома состоит из шести электронов.
По терминологии квантово-механических представлений четы- ре из них – «спаренные», отличающиеся друг от друга противопо-
 |
ложными спинами – объединены в две пары. А два – «неспарен- ные», то есть с одинаковыми спинами и значит – «холостые» [30,
с. 118]. Но что такое спин? Считается, что это внутренний момент количества вращения частицы, связанный с собственным магнит- ным моментом электрона как электрически заряженной части- цы. С позиции квантовой химии, физический носитель магнитных свойств – это неспаренный электрон, не имеющий такового сосед- него с противоположным спином. Потому, как если бы таковой появился рядом на орбитали с противоположным спином, т.е. с противоположным направлением вращения, то эти двое должны образовывать систему, суммарно не имеющую собственного маг- нитного момента [30]. Это не совсем так с точки зрения представле- ния о дипольной структуре атомов: физическим носителем её элек- трических, а значит и магнитных свойств является пульсирующий диполь с пульсацией электрона вдоль оси диполя, направленной к центру структуры.
|
|
Процесс пульсации есть чередование растяжений и сжатий ди- поля под действием внедряющихся и выскакивающих нейтрино. Именно особенности дипольной структуры атома кислорода ле- жат в основе особых свойств молекулы О2, отличающих кислород
от всех других газов. А именно: в основе атома О лежит структура
асимметричного атома биогенного углерода, как было показано в последних наших работах, в том числе в статье [13]. В дипольной атомной структуре различаются диполи, направленные электрона- ми наружу, и диполи с электронами, направленными внутрь атома. Последние несут функцию нейтронов.
В структурах атома и молекулы функцию связи с эфиром вы- полняют диполи с электронами наружу – их просто называем «ди- поли». В процессе ядерного синтеза от атома предыдущего эле- мента кислороду в числе наружных диполей (рис. 4.5). достались два диполя слева от оси (1 и 2) и два диполя справа от оси (3 и 4), которые образуют 4 электрона, не участвующие в химической связи молекулы воды. Вновь приращённые 2 самых наружных ди- поля разнесены друг от друга на угол 104° и являются валентными рис. 4.5).
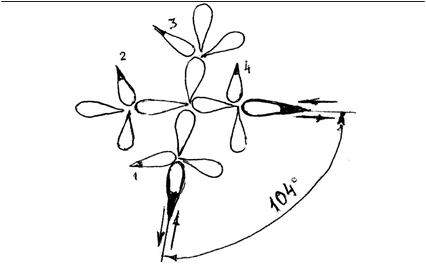 |
Рис. 4.5. Дипольная структура атома О
Таким образом, в рамках представления о дипольной структу- ре атомов 4 наружных диполя, доставшиеся кислороду при звёзд- ном синтезе от предыдущего атома (1, 2, 3, 4) не являются самыми наружными, то есть валентными. Пульсирующими диполями ато- ма, то есть носителями импульсных токов являются валентные ди- поли, то есть как раз самые наружные.
|
|
Каждый из них создаёт магнитное поле в плоскости, перпен- дикулярной направлению пульсаций. А они осуществляются вдоль осей диполей (указано стрелками), то есть у атома О в двух не со- впадающих направлениях, расположенных под углом, близким к 90° (104°). В такой конфигурации «двух проводников с током» атом не должен реагировать на внешнее магнитное поле – он и не реа- гирует. Дело в том, что А. Ф. Иоффе когда-то установил, что в слу- чае параллельного пучка электронов в вакууме его магнитное поле совпадает с магнитным полем прямого тока такой же величины в проводнике. В атоме кислорода пульсирующие валентные диполи не дают параллельных пучков электронов, благодаря величине ва- лентного угла, близкой к 90°.
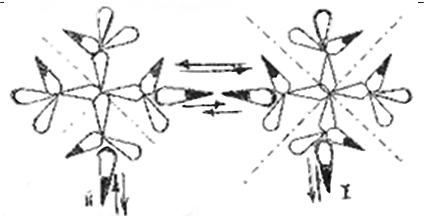 |
Рис. 4.7. Дипольная структура молекулы О2.
Два диполя I и II пульсируют почти параллельно друг к другу
в направлении от центра и к центру своего атома
Теперь вопрос: в каком положении валентные диполи ока- зываются в молекуле О2? Удивительно, что молекула О2, с одной стороны, очень похожа на атом О тем, что так же имеет два валент- ных диполя: дипольная структура молекулы О2 представлена на рис. 4.7.
«Замечательной особенностью молекулы О2 является наличие двух неспаренных электронов: это приводит к парамагнетизму кис- лорода» [32, с. 111]. Квантово-механические представления ставят
вопрос так: могут ли остаться неспаренными, то есть обладающи- ми одинаковыми спинами, неспаренные электроны при объедине- нии двух атомов в молекулу. Но всё дело в том, что на парамаг- нитные свойства молекулы кислорода должен влиять не сам факт объединения или необъединения неспаренных электронов в пару, якобы влияющий на возникновение магнитного момента. Послед- ний возникнет не из-за того, что одна пара неспаренных диполей просто останется неспаренной, а из-за того, что валентные дипо- ли оказываются в положении почти параллельном друг другу. Это возможно, если по одному из валентных диполей каждого из двух атомов участвуют в образовании молекулы, а два других валентных
 |
|
|
пульсирующих диполя по одному от каждого атома останутся сво- бодными пульсаторами. Тогда те, другие, и представят собой почти параллельный пучок электронов диполей I и II, имеющий соответ- ственное магнитное поле (рис. 4.7).
Сравнивая атом кислорода с молекулой по рисункам 5 и 7, об- наруживаем, что количество валентных диполей не изменилось, но изменилась их взаимная направленность: вместо почти перпенди- кулярной она стала почти параллельной.
В таком расположении валентные пульсирующие диполи в молекуле кислорода должны реагировать на внешнее магнитное поле, что и происходит в действительности: парамагнетизм моле- кулы элемента № 8 – известный экспериментальный факт.
|
|
|

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!