ФИЗИЧЕСКАЯ ХИМИИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ И ДИСПЕРСНЫХ СИСТЕМ
1.1. Предмет и основные понятия коллоидной химии
Коллоидная химия — раздел физической химии, изучающий поверхностные явления и дисперсные физико-химические системы.
Поверхностные явления — это процессы, происходящие на границах раздела фаз, составляющих физико-химические системы.
Фаза — однородная по составу и одинаковая по физическим и химическим свойствам часть физико-химической системы, отделенная от других ее частей поверхностями раздела.
Поверхностные явления сильнее всего проявляются в системах с очень большой поверхностью раздела фаз. К таким системам относятся поверхностные слои, пленки, нити, капилляры, мелкие частицы. Их совокупность вместе со средой, в которой они находятся, образует дисперсную коллоидную систему.
Та часть системы, которая находится в измельченном состоянии, называется дисперсной фазой.
Сплошная фаза, в которой распределена дисперсная фаза, называется дисперсионной средой.
Для коллоидных систем характерны два общих признака: гетерогенность и дисперсность.
Гетерогенность, или многофазность, указывает на наличие межфазной поверхности, т. е. на неоднородность системы.
Дисперсность (раздробленность) — определяется степенью измельчения вещества дисперсной фазы, т.е. размерами частиц. Размеры частиц дисперсных систем, изучаемых коллоидной химией, находятся в пределах от 10–2 до 10–7 см.
Коллоидные дисперсные системы характеризуются также определенным видом энергии — поверхностной энергией Гиббса G s.
Гетерогенность предполагает наличие поверхностного натяже ния σ.
Дисперсность определяет величину межфазной поверхности S.
Энергия поверхности G s = σ × S. Чем больше дисперсность, тем больше в системе свободная поверхностная энергия.
Большой запас энергии определяет еще одну характерную особенность дисперсных коллоидных систем — их неустойчивость.
Совокупность свойств типичных коллоидных систем: термодинамическая неустойчивость, высокая лабильнось и неполная воспроизводимость по отношению к биологическим дисперсным системам определяет их эволюцию.
1.1. Термодинамика поверхностных явлений
Поверхностные явления протекают на границах раздела фаз и обусловлены особыми свойствами поверхностных слоев.
Состояние молекул или атомов, находящихся в поверхностном слое, иное, чем у молекул или атомов, находящихся в объеме фазы.
Из-за нескомпенсированности сил межмолекулярного взаимодействия со стороны воздуха энергия у молекул поверхностного слоя выше, чем у молекул в объеме фазы.
 Суммарный избыток энергии молекул поверхности —свободная поверхностная энергия Гиббса Gs.
Суммарный избыток энергии молекул поверхности —свободная поверхностная энергия Гиббса Gs.
Общая энергия системы G — сумма поверхностной энергии Гиббса Gs и энергии Гиббса объемной фазы G v:
G = Gs + G v
Пусть имеется гомогенная фаза с площадью поверхности А, тогда:
Gs = A hσ – TAsσ,
где hσ и sσ — энтальпия и энтропия единицы поверхности, а Ahσ и Asσ — энтальпия (Hs) и энтропия (Ss) поверхности.
Общая энергия Гиббса системы:
G = H v – TS v + Hs – TSs,
где Hs и Ss — избыточные значения термодинамических величин, обусловленные наличием поверхностных слоев.
Поверхностная энтальпия Hs = Gs + TSs. Если энтропийный фактор незначителен, то Hs = Gs.
1.3. Поверхностное натяжение
Поверхностное натяжение (σ) — это работа, которую требуется затратить для образования единицы поверхности (размерность Дж/м2).
Поверхностное натяжение (σ) — это мера избытка поверхностной энергии, приходящегося на единицу площади поверхности, который возникает за счет нескомпенсированности сил межмолекулярных взаимодействий у молекул поверхностного слоя.
Зависимость поверхностного натяжения от различных факторов
От природы жидкости
Поверхностное натяжение некоторых жидких веществ на границе с воздухом при температуре 293 К
| Вещество
| σ × 10–3 Дж/м2
|
| Гексан
| 18.4
|
| Этанол
| 22.8
|
| Ацетон
| 23.8
|
| Фенол
| 42.3
|
| Анилин
| 43.9
|
| Сыворотка крови человека
| 46 ¸ 47
|
| Вода
| 72.7
|
От температуры
При повышении температуры силы межмолекулярных взаимодействий ослабевают и поверхностное натяжение уменьшается.
От давления
При повышении давления увеличивается взаимодействие поверхностных слоев жидкостей с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности (сила F становится меньше) –– поверхностное натяжение уменьшается.
Изотермы ПИВ и ПНВ
1.4. Методы измерения поверхностного натяжения
Сталагмометрический метод
ЛЕКЦИЯ № 2
АДСОРБЦИЯ
Адсорбция — процесс самопроизвольного перераспределения вещества между поверхностным слоем и объемом фазы.
Адсорбент — фаза, на поверхности которой происходит адсорбция.
Адсорбат или адсорбтив — вещество, которое адсорбируется на поверхности.
Десорбция — процесс обратный адсорбции.
Абсорбция — поглощение вещества не только поверхностью, но и всей массой адсорбента.
2.1. Адсорбция на границе раствор––газ
Уравнение изотермы Ленгмюра

где а ¥ — величина предельной адсорбции, когда вся поверхность адсорбента заполнена адсорбатом, постоянная для всего гомологического ряда адсорбатов; к — постоянная для данного вещества, равная отношению константы скорости десорбции к константе скорости адсорбции, численно равная равновесной концентрации адсорбата при адсорбции, равной половине предельной; с — концентрация адсорбата.

Изотерма адсорбции Ленгмюра
Размерность [а] = [моль/единица поверхности] или [моль/единица массы адсорбента].
Для экспериментального определения предельной величины адсорбции и константы адсорбционного равновесия (K) уравнение Ленгмюра преобразуют в уравнение прямой следующим образом:
 ;
; 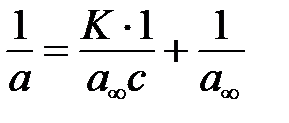
Затем строят зависимость  от
от  ; тангенс угла наклона прямой относительно оси абсцисс равен
; тангенс угла наклона прямой относительно оси абсцисс равен  , а сама прямая отсекает на оси ординат отрезок равный
, а сама прямая отсекает на оси ординат отрезок равный  .
.

2.2.2. Полимолекулярная адсорбция. Теории Поляни и БЭТ
Часто процесс адсорбции заканчивается образованием на поверхности адсорбента не одного слоя молекул адсорбата, а полимолекулярного адсорбционного слоя. В этом случае изотерма отличается от изотермы Ленгмюра и имеет более сложный вид.

На поверхности адсорбента преимущественно адсорбируются ионы, которые или входят в состав вещества адсорбента, или изоморфны его ионам и способны достраивать кристаллическую решетку вещества, или образуют с одним из ионов адсорбента труднорастворимые соединения.
Адсорбционная способность ионов зависит от их заряда и радиуса в гидратированном состоянии:
Li+ > Na+ > K+ > Rb+ > Cs+
Уменьшение адсорбции
Лиотропный ряд адсорбции однозарядных анионов:
анион NO3– I– Br– Cl– F–
радиус, Å 2,5 2,16 1,36 1,81 1,36
Уменьшение адсорбции
2.2.5. Ионообменная адсорбция
Смачивание — это поверхностное явление, заключающееся во взаимодействии жидкости с твердым или другим жидким телом при наличии одновременного контакта этих двух несмешивающихся фаз с третьей фазой — газом (чаще всего воздухом).
Если на поверхность твердого тела нанесена капля жидкости, то в системе имеются три поверхности раздела фаз: твердое тело—газ, жидкость—газ, жидкость—твердое тело с соответствующими поверхностными натяжениями: σтг, σтж, σгж. Линия пересечения всех трех поверхностей раздела –– линия смачивания; замкнутая линия смачивания образует периметр смачивания. Угол  между поверхностями жидкость—газ и твердое тело—жидкость –– краевой угол смачивания.
между поверхностями жидкость—газ и твердое тело—жидкость –– краевой угол смачивания.
Смачивание

Несмачивание

Если рассматривать поверхностные натяжения как силы, приложенные перпендикулярно к единице длины периметра смачивания и действующие по касательной к соответствующим поверхностям, то условие равновесия этих сил выражается уравнением Юнга:
σтг = σтж + σжг cosθ или 
· если краевой угол острый (θ < 900), т. е. cosθ > 0, то поверхность смачивается жидкостью («ограниченное смачивание»);
· если краевой угол тупой (θ > 900),  т. е. cos θ < 0; то поверхность не смачивается («плохое смачивание»)
т. е. cos θ < 0; то поверхность не смачивается («плохое смачивание»)
· если равновесный краевой угол не устанавливается, капля растекается в тонкую пленку — «полное смачивание» или растекание.
Если молекулярная природа жидкости и твердого тела близки, а σ жидкости мало — смачивание и растекание (органические жидкости с малым σ смачивают твердые тела). Жидкие металлы (высокие значения σ) смачивают только поверхности твердых металлов. Вода смачивает оксиды и растекается на некоторых силикатах, но не смачивает парафин.
Характеристика явления — энтальпия смачивания:
Δ Н = Hтг –Нтж
Отношение энтальпий смачивания твердых поверхностей водой (Нв) и углеводородом (H у) — характеристика гидрофильности поверхности — коэффициент гидрофильности. Для гидрофильных поверхностей  1, для гидрофобных — β < 1. Для активированного угля β
1, для гидрофобных — β < 1. Для активированного угля β  0,4 (гидрофобная поверхность), для кварца β
0,4 (гидрофобная поверхность), для кварца β 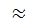 2 (гидрофильная поверхность), для крахмала β
2 (гидрофильная поверхность), для крахмала β 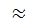 20 (сильно гидрофильная поверхность).
20 (сильно гидрофильная поверхность).
Явления адсорбции широко распространены в природе. Адсорбция играет очень важную роль в жизнедеятельности организма человека и животных. Это обусловлено наличием в организме огромного количества самых разнообразных поверхностей раздела — стенок сосудов, альвеол, поверхностей клеток, клеточных ядер, коллоидных частиц протоплазмы, и, наконец, поверхности раздела между организмом и окружающей средой.
Так, поверхность кожи взрослого человека –– 1.5 – 2.0 м2, площадь поверхности альвеол около 1000 м2, а площадь внутренней поверхности капилляров –– 2400 м2.
Адсорбционные возможности эритроцитов крови, обусловленны в первую очередь величиной суммарной поверхности этих форменных элементов. Эритроциты являются переносчиками различных веществ, в том числе и аминокислот, которые они разносят и передают клеткам и тканям организма. Число эритроцитов в крови взрослого человека примерно 27 × 1012; учитывая, что диаметр эритроцита 7 – 8 мкм, можно подсчитать, что общая поверхность эритроцитов крови одного человека составляет примерно 3200—3400 м2.
В медицине широко используется сорбционная детоксикация (Ю. М. Лопухин) — гемосорбция, основанная на избирательной адсорбции токсинов или метаболитов из крови, лимфы или плазмы пациентов, страдающих от острых отравлений, поражений печени и ряда других заболеваний.
ЛЕКЦИЯ № 3
ХРОМАТОГРАФИЯ
Хроматография — физико-химический метод, применяемый для выделения, разделения и идентификации разнообразных веществ природного и синтетического происхождения и качественного и количественного анализа их смесей.
3.1. Основной принцип хроматографии
Разделение веществ основано на различии в скоростях движения концентрационных зон веществ, перемещающихся в потоке подвижной фазы (элюента) вдоль слоя неподвижной фазы (адсорбента).
3.2. Классификация хроматографических методов
а) По агрегатному состоянию подвижной фазы:
газовая жидкостная
б) По агрегатному состоянию неподвижной фазы:


в) По доминирующему механизму взаимодействия разделяемых веществ с подвижной и неподвижной фазами:
● адсорбционная — основана на различии в физической адсорбции веществ;
● молекулярно-ситовая — основана на различной проницаемости молекул веществ в неподвижную фазу;
● ионообменная — основана на различной способности веществ к ионному обмену с адсорбентом;
● биоспецифическая — основана на высокой специфичности связывания веществ с неподвижной фазой;
● распределительная — основана на различии коэффициентов распределения веществ между подвижной и неподвижной жидкими фазами.
г) По геометрии неподвижной фазы: колоночная (в том числе капиллярная) и плоскостная (бумажная и тонкослойная).
3.3 Описание некоторых хроматографических методов
Ионообменная хроматография
Применяется для разделения смесей фенолов, карбоновых кислот (на анионитах), аминосахаров, нуклеотидов, нуклеозидов, пуриновых, пиримидиновых и других оснований (на катионитах), аминокислот, белков, нуклеиновых кислот.
Применяется для выделения специфических нуклеиновых кислот, гормонов, вирусов, антител, антигенов, ферментов, рецепторов лекарственных препаратов, клеток. Позволяет выделять следовые количества веществ.
Бумажная хроматография
Наконец, исключительно эффективно применение хроматографии при лечении психотропными препаратами, особенно при длительном применении, когда длитель ный прием их вызывает изменение метаболизма в зависимости от индивидуальных особенностей пациента и требуется дифференциированный подход к больному.
В фармации и фармакологии основное направление использования хроматографии — это идентификация лекарственных веществ, количественное определение биологически активных компонентов в растительном сырье, в полупродуктах, в сложных лекарственных смесях. Хроматография служит для контроля производства лекарств, для изучения стабильности лекарственных форм, для выбора метода оценки стабильности их, а также для контроля качества препаратов
ЛЕКЦИЯ № 4
ДИСПЕРСНЫЕ СИСТЕМЫ
Дисперсные системы гетерогенны и состоят из двух фаз — раздробленной дисперсной фазы с размерами частиц от 10–7 до 10–2 см и сплошной фазы — дисперсионной среды.
4.1. Классификация коллоидных дисперсных систем
Твердая
Твердая
| Т/Т
| Твердые гетерогенные системы: минералы, сплавы
| | Жидкая
| Т/Ж
| Суспензии и золи: пульпы, взвеси, пасты, бактерии, золи металлов в воде
|
| Газовая
| Т/Г
| Аэрозоли: пыли, дымы, порошки
|
|
Жидкая
| Твердая
| Ж/Т
| Капиллярные системы: жидкость в пористых телах, адсорбенты в растворах, жемчуг, опал, гели
|
| Жидкая
| Ж/Ж
| Эмульсии: нефть, кремы, молоко
|
| Газовая
| Ж/Г
| Аэрозоли: туманы, облака
|
|
Газовая
| Твердая
| Г/Т
| Пористые тела: твердые пены, адсорбенты в газах, гемостатические губки
|
| Жидкая
| Г/Ж
| Пены: флотационные, противопожарные, мыльные
|
| Газовая
| Г/Г
| Не являются гетерогенными системами
|
По структуре
● свободнодисперсные, в которых частицы дисперсной фазы не связаны между собой (суспензии, эмульсии, золи, аэрозоли);
● связнодисперсные, в которых одна из фаз не может перемещаться свободно. К последним системам относятся гели и студни, пены, твердые растворы (сплавы), пористые тела.
По дисперсности
● грубодисперсные, с размером частиц от 10–3 до 10–2 см и более (грубые суспензии, порошки, пены);
● микрогетерогенные, с размером частиц от 10–5 до 10–4 см (эмульсии, тонкие суспензии, аэрозоли);
● ультрамикрогетерогенные системы, с размером частиц от 10–7 до 10–6 см (золи).
Если дисперсионной средой является вода, то соответствующие системы называются гидрофильными и гидрофобными. В гидрофильных системах дисперсная фаза хорошо взаимодействует с водой, а в гидрофобных — наоборот.
4.2. Поверхностные явления в коллоидных дисперсных системах
Большая часть процессов, происходящих на поверхности раздела фаз в дисперсных системах, относится к адсорбционным процессам: образование двойных электрических слоев, пленок из молекул ПАВ или ВМС, образование адсорбционно-сольватных оболочек.
4.2.1. Образование и строение двойного электрического слоя
Возникновение двойного электрического слоя (ДЭС) на межфазной границе происходит самопроизвольно и связано с переходом ионов из одной фазы в другую.
Адсорбционный механизм. На примере избирательной адсорбции ионов на кристалле AgCl, образовавшемся при взаимодействии водных растворов AgNO3 и KCl.
AgNO3 + KCl  AgCl↓ + KNO3
AgCl↓ + KNO3
Пусть KCl был в избытке. Образовавшиеся кристаллы AgCl находятся в растворе, содержащем ионы K+, Cl– и NO3–.
На поверхности кристалла AgCl по механизму химической адсорбции адсорбируются ионы Cl–. Ионы K+ и NO3– не могут адсорбироваться, так как не способны достроить кристаллическую решетку или образовать с ионами AgCl труднорастворимые соединения (правило Фаянса––Панета).
При адсорбции ионов Cl– генерируется отрицательный электрический заряд и возникает электротермодинамический или j - потенциал. Ионы, создающие такой потенциал, –– потенциалопределяющие.
Ионы K+ из раствора притягиваются к отрицательно заряженной поверхности. Эти ионы, противоположные по знаку потенциалопределяющим, –– противоионы. Адсорбция противоионов протекает по механизму физической адсорбции.
На поверхности кристалла AgCl образуется ДЭС, состоящий из плотного адсорбционного и диффузного слоев.
На границе адсорбционного и диффузного слоев возникает электрокинетический потенциал или ζ-потенциал.

В адсорбционный слой входят потенциалопределяющие ионы Cl–, прочно хемосорбированные на поверхности кристалла, и часть противоионов K+, относительно прочно связанных с заряженной поверхностью.
Диффузный слой составляют ионы K+, расположенные на периферии ДЭС, они связаны с заряженной поверхностью менее прочно. Поскольку система в целом должна быть электронейтральна, число ионов K+, входящих в плотный адсорбционный и диффузный слои, равно числу потенциалопределяющих ионов Cl–.
Другой механизм возникновения ДЭС — поверхностная диссоциация — заключается в диссоциации вещества на поверхности твердой фазы, например, кварцевого песка. Частицы диоксида кремния SiO2 взаимодействуют с водой и образуют силанольные группы Si–OH Поверхностное соединение — поликремниевая кислота — способно к частичной диссоциации по кислотному типу:
Si–OH Si–O– + H+
Ионы Si–O– — потенциалопределяющие, а ионы H+ — противоионы.
4.3. Влияние различных факторов на строение ДЭС и величину z -потенциала
1. Влияние индифферентных электролитов
ЛЕКЦИЯ № 5
Схема диализатора
Схема электродиализатора
Диализ крови (гемодиализ) –– метод внепочечного очищения крови от веществ с малой и средней молекулярной массой (электролитов, мочевины, мочевой кислоты, креатинина и др.) путем диффузии и ультрафильтрации через синтетические полупроницаемые мембраны. Используется для детоксикации организма при острой и хронической почечной недостаточности, отравлениях диализируемыми ядами, а также в случаеях тяжелых нарушений электролитного состава крови с помощью аппарата «искусственная почка».
ЛЕКЦИЯ № 6
Устойчивость коллоидных дисперсных систем — это неизменность во времени их основных характеристик: дисперсности, взаимодействий между частицами и равномерности распределения частиц дисперсной фазы по всему объему системы.
Седиментационная устойчивость — устойчивость против оседания. Характеризует способность системы сохранять равномерное распределение частиц по объему дисперсионной среды.

FA – сила Архимеда; V – объем частицы; ρ 0 – плотность дисперсионнойсреды; g – ускорение свободного падения; Fg – сила тяжести; ρ – плотность дисперсной фазы
Если r > r 0 — оседание (седиментация);
Если r < r 0 — обратная седиментация (характерна для пен и многих жидких эмульсий).
Движение частиц вниз –– седиментационный поток.
Движение частиц вверх –– диффузионный поток.
Условие седиментационного равновесия — компенсация седиментационного потока (сверху вниз) диффузионным потоком (снизу вверх), характерно для систем с частицами, способными участвовать в броуновском движении, размерами 10–6 – 10–7 см (золей).
Агрегативная устойчивость — устойчивость частиц дисперсной фазы к агрегации, устойчивость к их объединению. Характеризует способность системы сохранять размеры и индивидуальность частиц.
Система коагулирует.
Правило Шульце – Гарди: коагуляцию вызывают только те ионы, которые несут заряд противоположный заряду гранулы; коагулирующая способность ионов-коагулянтов тем сильнее, чем выше их заряд (приблизительно пропорциональна шестой степени заряда).
ЛЕКЦИЯ № 7
Гидрофильно–липофильный баланс ПАВ (ГЛБ)
Обращение фаз эмульсий
При изменении характера эмульгатора прямая эмульсия может превратиться в обратную. Если в эмульсию, стабилизированную С17Н33СООК добавить CaCl2, то в результате реакции:

Порошки с гидрофильными свойствами (глина, мел) стабилизируют прямые эмульсии. Гидрофобные порошки (сажа, гидрофобизированный силикагель) стабилизируют обратные эмульсии. При стабилизации порошками действует структурно-механический фактор устойчивости.
Особо сильные стабилизаторы –– высокомолекулярные соединения, например, белки. Адсорбируясь на поверхности капель дисперсной фазы, они образуют гидратированные и структурированные пленки, создавая мощный структурно-механический фактор.
7.2. Пены
Пены –– это высококонцентрированные дисперсные системы с газовой дисперсной фазой и жидкой или твердой дисперсионной средой.
Стабилизаторы создают либо электростатический фактор (ионогенные ПАВ), либо структурно-механический фактор устойчивости (неионогенные ПАВ, белки), обеспечивающие расклинивающее давление.

Схема образования (а) и стабилизации пены, стабилизированной ионогенным ПАВ (б).
7.3. Аэрозоли
Аэрозоли — это дисперсные системы с газовой дисперсионной средой и жидкой (туманы) или твердой (пыли, дымы) дисперсной фазой.
Аэрозоли охватывают большой диапазон дисперсности – от 10-2 до 10-6 см, т. е. они могут существовать как в виде микрогетерогенных и грубодисперсных, так и в виде ультрамикрогетерогенных систем.
Аэрозоли характеризуются высокой седиментационной и агрегативной неустойчивостью. Это обусловлено малой плотностью газовой среды и слабым взаимодействием ее с дисперсной фазой. В аэрозолях не могут возникнуть термодинамические факторы устойчивости, так как газовая дисперсионная среда не в состоянии создать поверхностный слой, снижающий поверхностное натяжение, или образовать двойной электрический слой.
7.3.1. Особенности аэрозолей:
Термофорез –– движение частиц аэрозоля в направлении области с более низкой температурой.
Термопреципитация –– осаждение частиц аэрозоля на холодных поверхностях.
Фотофорез –– перемещение частиц при одностороннем освещении.
7.4. Порошки и суспензии
Порошки –– это свободно-дисперсные системы с газовой дисперсионной средой и твердой дисперсной фазой с размерами частиц от 10–5 до 10–2 см.
Порошки можно рассматривать как осажденные аэрозоли. В зависимости от размеров частиц для порошков приняты разные названия. Порошки с частицами от 0.2 до 0.002 см называют песками. Порошок с частицами от 2 до 20 мкм носит название пыль, а более мелкие порошки называют пудрой.
Формы частиц в порошках: равноосные, волокнистые и плоские.
Порошки агрегативно и седиментационно неустойчивы и обладают специфическими свойствами: сыпучестью (текучестью), слипаемостью (слеживаемостью), гигроскопичностью, влажностью, распыляемостью и др.
Важное свойство порошков –– способность к гранулированию. Гранулирование –– процесс образования гранул шарообразной или цилиндрической формы.
Суспензии — это грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. Суспензии подобны по дисперсности порошками. Если порошок поместить в жидкость и перемешать, то получится суспензия, а при высушивании суспензии она снова превращается в порошок.
В зависимости от дисперсности твердой фазы суспензии подразделяют на грубые (размер частиц более 10–3 см) и тонкие (размер частиц от 10–3 до 10–5 см). Суспензии с вязкой дисперсионной средой называют мазями, а с высоким содержанием дисперсной фазы — пастами.
Суспензии характеризуются седиментационной неустойчивостью. По своим электрическим свойствам (возникновение ДЭС), агрегативной устойчивости и способности к электролитной коагуляции они имеют много общего с золями.
7.5. Физиологическое и медицинское эначение микрогетерогенных грубодисперсных систем
В жизни человека эмульсии занимают особое место. С первого дня своего существования человек получает жиры, являющиеся необходимой составной частью питания, в виде эмульсии — молока матери. Жиры нерастворимы в водной среде, составляющей основу жизнедеятельности организма, поэтому хорошо усваиваются только эмульгированные жиры — молоко, сметана, сливки, сливочное масло. Другие жиры, потребляемые с пищей (растительное масло, животные жиры), усваиваются только после перевода их в эмульгированное состояние в двенадцатиперстной кишке под действием барботирующегося через пищевую кашицу углекислого газа в присутствии эмульгаторов –– солей желчных кислот.
Немалое значение для человека имеют и аэрозоли, особенно биологические, дисперсная фаза которых содержит биологически активный субстрат в виде патогенных микроорганизмов или их токсинов. Такие аэрозоли возникают при испарении жидких или высыхании и подъеме с пылью сухих экскрементов больных животных и человека. Они образуются и при выделении больными воздушно-капельным путем возбудителей инфекционных заболеваний или бацилл. Биологические аэрозоли, содержащие пыльцу или споры растений, могут вызывать аллергические заболевания.
Определенное значение в медицинской практике имеют и пены. В частности, они образуются при травмах грудной клетки, сопровождающихся ранением легких. Воздух, выходящий из раненного легкого, вспенивает кровь, образующаяся пена закрывает операционное поле и мешает проведению операции.
Образование пены в легких всегда наблюдается при развитии отека легких, возникающего при левожелудочковой сердечной недостаточности, печеночной недостаточности, аллергическом шоке, травме черепа и других патологических состояниях. Пена вызывает обструкцию (закупорку) альвеол и бронхиол и острую дыхательную недостаточность.
Для гашения пены в легких используется или аэрозольная ингаляция или внутривенное введение 30%‑го этилового спирта и другие методы.
ЛЕКЦИЯ № 8
КОЛЛОИДНЫЕ ПАВ
Коллоидные ПАВ — длинноцепочечные дифильные органические соединения с числом атомов углерода в радикале от 10 до 20.
8.1. Классификация коллоидных ПАВ
Ионогеннные:
– анионные (поверхностно-активный анион): C17H33COONa, C8H17C6H4SO3Na;
– катионные (поверхностно-активный катион): [C18H37NH3]Cl,  ;
;
– амфолитные: NH2(CH2)12COOH, в зависимости от рН среды либо анион–, либо катион-активные.
Неионогенные:
R(OCH2CH2)nX, где R от 6 до 18 атомов С, n = 10 – 100, гидрофильная часть — (ОСН2СН2)n, Х = ОН, СООН и др.
8.2. Мицеллообразование в растворах коллоидных ПАВ
Растворимость коллоидных ПАВ невелика — 10-6 ¸ 10-3 моль/л. В результате малой растворимости при повышении концентрации происходит ассоциация молекул ПАВ, при определенной концентрации переходящая в мицеллообразование. Концентрация раствора ПАВ, при которой начинается мицеллообразование, называется критической концентрацией мицеллобразования (ККМ).

После формирования поверхностного слоя на границе раздела фаз раствор––воздух при дальнейшем повышении концентрации раствора начинается ассоциация углеводородных радикалов ПАВ, образующих ядро — практически жидкий углеводород. Полярные группы ПАВ образуют гидрофильную оболочку.

Образование мицеллы в водном растворе коллоидного ПАВ.
Движущая сила образования мицеллы — гидрофобные взаимодействия. Энтальпия взаимодействия радикалов ПАВ между собой меньше энтальпии взаимодействия их с водой, поэтому при образовании ядра мицеллы энтальпия системы уменьшается (D Н < 0).
Вокруг радикалов ПАВ, находящихся в неассоциированном состоянии, образуются упорядоченные структуры из молекул воды. При ассоциации радикалов ПАВ эти структуры разрушаются, энтропия системы повышается (D S > 0).
Энергия Гиббса системы D G = D H - T D S при этом уменьшается (D G < 0), следовательно, мицеллообразование термодинамически выгодно и идет самопроизвольно.
D G на 1 моль групп –СН2– составляет 2600 Дж/моль.
8.2.2. Строение мицелл коллоидных ПАВ в водных растворах
При концентрациях ПАВ, несколько превышающих ККМ, образуются сферические мицеллы с определенным числом агрегации (от 20 до 100), которое зависит от длины радикала и способности полярной части молекул образовывать гидрофильную оболочку мицелллы. Диаметр сферических мицелл примерно равен удвоенной длине молекул ПАВ.
В целом строение мицелл коллоидных ПАВ и двойных электрических слоев на них аналогичны строению мицелл неорганических золей и схему их строения можно записывать так же, как и для неорганических мицелл.
{[(C17H33COO-)n ∙ (n – x) Na+] ∙ x Na+}
Возможность изготавливать лекарственные формы нерастворимых в воде лекарственных веществ:инъекционные растворы гормонов взамен таблеток, водные растворы камфары вместо масляных, растворы барбитуратов, аспирина, каротина.
ЛЕКЦИЯ № 9
СТРУКТУРООБРАЗОВАНИЕ В ДИСПЕРСНЫХ СИСТЕМАХ И РАСТВОРАХ ВМС. РЕОЛОГИЧЕСКИЕ СВОЙСТВА ЗОЛЕЙ И РАСТВОРОВ ВМС
9.1. СТРУКТУРООБРАЗОВАНИЕ
Коллоидные дисперсные системы и растворы ВМС при некоторых условиях способны образовывать пространственные структуры.
Гели — коллоидные системы, потерявшие текучесть в результате образования в них внутренних структур; обычно эластичны, но могут быть и хрупкими.
Студни — растворы ВМС, потерявшие текучесть в результате образования в них внутренних структур, эластичны.
Гелеобразование — процесс превращения золей в гели.
Застудневание — процесс превращения растворов ВМС в студни.
Гели и студни — связнодисперсные системы.
Механизм гелеобразования
Образование структур в золях с частицами разной формы


| Коагуляционная структура (эластичный гель)
| Конденсационно-кристаллизационная структура (хрупкий гель)
|



 Суммарный избыток энергии молекул поверхности —свободная поверхностная энергия Гиббса Gs.
Суммарный избыток энергии молекул поверхности —свободная поверхностная энергия Гиббса Gs.

 ;
; 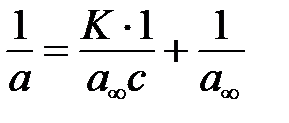
 от
от  ; тангенс угла наклона прямой относительно оси абсцисс равен
; тангенс угла наклона прямой относительно оси абсцисс равен  , а сама прямая отсекает на оси ординат отрезок равный
, а сама прямая отсекает на оси ординат отрезок равный  .
.

 между поверхностями жидкость—газ и твердое тело—жидкость –– краевой угол смачивания.
между поверхностями жидкость—газ и твердое тело—жидкость –– краевой угол смачивания.


 т. е. cos θ < 0; то поверхность не смачивается («плохое смачивание»)
т. е. cos θ < 0; то поверхность не смачивается («плохое смачивание») 1, для гидрофобных — β < 1. Для активированного угля β
1, для гидрофобных — β < 1. Для активированного угля β  0,4 (гидрофобная поверхность), для кварца β
0,4 (гидрофобная поверхность), для кварца β  2 (гидрофильная поверхность), для крахмала β
2 (гидрофильная поверхность), для крахмала β 

 AgCl↓ + KNO3
AgCl↓ + KNO3



 ;
;





