Цель работы: ознакомиться с методикой выполнения санитарно-бактерио-логического анализа.
5.1. Теоретическая часть
Одним из видов анализа природных вод является санитарно-бактериологический. При этом анализе определяются следующие показатели: микробное число, коли-титр, коли-индекс. Микробное число показывает общее количество бактерий в 1 мл воды, развивающихся на питательной среде - мясопептонном агаре (МПА) при t = 37±0,5°С в течение 24 ч. По ГОСТ 2874-73 микробное число не должно превышать 100.
Коли-титр показывает количество миллилитров воды, в котором содержится одна кишечная палочка Coli. По ГОСТ 2874-73 коли-титр должен быть не менее 300 мл. Эта величина, обратная коли-индексу, представляет собой следующее соотношение:
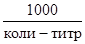
По ГОСТ 2874-73 коли-индекс не должен быть более 3.
К группе кишечной палочки относятся неспороносные, аэробные, грамотрицательные (не окрашиваются по Граму), оксидазоотрицательные бактерии, сбраживающие глюкозу с образованием альдегидов, кислоты и газа.
Эти виды микробов развиваются на фуксин-сульфитном мясопептонном агаре (среда Эндо) с образованием красных колоний с металлическим блеском или темно-красных и розовых с темным центром.
Механизм действия среды состоит в следующем: фуксин, содержащийся в среде, обесцвечивается добавляемым к среде сульфитом натрия и переходит при этом в бесцветное лейкосоединение. При выращивании кишечных палочек они разлагают имеющийся в среде молочный сахар или глюкозу с образованием альдегидов, которые вступают в реакцию с сульфитом натрия, при этом фуксин освобождается и восстанавливается его окраска.
5.2. Экспериментальная часть
Большое значение в санитарно-бактериологическом анализе имеет стерильность посуды и тех сред, которые используются при определении микробного числа и коли-титра.
Стерилизацию проводят за I-2 дня до работы.
Перед стерилизацией всю посуду для отбора проб воды (пипетки, пробирки, колбы) и выращивания колоний (чашки Петри) тщательно вымыть, высушить, закрыть ватными пробками, обернутыми в марлю (кроме чашек Петри) и завернуть каждую вещь отдельно в бумагу или уложить в бумажный пакет.
Стерилизация производится сухим жаром в сушильном шкафу в течение одного часа при температуре 160°С или путем обжига в пламени спиртовки. Фильтровальный прибор, кончики пипеток и пинцетов можно стерилизовать в племени ватного тампона, смоченного спиртом.
5.2.1. Определение микробного числа
Дляопределения микробного числа рекомендуется пользоваться готовой питательной средой - мясопептонным агаром (МПА), изготавливаемым в специальных учреждениях (институте Пастора или Институте питательных сред).
При отсутствии готовых питательных сред их изготавливают в лаборатории по следующей методике.
500 г мясного фарша без жира, костей и сухожилий, смешанного с 1 л дистиллированной воды, настаивают в течение 12 ч на холоде или 1 ч при 50-60°С. Затем мясную воду кипятят, отфильтровывают через марлю и доводят дистиллированной водой до 1 л.
К 1 л мясной воды добавляют 10 г пептона и 5 г хлористого натрия. Смесь нагревают до полного растворения пептона и соли. рН раствора доводят раствором соды до 7,2-7,4. Затем к 1 л мясопептонного бульона добавляют 15 г агара в волокнах или порошке, нагревают до полного его растворения, фильтруют в горячем виде через марлевый фильтр.
Полученный МПА разливают в пробирки (по 15 мл в каждую), закрывают их ватными пробками, обернутыми в марлю, и стерилизуют в автоклаве в течение 20 мин при 120±2°С.
Для определения микробного числа в загрязненной воде необходимо производить разбавление ее стерилизованной дистиллированной водой. Для этого дистиллированную воду наливают в пробирки (по 9 мл в каждую), закрывают ватными пробками, обернутыми марлей, и стерилизуют в автоклаве при 120±2°С в течение 20 мин. Срок хранения этой воды не должен превышать двух недель.
Разбавление загрязненной воды производится следующим образом. В пробирку с 9 мл стерильной дистиллированной воды вводят стерилизованной пипеткой 1 мл исследуемой воды. Затем из этого раствора другой стерилизованной пипеткой отбирают 1 мл и вводят в следующую пробирку с 9 мл стерильной воды и т.д.
Для определения микробного числа из водопроводной воды разбавления не требуется.
Методика выполнения этого определения следующая.
Перед отбором пробы из водопроводного крана спустить воду в течение 10-15 мин. Затем слегка обжечь на спиртовке или газовой горелке водопроводный кран и края стерильной колбы для отбора пробы. Объем исследуемой воды равен 500 мл.
В стерильные колбы до стерилизации необходимо ввести по 10 мг сульфита натрия для восстановления активного хлора, находящегося в водопроводной воде.
На водяной бане расплавить МПА, находящийся в пробирках, охладить его до 45±5°С.
Отобрать 1 мл исследуемой воды для посева на МПА. Для этого со стерильной пипетки снять оберточную бумагу, кончик пипетки обжечь в пламени спиртовки или газовой горелки, всосать исследуемую воду в пипетку через ватный фильтр, вложенный в ее широкую часть.
Воду перенести в чашку Петри со слегка приподнятой крышкой. Быстро смешать воду с МПА. При этом необходимо избегать попадания пузырьков воздуха во внутрь, а также растворе на края крышки. Воду с МПА следует смешивать, вращая чашку. Для определения микробного числа необходимо производить посев каждой воды в 2 чашках.
Чашки поставить на горизонтальную поверхность до затвердения среды. На чашках указать название пробы, разведение, если оно производилось, и дату посева.
После застывания среды чашки с посевами поставить вверх дном, друг на друга по 3-4 в стопке. Выращивание бактерий производить в термостате при 37°С в течение 24 ч. При инкубации чашек в термостате из каждой живой бактериальной клетки, содержащейся в исследуемой воде, вырастает колония клеток.
Через сутки после посева с помощью лупы, не открывая чашки, произвести счет колоний, выросших на поверхности и в глубине МПА. При подсчете колоний площадь чашки можно разделить восковым карандашом на четыре сектора и просуммировать число колоний в каждом секторе. Если общее число превышет 300, то счет можно вести с помощью миллиметровой бумаги, из которой вырезать несколько квадратов, каждый площадью в 1 см2. Определить среднее количество на 1 см2, умножив которое на площадь всей чашки, найти общее количество колоний в 1 мл. Для большей точности каждую подсчитанную колонию отметить со стороны дна чашки тушью. Результаты подсчета выразить средним количеством бактерий в 1мл по двум чашкам.
Микробное число = 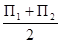 ,
,
где П1 и П2 -соответственно количество колоний в каждой чашке Петри.
5.2.2. Определение коли-титра и коли-индекса
При определении коли-титра рекомендуется использовать сухой агар Эндо, выпускаемый Институтом питательных сред, а также необходимо приготовить глюкозопептонную среду (среда Эндо) по следующей технологии.
В один литр дистиллированной воды внести 30 г пептона и 15 г хлорида натрия. Раствор довести до кипения, снять с огня, добавить 15 г чистой глюкозы. рН этого раствора равен 7,4-7,6 (проверить по рН-метру). Откорректировать рН можно подщелачиванием 4%-ным раствором NaОН. Затем добавить 6 мл 1,6%-ного раствора бромтимолового красителя. Приготовленный раствор разлить в три флакона по 33 мл и три пробирки по 3 мл. Еще в 3 пробирки налить по 5-6 мл раствора, состоящего из среды Эйкмана, разведенного дистиллированной водой в соотношении 1:3. На дно флаконов положить вату, на дно пробирок - поплавки, простерилизовать их.
После стерилизации для определения коли-титра в 3 флакона со средой Эйкмана вносятся по 100 мл исследуемой воды (методика отбора воды та же, что и при определении микробного числа), в 3 пробирки со средой Эйкмана - по 10 мл и в 3 пробирки с разведенной средой Эйкмана - по 1 мл.
ВСЯ ПОСУДА ДОЛЖНА БЫТЬ СТЕРИЛЬНА, ПИПЕТКИ, ПРОБКИ ОБОЖЖЁНЫ НАД ПЛАМЕНЕМ.
Подготовленные растворы термостатировать в течение суток при 37°С. Через сутки там, где присутствуют кишечные палочки, происходит изменение окраски за счет процесса брожения.
Из проб, где обнаружено брожение, сделать посевы на чашки Петри со средой Эндо. Посев производить петлей или стеклянной палочкой, стерилизованными над пламенем. Чашки Петри разделить восковым карандашом на 4 сектора, надписать (дата, из какого объема взята проба) и термостатировать сутки при 37°С.
Затем по нижеприведенной таблице определять коли-титр и коли-индекс.
Таблица



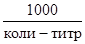
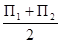 ,
,


