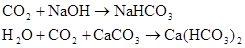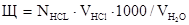ЗАДАНИЯ
1. Написать уравнение гидролиза соли А (если он возможен) в ионном и молекулярном виде.
2. Рассчитать рН растворов соли А концентраций М1 и М2.
3. Сделать вывод о влиянии разбавления раствора на сдвиг равновесия процесса гидролиза.
Исходные данные для расчета по вариантам представлены в таблице 2.1.
Таблица 2.1
| №
в-та
| Исходные данные
| Справочные данные
|
| Соль А,
формула
| Концентрация М, моль/л
| Формула электролита
| Числовые значения констант диссоциации при t 25°C
|
| М1
| М2
|
| 1
| К2CO3
| 0,1
| 0,01
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 2
| CH3COONa
| 0,1
| 0,001
| CH3COOH
| K=1,75×10-5
|
| 3
| NH4Cl
| 0,1
| 0,001
| NH4OH
| K=1,8×10-5
|
| 4
| Na2CO3
| 0,1
| 0,001
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 5
| (NH4)2SO4
| 0,1
| 0,01
| NH4OH
| K=1,8×10-5
|
| 6
| NaHCO3
| 0,1
| 0,01
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 7
| Na2CO3
| 0,1
| 0,001
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 8
| NaNO2
| 0,1
| 0,01
| HNO2
| K=4,0×10-4
|
| 9
| CH3COONa
| 0,1
| 0,01
| CH3COOH
| K=1,75×10-5
|
| 10
| NH4Cl
| 0,1
| 0,001
| NH4OH
| K=1,8×10-5
|
| 11
| K2S
| 0,1
| 0,001
| H2S
| K1=6,0×10-8; K2=1,0×10-14
|
| 12
| Na2SO3
| 0,1
| 0,001
| H2SO3
| K1=1,7×10-2; K2=6,2×10-8
|
| 13
| K2S
| 0,1
| 0,01
| H2S
| K1=6,0×10-8; K2=1,0×10-14
|
| 14
| Na2SO3
| 0,1
| 0,01
| H2SO3
| K1=1,7×10-2; K2=6,2×10-8
|
| 15
| Na2CO3
| 0,1
| 0,01
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 16
| NaHCO3
| 0,1
| 0,001
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 17
| NH4Cl
| 0,1
| 0,01
| NH4OH
| K=1,8×10-5
|
| 18
| CH3COONa
| 0,1
| 0,01
| CH3COOH
| K=1,75×10-5
|
| 19
| (NH4)2SO4
| 0,1
| 0,001
| NH4OH
| K=1,8×10-5
|
| 20
| (NH4)2SO4
| 0,1
| 0,01
| NH4OH
| K=1,8×10-5
|
| 21
| K2S
| 0,1
| 0,01
| H2S
| K1=6,0×10-8; K2=1,0×10-14
|
| 22
| NaHCO3
| 0,1
| 0,001
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 23
| К2CO3
| 0,1
| 0,001
| H2CO3
| K1=4,3×10-7; K2=5,6×10-11
|
| 24
| K2S
| 0,1
| 0,01
| H2S
| K1=6,0×10-8; K2=1,0×10-14
|
| 25
| Na2S
| 0,1
| 0,01
| H2S
| K1=6,0×10-8; K2=1,0×10-14
|
| 26
| (NH4)2SO4
| 0,1
| 0,001
| NH4OH
| K=1,8×10-5
|
| 27
| Na2SO3
| 0,1
| 0,01
| H2SO3
| K1=1,7×10-2; K2=6,2×10-8
|
| 28
| CH3COONa
| 0,1
| 0,01
| CH3COOH
| K=1,75×10-5
|
| 29
| Na2SO3
| 0,1
| 0,001
| H2SO3
| K1=1,7×10-2; K2=6,2×10-8
|
| 30
| CH3COONa
| 0,1
| 0,01
| CH3COOH
| K=1,75×10-5
|
ПРИМЕР РАСЧЕТА
Рассчитать рН 0,01 М раствора соли Na2CO3.
Решение
Уравнение гидролиза соли по I ступени:
Na2CO3 + H2O ® NaHCO3 + NaOH
CO32- + HOH ® HCO3- + OH-
Расчет константы гидролиза соли концентрации 0,01 М:
Кг = 
Кг = 
 моль/л
моль/л

рН = 12 – lg 7,7 = 11,3
Аналогично рассчитать рН раствора соли другой концентрации и, сравнив полученные значения, сделать вывод о направлении смещения равновесия при разбавлении раствора.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Определение рН раствора соли производится электрометрическим методом с помощью преобразователя ионометрического И-500.
Электрометрический метод определения рН основан на измерении электродвижущей силы гальванической цепи, составленной из двух электродов, одним из которых является электрод с известным потенциалом, или стандартный электрод, или электрод сравнения, а вторым – электрод, величина потенциала которого зависит от концентрации ионов водорода в исследуемом растворе.
Выполнение эксперимента производится в следующем порядке:
1. Приготовить раствор соли А заданной по номеру варианта концентрации М2 из раствора соли с исходной концентрацией М1.
Для этого в мерную колбу на 50 мл внести пипеткой необходимое количество исходного раствора соли с концентрацией 0,1М, а, именно, - 5 мл, если требуется разбавление в 10 раз, и 0,5 мл, если требуется разбавление в 100 раз. Долить в раствор до метки дистиллированную воду, перемешать содержимое колбы.
2. Измерить рН исходного и разбавленного растворов соли на рН-метре. Перед началом измерений электроды должны быть опущены в дистиллированную воду, резиновый ободок на электроде поднят вверх, чтобы было открыто отверстие.
Выполнение измерений производится в следующем порядке:
2.1. Вынуть электроды из стакана с дистиллированной водой, промокнуть их фильтровальной бумагой и опустить в стакан с исследуемым раствором на глубину не менее 20 мм.
2.2. Включить прибор кратким (0,5 сек) нажатием клавиши 0/1. На дисплее появятся надписи «измерение» и «параметры».
2.3. Нажать клавишу ¿, преобразователь переходит в режим измерения. На дисплее высвечиваются обозначения Т и рН и вскоре появляются значения этих параметров, Записать значения параметров в таблицу 2.
2.4. Выключить прибор нажатием клавиши 0/1.
2.5. Вынуть электроды из раствора, осторожно промокнуть, опустить в следующий исследуемый раствор и провести операцию по п.п. 2.1-2.4.
Таблица 2.2
| № варианта
| № измерения
| Соль А
| Значение рН
| Концентрация ионов, моль/л
|
| Формула
| Концентрация М, моль/л
| Экспериментальное
| Расчетное
| Экспериментальная
| Расчетная
|
| [H+]
| [OH-]
| [H+]
| [OH-]
|
|
|
|
|
|
|
|
|
|
|
|
3. ОТЧЕТ О РАБОТЕ
Отчет должен включать:
- наименование, цель работы;
- расчеты по заданию (по варианту таблицы 2.1);
- результаты измерений и расчетов (таблица 2.2);
- выводы по работе.
ЛАБОРАТОРНАЯ РАБОТА № 3
щелочность и кислотность природных вод
Цель работы: познакомиться с видами кислотности и щелочности природных вод и определением их методом титрования.
3.1. Теоретическая часть
Щелочность природных вод чаще всего обусловлена гидролизом солей, образованных угольной кислотой (бикарбонатов и карбонатов) и сильными основаниями. Реже в природных водах встречаются соли других слабых кислот (борной, кремниевой и т.п.), которые также придают щелочную реакцию среде. Гидролиз таких солей соответствует равновесиям, описываемым следующими уравнениями:

При гидролизе солей сильных кислот и слабых оснований, находящихся в природных водах, образуется кислая среда.
Между концентрацией (активностью) водородных и гидроксильных ионов в природных водах существует определенное соотношение, количественно связанное с концентрацией свободной углекислоты, бикарбонатов и карбонатов, которое отвечает определенным требованиям рН. Это соотношение выражается представленным ниже графиком, рассчитанным по значениям констант диссоциации угольной кислоты (рисунок).
Так, при рН = 0-4 в природных водах могут находиться сильные минеральные кислоты; при рН = 4-8,36 - угольная кислота в равновесии с бикарбонатами; при рН = 8,36-12 - бикарбонаты в равновесии с карбонатами; при рН = 12-14 - сильные основания.
Равновесия между угольной кислотой и бикарбонатами, а также бикарбонатами и карбонатами могут быть описаны следующими уравнениями, каждому из которых соответствуют константы равновесия, являющиеся константами диссоциации угольной кислоты по I и II ступеням:

Исходя из этих констант и рН воды, можно рассчитать соотношения между концентрациями ионов.
При определении кислотности и щелочности природных вод могут быть следующие варианты.
3.1.1. При добавлении к пробе воды двух - трех капель раствора фенолфталеина он не окрашивается в малиновый цвет, а при добавлении нескольких капель смешанного индикатора последний приобретает фиолетовую окраску. В этом случае рН среды лежит в интервале от 0 до 4, т.е. в воде содержатся сильные минеральные кислоты. Для определения их концентрации необходимо определенный объем исследуемой воды оттитровать раствором щелочи строго определенной концентрации до перехода фиолетовой окраски в серо-голубую и рассчитать кислотность по следующей формуле, мэ/л:
Кислотность =  ,
,
где Nщ - нормальность щелочи, э/л; Vщ- объем щелочи, мл;  - объем исследуемой воды.
- объем исследуемой воды.
3.1.2. При добавлении к пробе воды двух - трех капель фенолфталеина окраска его не изменяется, а при добавлении нескольких капель смешанного индикатора он окрашивается в зеленый цвет. В этом случае рН среды лежит в интервале от 4 до 8,36. В воде содержится свободная углекислота СО2 в равновесии с бикарбонатными ионами  и водородными ионами. Концентрация угольной кислоты (или других слабых кислот) определяется титрованием пробы воды в присутствии фенолфталеина раствором щелочи до появления малинового окрашивания и рассчитывается по следующей формуле, мэ/л:
и водородными ионами. Концентрация угольной кислоты (или других слабых кислот) определяется титрованием пробы воды в присутствии фенолфталеина раствором щелочи до появления малинового окрашивания и рассчитывается по следующей формуле, мэ/л:
[CO2] = 
Реакция в этом случае протекает по уравнению:

Концентрацию бикарбонатных ионов определяют в отдельной пробе воды титрованием раствором соляной кислоты в присутствии смешанного индикатора до перехода зеленой окраски в серо-голубую и рассчитывают по следующей формуле, мэ/л:
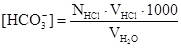 ,
,
где NHCl - нормальность раствора соляной кислоты, э/л;
VHCl- объем раствора соляной кислоты, пошедшего на титрование, мл.
Реакция в этом случае протекает по уравнению

3.1.3. При добавлении к пробе 2-3 капель раствора фенолфталеина он окрашивается в малиновый цвет, а смешанный индикатор приобретает зеленое окрашивание. Значение рН в этом случае находится в интервале от 8,36 до 14. Данная вода может содержать либо бикарбонатные ионы в равновесии с карбонатными и водородными, либо только карбонатные и гидроксильные, либо только гидроксильные.
Концентрацию этих ионов определяют последовательным титрованием пробы воды в присутствии фенолфталеина раствором соляной кислоты до обесцвечивания малиновой окраски, а затем, добавляя несколько капель смотанного индикатора, продолжают титровать до перехода зеленого окрашивания в серовато-голубой. При этом могут быть следующие варианты:
- если при титровании по фенолфталеину расходуется определенный объем соляной кислоты, а по смешанному индикатору кислота не расходуется, то в воде содержатся только сильные щелочи, обусловливающие только гидратную щелочность. Ее рассчитывают по следующей формуле, мэ/л:
Щг = 
При этом реакция происходит по следующему уравнению:

- если при последовательном титровании по фенолфталеину и по смешанному индикатору расходуется одинаковое количество миллиэквивалентов кислоты, то в этом случае вода содержит только карбонатные ионы  , обуславливающие карбонатную щелочность.
, обуславливающие карбонатную щелочность.
При этом происходят процессы по следующим схемам:


Щелочность карбонатная рассчитывается по формуле, мэ/л:
Щк = 2 × 
- если при последовательном титровании по фенолфталеину расходуется большее количество миллиэквивалентов кислоты, чем по смешанному индикатору, то вода обладает гидратной и карбонатной щелочностью. При этом щелочность карбонатная рассчитывается по приведенной выше формуле, а щелочность гидратная – по следующей, мэ/л:
Щг =  ,
,
где V1 – объем раствора соляной кислоты, пошедшей на титрование по фенолфталеину,
мл;
V2 – объем раствора соляной кислоты, пошедшей на титрование по смешанному
индикатору, мл.
Общая щелочность в этом случае равна: Що = Щк + Щг.
- если при последовательном титровании по фенолфталеину расходуется меньшее количество миллиэквивалентов соляной кислоты, чем по смешанному индикатору, то вода обладает карбонатной и бикарбонатной щелочностью. При этом щелочность карбонатная рассчитывается по приведенной выше формуле, а щелочность бикарбонатная – по следующей, мэ/л:
Щг =  ,
,
Общая щелочность в этом случае равна: Що = Щк + Щб.
При определении щелочности можно использовать вместо смешанного индикатора метилоранж, расчет по которому производится аналогично вышеприведенным.
3.2. Экспериментальная часть
3.2.1. Получить у преподавателя набор проб исследуемой воды. В отдельные пробирки налить по 2-3 мл каждой из них и добавить по 2-3 капли раствора фенолфталеина.
3.2.2. Те воды, в которых фенолфталеин окрасился в малиновый цвет, оттитровать раствором соляной кислоты. Для этого отобрать 100 мл исследуемой воды в коническую колбу для титрования, добавить 2-3 капли раствора фенолфталеина и титровать воду раствором соляной кислоты до обесцвечивания. Измерить объем кислоты, пошедший на титрование, и рассчитать количество миллиэквивалентов ее Ф, приходящееся на 1 литр исследуемой воды, по формуле, мэ/л:
Ф = NHCl × VHCl × 10
Затем добавить 2-3 капли смешанного раствора индикатора в обесцвеченный раствор и продолжать титрование его раствором соляной кислоты до перехода зеленой окраски в серо-голубую. Измерить объем раствора кислоты и рассчитать количество миллиэквивалентов ее С, пошедшее на титрование 1 литра исследуемой воды по смешанному индикатору, по формуле, мэ/л:
C = NHCl × VHCl × 10
Сравнить соотношения между Ф и С. Исходя из пункта 1.3, сделать вывод о видах щелочности в этих водах и рассчитать Щг, Щк, Щб и Що.
3.2.3. В те воды, в которых фенолфталеин не окрасился в малиновый цвет, добавить по 2-3 капли смешанного индикатора. Те пробы, в которых раствор приобрел фиолетовый цвет, оттитровать раствором щелочи. Для этого отобрать в коническую колбу для титрования 100 мл исследуемой воды, добавить 2-3 капли смешанного индикатора и оттитровать ее раствором щелочи до перехода фиолетового окрашивания в серо-голубое.
По формуле п. 1.1 определить кислотность воды.
3.2.4. Те воды, в которых смешанный индикатор окрасился в зеленый цвет, оттитровать раствором соляной кислоты.
Для этого в коническую колбу для титрования отобрать 100 мл исследуемой воды, добавить 2-3 капли смешанного индикатора и оттитровать их раствором соляной кислоты до перехода зеленого окрашивания в серо-голубой. Рассчитать концентрацию бикарбонатных ионов по п. 1.1.2.
3.2.5. Взять 100 мл той же воды, добавить 2-3 капли раствора фенолфталеина и оттитровать ее раствором щелочи до появления слабого малинового окрашивания. Рассчитать концентрацию свободной углекислоты по п. 1.1.2, замерив объем израсходованного раствора щелочи.
3.2.6. Проверить у преподавателя полученные результаты и составить отчет о работе.
ЛАБОРАТОРНАЯ РАБОТА № 4
СТАБИЛЬНОСТЬ ПРИРОДНЫХ ВОД
Цель работы: ознакомиться с методами определения стабильности природных вод.
4.1. Теоретическая часть
Одним из технологических показателей природных вод является стабильность.
Стабильностью воды называется способность ее при длительном хранении и транспортировке по трубопроводам сохранять постоянный состав. Стабильная вода не выделяет и не растворяет карбонат кальция CaCO3. Она зависит от концентрации свободной углекислоты СО2 и гидрокарбонатов кальция и магния.
При контакте воды, содержащей растворенную углекислоту, с карбонатом кальция устанавливается равновесие:

Кравновесия =  = 3,43 × 10-5.
= 3,43 × 10-5.
Если учесть, что [Са2] = 1/2  (из уравнения равновесия), то
(из уравнения равновесия), то
Кравн. = 
Та концентрация [CO2], которая отвечает равновесию, называется равновесной, а такая вода – стабильной. Если [CO2] исследуемой воды больше [CO2] равновесной, то происходит растворение карбоната кальция. Такая вода называется агрессивной. Агрессивная углекислота может вызывать коррозию металлических, бетонных и железобетонных сооружений. Если [CO2] исследуемой воды меньше [CO2] равновесной, то из воды выделяется карбонат кальция. Такая вода называется нестабильной. Отложение карбоната кальция из нестабильной воды способствует забиванию трубопроводов, а впоследствии и углекислотной коррозии бетонов, а также, если при этом происходят биологические обрастания поверхностей, и электрохимической коррозии стали при неравномерной аэрации.
Количественной характеристикой стабильности воды является показатель стабильности, который может быть рассчитан либо по щелочности исследуемой воды, либо по измерению ее рН.
Показатель стабильности представляет собой отношение щелочности или рН исследуемой воды к щелочности или рН этой же вода, насыщенной СаСО3.


Если Ст > 1 - вода агрессивна; если Cт < 1 - вода нестабильна; если Ст = 1 - вода стабильна.
Методы стабилизации заключаются в следующем:
Нестабильную воду подкисляют сильными кислотами

Агрессивную воду обрабатывают едким натром (гидроксидом натрия) или карбонатными солями для удаления избыточной углекислоты:
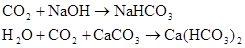
Агрессивную воду можно стабилизировать фильтрованием через карбонатные минералы (мел, известняк, мраморную крошку) или песчано-известковые фильтры.
4.2. Экспериментальная часть
4.2.1. Определение стабильности воды по измерению рН
Получить у преподавателя задание - пробу исследуемой воды.
Измерить ее рН с помощью рН-метра.
Налить в коническую колбу заданный объем исследуемой воды (50-100 мл) и всыпать в нее карбонат кальция до насыщения. Перемешивать воду с СаСО3 в течение 25-30 мин.
Отфильтровать оставшийся осадок. После насыщения измерить рН полученного раствора.
Рассчитать показатель стабильности по следующей формуле:

Сделать вывод о стабильности воды.
4.2.2. Определение стабильности по изменению щелочности исследуемой воды
Отмерить заданный объем исследуемой воды (50 или 100 мл), влить ее в коническую колбу для титрования, добавить 2-3 капли смешанного индикатора на  , который в щелочной среде окрашивается в зеленый цвет.
, который в щелочной среде окрашивается в зеленый цвет.
Титровать зеленый раствор 0,1 Н раствором НСl до перехода его в серо-голубой.
Отметить объем кислота, пошедшей на титрование, и рассчитать щелочность воды, исходя из закона эквивалентов:
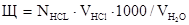
Отмерить такой же объем исследуемой вода, добавить карбонат кальция и перемешивать содержимое в течение 25-30 мин до насыщения воды карбонатом кальция, отфильтровать оставшийся осадок СаСО3.
Определить щелочность в фильтрованном растворе.
Рассчитать показатель стабильности исходя из щелочности последующей формуле:

Сделать вывод о стабильности воды.
ЛАБОРАТОРНАЯ РАБОТА № 5
РАСЧЕТНЫЕ ЗАДАЧИ
№ 1. Определить все виды жесткости воды, если в объеме воды V, л, содержится А мг Са2+, В мг Mg2+, С мг НСО3-.
№ 2. Определить жесткость и нормальность водного раствора, если в воде объемом V, л, содержится А мг Са2+ и В мг Mg2+.
№ 3. Определить остаточную жесткость воды, если к воде объемом V, л, с содержанием А мг Са2+ и В мг Mg2+ прибавили m мг реагента Р.
№ 4. Определить массу (граммов) выпавшего осадка после реагентного умягчения воды, если к пробе воды объемом V, л, и содержанием А мг Са2+ прибавили m мг реагента Р.
№ 5. Определить остаточную жесткость воды после кипячения с исходным содержанием в V л воды А мг Са2+, В мг Mg2+, С мг НСО3-.
№ 6. Определить остаточную жесткость воды с исходным содержанием в V, л воды А мг Са2+, В мг Mg2+ после прибавления к данной пробе воды m мг реагента Р.
Таблица 9.1
Варианты задания
| № варианта
| №
задач
| Исходные данные
|
| Объем воды V, л
| Содержание в воде, мг
| Реагент (Р) для умягчения
|
| А (Са2+)
| В (Mg2+)
| C (HCO3-)
| Наиме-нование
| Масса (mp), мг
|
| 1
| 1, 3, 5
| 1,250
| 60
| 40
| 122
| Na2CO3
| 106
|
| 2
| 2, 4, 6
| 0,400
| 30
| 12
| 61
| Ba(OH)2
| 159
|
| 3
| 1, 2, 5
| 0,300
| 10
| 8
| 20
| Na3PO4
| 53
|
| 4
| 2, 3, 6
| 1,200
| 100
| 60
| 500
| Ba(OH)2
| 100
|
| 5
| 2, 4, 5
| 0,600
| 50
| 20
| 50
| Na2CO3
| 106
|
| 6
| 3, 5, 6
| 0,750
| 60
| 40
| 100
| Na2CO3
| 106
|
| 7
| 1, 3, 6
| 2,200
| 200
| 100
| 400
| Na3PO4
| 150
|
| 8
| 1, 4, 5
| 0,500
| 20
| 10
| 40
| Ba(OH)2
| 80
|
| 9
| 2, 4, 5
| 2,300
| 300
| 150
| 366
| Na2CO3
| 212
|
| 10
| 1, 4, 5
| 1,300
| 200
| 100
| 400
| Na2CO3
| 159
|
| 11
| 2, 3, 6
| 0,700
| 15
| 10
| 244
| Na3PO4
| 50
|
| 12
| 3, 4, 5
| 0,800
| 40
| 20
| 30
| Ba(OH)2
| 70
|
| 13
| 2, 3, 6
| 1,200
| 30
| 30
| 600
| Ba(OH)2
| 100
|
| 14
| 4, 5, 6
| 0,900
| 20
| 15
| 30
| Na2CO3
| 53
|
| 15
| 1, 5, 6
| 0,200
| 5
| 4
| 10
| Na2CO3
| 40
|
| 16
| 1, 2, 4
| 0,350
| 8
| 6
| 18
| Na2CO3
| 20
|
| 17
| 1, 5, 6
| 1,100
| 20
| 45
| 40
| Na3PO4
| 75
|
| 18
| 2, 4, 5
| 0,300
| 15
| 20
| 30
| Ba(OH)2
| 40
|
| 19
| 1, 2, 5
| 0,450
| 20
| 15
| 30
| Ba(OH)2
| 40
|
| 20
| 3, 4, 6
| 1,600
| 30
| 60
| 244
| Na3PO4
| 120
|
| 21
| 1, 3, 6
| 0,850
| 50
| 30
| 122
| Na3PO4
| 80
|
| 22
| 2, 4, 5
| 2,500
| 120
| 200
| 366
| Na2CO3
| 300
|
| 23
| 3, 5, 6
| 0,300
| 20
| 10
| 80
| Ba(OH)2
| 50
|
| 24
| 1, 3, 5
| 0,600
| 30
| 24
| 120
| Ba(OH)2
| 90
|
| 25
| 2, 4, 6
| 0,850
| 40
| 36
| 122
| Na3PO4
| 100
|
| 26
| 1, 2, 5
| 1,000
| 60
| 12
| 183
| Na2CO3
| 159
|
| 27
| 3, 5, 6
| 0,600
| 30
| 36
| 122
| Na2CO3
| 53
|
| 28
| 1, 2, 3
| 0,700
| 70
| 48
| 100
| Na3PO4
| 70
|
| 29
| 2, 3, 5
| 2,250
| 200
| 72
| 427
| Na3PO4
| 60
|
| 30
| 2, 4, 6
| 0,300
| 20
| 24
| 61
| Ba(OH)2
| 40
|
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Определение жесткости воды (концентрации солей кальция и магния) производится потенциометрическим методом с помощью ионоселективного электрода «Эком – Са+Mg» на анализаторе «Эксперт-001-3».
Метод заключается в измерении разности потенциалов (ЭДС) измерительного электрода и электрода сравнения ЭВЛ-1-М3.1. В основу работы анализатора положен метод построения градуировочного графика зависимости ЭДС электродной системы от концентраций градуировочных (стандартных) растворов с известной концентрацией и последующего нахождения концентрации анализируемого раствора.
Измерение жесткости производится в следующем порядке:
1. В мерный стакан налить 45 мл исследуемого раствора.
2. Определить рН исследуемого раствора (допустимый диапазон рН = 7 ¸ 10).
3. Прилить к исследуемому раствору с помощью бюретки 5 мл фонового раствора (0,1 М раствор KCl). Тщательно перемешать.
4. Опустить электроды в стакан с исследуемым раствором на глубину не менее 20 мм.
5. Включить прибор (кнопка «вкл.»); на дисплее появится надпись «Выбор режима. РН-метр-иономер»/
6. Нажать кнопку «ион» и кнопками < и > выбрать из списка ионов ионы «Ca-Mg», на дисплее появится надпись «Са-Mg».
7. Нажать кнопку «ввод», на экране появится надпись «рН-метр-иономер».
8. Нажать кнопку «изм.» (при этом на дисплее появится надпись «Са-Мg» и время измерения), затем нажать кнопку «М» (выдается результат в ммоль/л). Перевести полученный результат в единицы жесткости. Записать результат в таблицу 2.
9. После записи результата нажать кнопку «отм», при этом снова входим в режим «рН-метр-иономер», и прибор готов к следующему измерению.
10. Для устранения жесткости в данном объеме рассчитать количество Na2CO3 и добавить в стаканчик с исследуемым раствором, перемешать в течение 2-3 минут и провести экспериментальное измерение остаточной жесткости воды по п.п. 4-8. Результаты записать в таблицу 9.2.
11. Провести теоретический расчет остаточной жесткости после умягчения данной пробы воды предложенным реагентом.
Таблица 9.2
Экспериментальное определение жесткости воды
| Исходные данные
| Результаты эксперименталь-ного определения жесткости
| Теоретическое * определение остаточной жесткости
|
| № пробы
| V воды, л
| Реагент
| Жисх. до умягчения, мэкв/л
| Жост. после умягчения, мэкв/л
| Устранимая Жр, мэкв/л
Жр=mр/Эр×V
| Остаточная жесткость Жост., мэкв/л
Жост. = Жисх.-Жр
|
| Наименование
| Эквивалентная масса реагента, Эр
| Масса (mр),
мг
|
|
|
|
|
|
|
|
|
|
|
* Привести пояснения к теоретическому определению остаточной жесткости:
a) расчет эквивалентной массы реагента;
b) расчет устранимой жесткости исходной пробы воды;
c) расчет остаточной жесткости воды.
3. ОТЧЕТ О РАБОТЕ
Отчет должен включать:
- наименование, цель работы;
- расчеты по заданию (на основании таблицы 9.1);
- результаты измерений и расчетов (таблица 9.2);
- выводы по работе.
ЛАБОРАТОРНАЯ РАБОТА №10
Для просмотра мукоровых грибов следует осторожно взять препаровальной иглой небольшое количество мицелия и другой препаровальной иглой снять его на сухое предметно стекло. Препарат сначала рассматривают без покровного стекла при малом увеличении микроскопа. Видны спорангиеносцы, и круглые темные шарики на их концах — спорангии. Обычно они покрыты тонкими шипами из кристаллов оксалата кальция. Затем на поверхность препарата наносят каплю воды, накрывают его покровным стеклом. Оболочка спорангия при этом разрушается, и споры выпадают. Препарат рассматривают последовательно при малом и большом увеличениях (без иммерсии).
Представители рода Мисог могут быть выделены из почвы при посеве пылевидных ее частиц на поверхность сусло-агара в чашках Петри или из свежего конского навоза, помещенного на 3—4 дня под стеклянный колпак на тарелку с влажной фильтровальной бумагой или сырым песком.
Аскомицеты, или сумчатые грибы. Высшие грибы с многоклеточным или членистым мицелием, образующие споры в сумках — асках. Они включают представителей эуаскомицетов (истинных аскомицетов), у которых сумки со спорами формируются в результате полового процесса на поверхности или внутри плодовых тел, образуемых сплетением гиф мицелия (возможно бесполое размножение экзогенно возникающими спорами — конидиями), и гемиаскомицетов, у которых плодовые тела отсутствуют. К гемиаскомицетам относят большинство дрожжей, рассматриваемых отдельно.
Эуаскомицеты включают два важнейших рода почвенных грибов — Penicillium и Aspergillus, которых нередко называв также плесневыми грибами. К группе плесневых относят и некоторых представителей зигомицетов и несовершенных грибов.
Пенициллы и аспергиллы имеют хорошо развитый многоклеточный мицелий. Размножаются преимущественно конидиальным спороношением. Наблюдаются в виде налета голубого, зеленого, сизого, реже других цветов на продуктах растительного происхождения (варенье, томатной пасте, лимонах и апельсинах), отсыревших изделиях из кожи, обоях. Распространены в верхних горизонтах почвы.
Грибы рода Penicillium называют кистевиками, так как они образуют конидии на концах мутовчаторазветвленных конидиеносцев, напоминающих кисть руки. Иногда отдельный пучок конидиеносцев, выходящих из одной точки и отчленяющих конидии, напоминает рисовальные кисти.
Для рассмотрения строения конидиеносцев Penicillium glaucum препаровальной иглой вырезают кусочек мицелия (приблизительно 0,5 мм2) на границе между его зеленым и белым участками. (Гриб к занятию выращивают в чашке Петри; старые грибы с полностью зеленым мицелием не годятся для просмотра.) Осторожно с помощью двух препаровальных игл кусочек мицелия снимают со среды и помещают в каплю воды на предметное стекло. Сверху на мицелий кладут покровное стекло. Поскольку мицелиальная пленка гриба довольно толстая, может получиться так, что под покровным стеклом вода не будет целиком окружать исследуемый мицелий. В этом случае надо из капельницы добавлять воду под покровное стекло до тех пор, пока кусочек мицелия не будет со всех сторон окружен водой. Затем слегка надавливают на покровное стекло в центре стеклянной палочкой (или препаровальной иглой). Избыток воды можно удалить фильтровальной бумагой.
Препарат сначала просматривают при малом увеличении, уделяя основное внимание его краям, так как на них обычно хорошо видны кисти конидиеносцев. Когда подходящий участок найден, переходят с объектива 8х на объектив 40х и детально рассматривают кисточки. Во время просмотра при малом увеличении конденсор опускают, при переводе на объектив 40х снова регулируют освещенность поднятием конденсора.
Aspergillus, или леечная плесень, имеет обычно одноклеточные конидиеносцы шаровидно, булавовидно или грушевидно вздутые. На них располагаются параллельно друг другу короткие кеглеобразные стеригмы, каждая из которых отшнуровывает радиально цепочки конидий. Некоторые виды аспергиллов имеют два ряда стеригм. Вся головка конидиеносца с радиально расходящимися цепочками конидий напоминает наконечник лейки со струйками воды.
Для ознакомления со строением конидиеносцев аспергилла на примере Aspergillus niger препаровальной иглой берут небольшое количество мицелия на границе между черным и коричнево-бурым участками колонии и вносят в каплю воды на предметном стекле. Далее поступают так же, как и при просмотре пеницилла. В начальной стадии спорообразования Aspergillus похож на Мисог (бесцветные головки), затем с возрастом головки покрываются стеригмами, на которых развиваются споры. В результате получаются так называемые кудрявые головки. От мукора аспергилл всегда можно отличить наличием таких головок. У мукора головки гладкие — «лысые», так как споры его эндогенного происхождения (внутренние), а у аспергилла и пеницилла — экзогенные споры (внешние).
Дрожжи. По современным представлениям, дрожжи — это сборная группа одноклеточных микроскопических организмов, относящихся к разным классам грибов, преимущественно — к классу аскомицетов.
Диаметр клеток дрожжей колеблется от 8 до 15 мкм. Форма их разнообразна: эллипсовидная, грушевидная, округлая, цилиндрическая. Размножаются вегетативным и половым путем. Вегетативные способы размножения — почкование и деление; половой способ размножения связан с образованием спор. К почкующимся дрожжам относятся представители «культурных» дрожжей рода Saccharomyces (сахаромицеты), к делящимся — виды рода Schizosaccharomyces (шизосахаромицеты). При половом процессе слияние вегетативных клеток ведет к образованию сумок со спорами или сначала могут сформироваться споры, которые в последующем копулируют друг с другом. В каждой сумке образуется от 2 до 8, иногда 12 спор. Среди дрожжей есть аспорогенные, ложные дрожжи, не способные к половому процессу и спорообразованию. Они относятся к классу несовершенных грибов.
С делящимися дрожжами можно познакомиться на примере Schizosaccharomyces pombe (schizo — рваться, делиться, saccharomyces — сахарный гриб, pombe — название африканского напитка, из которого этот организм выделен). Дрожжам размножение делением несвойственно, поэтому данный род дрожжей является отклонением от нормы. Шизосахаромицеты размножаются и половым путем, связанным со спорообразованием, что характерно для сумчатых грибов. Schizosaccharomyces pombe рассматривают на фиксированных, окрашенных фуксином препаратах. Это цилиндрической формы крупные клетки с округлыми концами. Размножение делением свойственно также дрожжам Рода Endomyces. Из почкующихся дрожжей наиболее «одомашне





 моль/л
моль/л


 ,
, - объем исследуемой воды.
- объем исследуемой воды. и водородными ионами. Концентрация угольной кислоты (или других слабых кислот) определяется титрованием пробы воды в присутствии фенолфталеина раствором щелочи до появления малинового окрашивания и рассчитывается по следующей формуле, мэ/л:
и водородными ионами. Концентрация угольной кислоты (или других слабых кислот) определяется титрованием пробы воды в присутствии фенолфталеина раствором щелочи до появления малинового окрашивания и рассчитывается по следующей формуле, мэ/л:

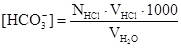 ,
,


 , обуславливающие карбонатную щелочность.
, обуславливающие карбонатную щелочность.


 ,
, ,
,
 = 3,43 × 10-5.
= 3,43 × 10-5. (из уравнения равновесия), то
(из уравнения равновесия), то