

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Основная статья: Термодинамические потенциалы идеального газа
Выражая CV в терминах ĉV как было показано в предыдущем разделе, дифференцируя уравнение состояния идеального газа и интегрируя можно получить выражение энтропии[77]:
Δ S = c ^ V N k ln (T T 0) + N k ln (V V 0), {\displaystyle \Delta S={\hat {c}}_{V}Nk\ln \left({\frac {T}{T_{0}}}\right)+Nk\ln \left({\frac {V}{V_{0}}}\right),}
Данное выражение, после ряда преобразований позволяет получить термодинамические потенциалы для идеального газа как функции T, V, и N в виде[78]:
| U {\displaystyle U\,} | = c ^ V N k T {\displaystyle ={\hat {c}}_{V}NkT\,} | |
| A {\displaystyle A\,} | = U − T S {\displaystyle =U-TS\,} | = μ N − N k T {\displaystyle =\mu N-NkT\,} |
| H {\displaystyle H\,} | = U + P V {\displaystyle =U+PV\,} | = c ^ P N k T {\displaystyle ={\hat {c}}_{P}NkT\,} |
| G {\displaystyle G\,} | = U + P V − T S {\displaystyle =U+PV-TS\,} | = μ N {\displaystyle =\mu N\,} |
где, как и раньше,
c ^ P = c ^ V + 1. {\displaystyle {\hat {c}}_{P}={\hat {c}}_{V}+1.}
Применение теории идеального газа
Физический смысл температуры газа
Основная статья: Температура
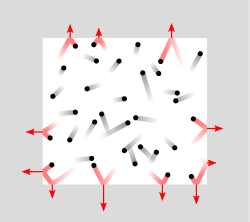
Давление, как процесс передачи импульса молекул газа стенкам сосуда
В рамках молекулярно-кинетической теории давление молекул газа на стенку сосуда p = F S {\displaystyle p={\frac {F}{S}}} равно отношению силы F {\displaystyle F}, действующей на стенку со стороны молекул, к площади стенки S {\displaystyle S}. Силу можно вычислить как отношение суммарного импульса K {\displaystyle K}, переданного стенке при столкновениях молекул за время Δ t {\displaystyle \Delta t}, к длительности этого интервала:
p = K S Δ t. {\displaystyle p={\frac {K}{S\Delta t}}.\qquad \qquad } (1)
При упругом соударении молекула массы m {\displaystyle m} передаёт стенке импульс
k m = 2 m v cos ϑ, {\displaystyle k_{m}=2mv\cos \vartheta,\qquad \qquad } (2)
где ϑ {\displaystyle \vartheta } — угол между импульсом молекулы до соударения и нормалью со стенкой и v {\displaystyle v} — скорость молекулы[79]. Число соударений со стенкой равно N s t = n v S cos ϑ Δ t. {\displaystyle N_{\rm {st}}=nvS\cos \vartheta \Delta t.} Усреднение выражения K = k m N s t {\displaystyle K=k_{m}N_{\rm {st}}} по всем возможным углам и скоростям, даёт:
|
|
K = 2 3 n ε k i n S Δ t, {\displaystyle K={\frac {2}{3}}n\varepsilon _{\rm {kin}}S\Delta t,\qquad \qquad } (3)
где ε k i n {\displaystyle \ \varepsilon _{\rm {kin}}} — средняя кинетическая энергия поступательного движения молекул газа. Подставив (3) в (1), получаем, что давление молекул газа на стенку сосуда определяется по формуле p = 2 3 n ε k i n {\displaystyle p={\frac {2}{3}}n\varepsilon _{\rm {kin}}} [79], Подставив p {\displaystyle p} в уравнение Клапейрона в форме p = n k T {\displaystyle p=nkT}, получаем выражение ε k i n = 3 2 k T {\displaystyle \ \varepsilon _{\rm {kin}}={\frac {3}{2}}kT}, откуда следует, что температура газа прямо пропорциональна средней энергии поступательного движения молекул[79].
Распределение Больцмана
Основная статья: Распределение Больцмана

Распределение скоростей для 106 молекул кислорода при −100, 20, 600 градусах Цельсия. По горизонтальной оси отложенная скорость, по вертикальной — число молекул в каждом диапазоне скоростей шириной 1 м/с.
Равновесное распределение частиц классического идеального газа по состояниям можно получить следующим образом. Используя выражение для потенциальной энергии газа в гравитационном поле и уравнение Клапейрона, выводят барометрическую формулу[80] и с её помощью находят распределение молекул газа по энергиям в гравитационном поле. Больцман показал, что полученное таким образом распределение справедливо не только в случае потенциального поля сил земного тяготения, но и в любом потенциальном поле сил для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения[81]. Это распределение и носит название распределения Больцмана:
n ¯ j = a e − ε j k T, {\displaystyle {\bar {n}}_{j}=ae^{-{{\varepsilon _{j}} \over {kT}}},}
где n ¯ j {\displaystyle {\bar {n}}_{j}} — среднее число частиц, находящихся в j {\displaystyle j} -ом состоянии с энергией ε j {\displaystyle \varepsilon _{j}}, а константа a {\displaystyle a} определяется условием нормировки:
|
|
∑ n j = N, {\displaystyle \sum {n_{j}}=N,}
где N {\displaystyle N} — полное число частиц.
Распределение Больцмана является предельным случаем распределений Ферми — Дирака и Бозе — Эйнштейна для больших температур, и, соответственно, классический идеальный газ является предельным случаем Ферми-газа и Бозе-газа. Данный предельный случай соответствует ситуации, когда заполнение энергетических уровней невелико и квантовыми эффектами можно пренебречь[82].
Адиабатический процесс

График адиабаты (жирная линия) на p − V {\displaystyle p-V} диаграмме для газа.
p {\displaystyle p} — давление газа;
V {\displaystyle V} — объём
Основная статья: Адиабатический процесс
C помощью модели идеального газа можно предсказать изменение параметров состояния газа при адиабатическом процессе. Запишем уравнение Клапейрона в таком виде:
p V = ν R T. {\displaystyle pV=\nu RT.}
Продифференцировав обе части, получаем:
p d V + V d p = ν R d T. (1) {\displaystyle pdV+Vdp=\nu RdT.(1)}
Согласно экспериментально установленному закону Джоуля (закону Гей-Люссака — Джоуля) внутренняя энергия идеального газа не зависит от давления или объёма газа[15]. По определению молярной теплоёмкости при постоянном объёме, (∂ U ∂ T) V = C V {\displaystyle \left({\frac {\partial U}{\partial T}}\right)_{V}=C_{V}} [83]. Поэтому получаем
|
где ν {\displaystyle \nu } — число молей идеального газа.
Учитывая отсутствие теплообмена с окружающей средой имеем[84]:
|
C учётом этого уравнение (1) приобретает вид
p d V + V d p = − p d V ⋅ R C V, {\displaystyle p\mathrm {d} V+V\mathrm {d} p=-p\mathrm {d} V\cdot {\frac {R}{C_{V}}},}
далее, введя коэффициент γ = 1 + R / C V {\displaystyle {\mathsf {\gamma }}=1+R/C_{V}}, получаем получаем окончательно уравнение Пуассона:
p ⋅ V γ = c o n s t. {\displaystyle p\,\cdot V^{\mathsf {\gamma }}=\mathrm {const}.}
Для нерелятивистского невырожденного одноатомного идеального газа k = 5 / 3 {\displaystyle {\mathsf {k}}=5/3} [85], для двухатомного k = 7 / 5 {\displaystyle {\mathsf {k}}=7/5} [85].
Скорость звука
Основная статья: Скорость звука
Скорость звука в идеальном газе определяется[86]
c s = (∂ P ∂ ρ) s = γ P ρ = γ R T M, {\displaystyle c_{s}={\sqrt {\left({\frac {\partial P}{\partial \rho }}\right)_{s}}}={\sqrt {\frac {\gamma P}{\rho }}}={\sqrt {\frac {\gamma RT}{M}}},}
где γ — показатель адиабаты (ĉP/ĉV), s — энтропия на частицу газа, ρ — плотность газа, P — давление газа, R — универсальная газовая постоянная, T — температура, M — молярная масса газа. Так как колебания плотности быстрые, то процесс в целом происходит без обмена теплом, что объясняет появление показателя адиабаты в выражении для скорости звука. Для воздуха возьмём γ = 1,4, M =28,8, T = 273 К, тогда c s=330 м/с.
|
|
Квантовый идеальный газ
Понижение температуры и увеличение плотности газа может привести к ситуации, когда среднее расстояние между частицами становится соизмеримым с длиной волны де Бройля для этих частиц, что приводит к переходу от классического к квантовому идеальному газу (см. Вырожденный газ). В таком случае поведение газа зависит от спина частиц: в случае полуцелого спина (фермионы) действует статистика Ферми — Дирака (Ферми-газ), в случае целого спина (бозоны) — статистика Бозе — Эйнштейна (Бозе-газ)[87].
Ферми-газ
Для фермионов действует принцип Паули, запрещающий двум тождественным фермионам находиться в одном квантовом состоянии[88]. Вследствие этого при абсолютном нуле температуры импульсы частиц и, соответственно, давление и плотность энергии Ферми-газа отличны от нуля и пропорциональны числу частиц в единице объёма[82]. Существует верхний предел энергии, который могут иметь частицы Ферми-газа при абсолютном нуле (Энергия Ферми E F {\displaystyle E_{F}}). Если энергия теплового движения частиц Ферми-газа значительно меньше энергии Ферми, то это состояние называют вырожденным газом[89].
Примерами Ферми-газов являются электронный газ в металлах, сильнолегированных и вырожденных полупроводниках, вырожденный газ электронов в белых карликах[89].
Бозе-газ

Распределение скоростей атомов рубидия вблизи абсолютного нуля. Слева — распределение до образования конденсата, в центре — после образования, справа — после испарения газообразной составляющей и появления чистого конденсата
Так как бозоны могут быть строго тождественны друг другу[90][91] и, соответственно, принцип Паули на них не распространяется, то при снижении температуры Бозе-газа ниже некоторой температуры T 0 {\displaystyle T_{0}} возможен переход бозонов на наинизший энергетический уровень с нулевым импульсом, то есть образование конденсата Бозе — Эйнштейна. Поскольку давление газа равно сумме импульсов частиц, переданной стенке в единицу времени, при T < T 0 {\displaystyle T<T_{0}} давление Бозе-газа зависит только от температуры. Этот эффект в 1995 году наблюдался экспериментально, а в 2001 году авторам эксперимента была присуждена Нобелевская премия[92].
|
|
Примерами Бозе-газов являются различного рода газы квазичастиц (слабых возбуждений) в твёрдых телах и жидкостях, сверхтекучая компонента гелия II, конденсата Бозе — Эйнштейна куперовских электронных пар при сверхпроводимости. Примером ультрарелятивистского бозе-газа является фотонный газ (тепловое излучение)[90][91]. Примером бозе-газа, состоящего из квазичастиц является фононный газ[93].
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!