

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Нижний (верхний) концентрационный предел распространения пламени - минимальная (максимальная) концентрация горючего в окислителе, способная воспламениться от высокоэнергетического источника с последующим распространением горения на всю смесь.
Расчетные формулы
Нижний концентрационный предел воспламенения jН определяют по предельной теплоте сгорания. Установлено, что 1 м3 различных газовоздушных смесей на НКПВ выделяет при горении постоянное среднее количество тепла - 1830 кДж, называемое предельной теплотой горения. Следовательно,
 2.1
2.1
если принять среднее значение Q ПР равным 1830 кДж/м3, то jН будет равно

где Q Н - низшая теплота сгорания горючего вещества, кДж/м3.
Нижний и верхний КПВ могут быть определены по аппроксимационной формуле
 2.2
2.2
где n - cтехиометрический коэффициент при кислороде в уравнении химической реакции; a и b - эмпирические константы, значения которых приведены в табл. 2.1.
| Т а б л и ц а 2.1 | |||
| Концентрационные пределы | Значения коэффициентов | ||
| воспламенения | |||
| a | b | ||
| Нижний | 8,684 | 4,679 | |
| Верхний | n £ 7,5 | 1,550 | 0,560 |
| n > 7,5 | 0,768 | 6,554 | |
Концентрационные пределы воспламенения паров жидких и твердых веществ могут быть рассчитаны, если известны температурные пределы

где p Н(В) - давление насыщенного пара вещества при температуре, соответствующей нижнему (верхнему) пределу воспламенения, Па; p 0 - давление окружающей среды, Па.
Давление насыщенного пара может быть определено по уравнению Антуана или по табл. 4 приложения

где A, B, C - константы Антуана (табл. 12 приложения); t - температура, 0С - (температурные пределы).
Для расчета концентрационных пределов воспламенения смесей горючих газов используют правило Ле-Шателье
|
|

Где  нижний (верхний) КПВ смеси газов, % об.;
нижний (верхний) КПВ смеси газов, % об.; 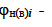
нижний (верхний) предел воспламенения i -го горючего газа %, об.; m i - мольная доля i -го горючего газа в смеси.
Следует иметь при этом в виду, что Sm i = 1, т.е. концентрация горючих компонентов газовой смеси принимается за 100 %.
Если известны концентрационные пределы воспламенения при температуре Т 1, то при температуре Т 2 они вычисляются по формулам

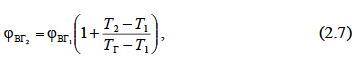
Где 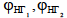 - нижний концентрационный предел воспламенения соответственно при температурах Т 2 и Т 1;
- нижний концентрационный предел воспламенения соответственно при температурах Т 2 и Т 1;  верхний концентрационный предел воспламенения соответственно при температурах Т 1 и Т 2; Т Г - температура горения смеси.
верхний концентрационный предел воспламенения соответственно при температурах Т 1 и Т 2; Т Г - температура горения смеси.
Приближенно при определении НКПВ Т Г принимают 1550 К, при определении ВКПВ - 1100 К.
При разбавлении газовоздушной смеси инертными газами (N2, СО2, Н2О пары и т.п.) область воспламенения cужается: верхний предел снижается, а нижний - возрастает. Концентрация инертного газа (флегматизатора), при которой нижний и верхний пределы воспламенения смыкаются, называется минимальной флегматизирующей концентрацией jф. Содержание кислорода в такой системе называют минимальным взрывоопасным содержанием кислорода МВСК)
О2
(φ. Некоторое содержание кислорода ниже МВСК называют безопасным О без
2
φ. Расчет
указанных параметров проводят по формулам

где ΔH0 f - стандартная теплота образования горючего, Дж/моль; h i ¢, h " i, h Ф¢¢ - константы, зависящие от вида химического элемента в молекуле горючего и вида флегматизатора (табл. 11 приложения); m i - количество атомов i -го элемента (структурной группы) в молекуле горючего.
Расчет этих параметров может поводиться по другой физически более прозрачной методике – решением уравнения теплового баланса (1.36) при следующих двух условиях: - в точке флегматизации горючая смесь имеет предельную температуру горения ~1500 К; - смесь является стехиометрической при окислении углерода до СО, водорода до Н2О.
Уравнение теплового баланса (1.36) в случае разбавления нейтральным газом представляем в виде:
|
|
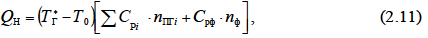
где Т Г* - предельная температура горения ~1500 К; С P i, С Рф – соответственно теплоемкость i -го продукта горения и нейтрального газа (флегматизатора), кДж/(моль×К); n ПГ i - количество молей i -го продукта горения стехиометрической смеси, моль/моль; n ф – количество молей нейтрального газа в точке флегматизатора, моль/моль.
Из (2.11) 
Приняв объем всех компонентов газовоздушной смеси за 100 %, определяется концентрация (% об.) каждого из них
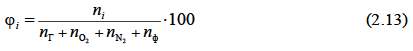
Примеры
П р и м е р 1. По предельной теплоте сгорания определить нижний концентрационный предел воспламенения бутана в воздухе.
Р е ш е н и е. Для расчета по формуле (2.1) в табл. 3 приложения находим низшую теплоту сгорания вещества 2882,3 кДж/моль. Эту величину надо перевести в другую размерность – кДж/м3:

По формуле (2.1) определим НКПВ

По табл. 4 приложения находим, что экспериментальное значение jН = 1,9 %. Относительная ошибка расчета, следовательно, составила

П р и м е р 2. Определить концентрационные пределы воспламенения этилена в воздухе.
Р е ш е н и е. Расчет КПВ проводим по аппроксимационной формуле.
Определяем значение стехиометрического коэффициента при кислороде

Таким образом, n = 3, тогда

Определим относительную ошибку расчета. По табл. 4 приложения экспериментальные значения пределов составляют 3,0 - 32,0:

Следовательно, при расчете НКПВ этилена результат завышен на 8 %, а при расчете ВКПВ - занижен на 40 %.
П р и м е р 3. Определить концентрационные пределы воспламенения насыщенных паров метанола в воздухе, если известно, что его температурные пределы составляют 280 - 312 К. Атмосферное давление нормальное.
Р е ш е н и е. Для расчета по формуле (2.3) необходимо определить давление насыщенных паров, соответствующее нижнему (7 оС) и верхнему (39 оС) пределам воспламенения.
По уравнению Антуана (2.4) находим давление насыщенного пара, воспользовавшись данными табл.12 приложения.

По формуле (3.3) определим НКПВ

П р и м е р 4. Определить концентрационные пределы воспламенения газовой смеси, состоящей 40 % пропана, 50 % бутана и 10 % пропилена.
Р е ш е н и е. Для расчета КПВ смеси газов по правилу Ле-Шателье (2.5) необходимо определить КПВ индивидуальных горючих веществ, методы расчета которых рассмотрены выше.
|
|
C3H8 - 2,1¸9,5 %; C3H6 - 2,2¸10,3 %; C4H10 - 1,9¸9,1 %;

П р и м е р 5. Каково минимальное количество диэтилового эфира, кг, способное при испарении в емкости объемом 350 м3 создать взрывоопасную концентрацию?
Р е ш е н и е. Концентрация будет взрывоопасной, если jН = jПГ (jПГ - концентрация паров горючего вещества). Расчетом (см. примеры 1-3) или по табл. 5 приложения находим НКПВ диэтилового эфира. Он равен 1,7 %.
Определим объем паров диэтилового эфира, необходимый для создания в объеме 350 м3 этой концентрации.

Таким образом, для создания НКПВ диэтилового эфира в объеме 350 м3 необходимо ввести 5,95 м3 его паров. Принимая во внимание, что 1 кмоль (74 кг) пара, приведенный к нормальным условиям, занимает объем, равный 22,4 м3, находим количество диэтилового эфира

П р и м е р 6.Определить, возможно ли образование взрывоопасной концентрации в объеме 50 м3 при испарении 1 кг гексана, если температура окружающей среды 300 К.
Р е ш е н и е. Очевидно, паровоздушная смесь будет взрывоопасной, если jН £ jПГ £ jВ. При 300 К объем паров гексана, образующийся в результате испарения 5 кг вещества, найдем, принимая во внимание, что при испарении 1 кмоля (86 кг) гексана при 273 К объем паровой фазы будет равен 22,4 м3

Концентрация паров гексана в помещении объемом 50 м3, следовательно, будет равна

Определив концентрационные пределы воспламенения гексана в воздухе (1,2 - 7,5 %), по таблицам или расчетом устанавливаем, что образующаяся смесь является взрывоопасной.
П р и м е р 7. Определить, образуется ли взрывоопасная концентрация насыщенных паров над поверхностью резервуара, содержащего 60 %
диэтилового эфира (ДЭ) и 40 % этилового спирта (ЭС), при температуре 245 К?
Р е ш е н и е. Концентрация паров будет взрывоопасной, если  - концентрация насыщенных паров смеси жидкостей).
- концентрация насыщенных паров смеси жидкостей).
Очевидно, что в результате различной летучести веществ состав газовой фазы будет отличаться от состава конденсированной фазы.
Содержание компонентов в газовой фазе по известному составу жидкой определим по закону Рауля для идеальных растворов жидкостей.
1. Определим мольный состав жидкой фазы

где miж - мольная доля i -го вещества; q i - весовая доля i -го вещества; M i -молекулярная масса i -го вещества (М ДЭ = 74, М ЭС = 46),
|
|

2. По уравнению (2.4), используя значения констант Антуана из табл.12 приложения. Находим давление насыщенных паров диэтилового эфира и этилового спирта при температуре 19 оС (245 К)
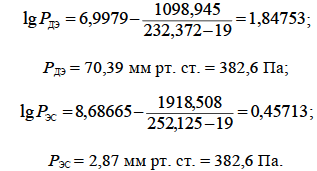
3. Согласно закону Рауля, парциальное давление насыщенных паров i -й жидкости над смесью равно произведению насыщенного пара над чистой жидкостью на ее мольную долю в жидкой фазе, т.е.
Р ПАР(ДЭ) = 9384,4×0,479 = 4495,1 Па;
Р ПАР(ЭС) = 382,6×0,521 = =199,3 Па.
3. Приняв сумму парциальных давлений насыщенных паров диэтилового эфира и этилового спирта равной 100 %, определим
а) концентрацию паров в воздухе
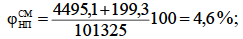
б) мольный состав газовой фазы (закон Рауля-Дуартье)

4. Определив расчетом или по справочным данным (табл.5 приложения) КПВ индивидуальных веществ (диэтиловый эфир 1,7¸59 %, этиловый спирт 3,6¸19 %), по правилу Ле-Шателье рассчитаем КПВ паровой фазы

6. Сравнивая полученные в п. 4, а концентрацию паровоздушной смеси с концентрационными пределами распространения пламени (1,7-46,1 %), делаем заключение, что при 245 К над данной жидкой фазой образуется взрывоопасная концентрация насыщенных паров в воздухе.
П р и м е р 8. Рассчитать безопасную концентрацию кислорода при разбавлении углекислым газом смеси паров ацетона в воздухе.
Р е ш е н и е. По табл.3 приложения находим теплоту образования ацетона 248,1 103 Дж/моль. Из химической формулы ацетона (С3Н6О) следует, что m с = 3, m н= 6, m o = 1. Значения остальных параметров, необходимые для расчета по формуле (2.8), выбираем из табл. 11 для двуокиси углерода

Следовательно, при снижении концентрации кислорода в четырехкомпонентной системе, состоящей из паров ацетона, двуокиси углерода, азота и кислорода, до 8,6 % смесь становится взрывобезопасной.
При содержании же кислорода, равном 10,7 % эта смесь будет предельной по взрываемости. Согласно справочным данным ("Пожарная опасность веществ и материалов, применяемых в химической промышленности".
Справочник. - М., Химия, 1979), МВСК ацетоновоздушной смеси при разбавлении ее двуокисью углерода составляет 14,9 %. Определим относи-тельную ошибку расчета.

Таким образом, результаты расчета МВСК занижены на 28 %.
П р и м е р 9. Рассчитать параметры точки флегматизации (МФК, МВС, концентрацию горючего) при разбавлении бутановоздушной смеси диоксидом углерода. Расчет проведем по уравнениям (2.11)¸(2.13). Запи-шем уравнение химической реакции окисления бутана до СО и Н2О
С4Н10 + 4,5О2 + 4,5×3,76N2 = 4СО + 5Н2О + 4,5×3,76N2
По (1.30) рассчитаем низшую теплоту этой реакции.
Из табл. 3 приложения находим теплоты образования продуктов реак-ции и рассчитываем Q Н:
Q Н = 4×112,7 + 5×242,2 - 1×132 = 1529,4 кДж/моль.
|
|
По (2.12), имея данные по теплоемкости продуктов горения и ней-трального газа при температуре 1500 К (см. табл. 1.8), рассчитываем коли-чество молей диоксида углерода в точке флегматизации.

МФК диоксида углерода определим по (2.13)

По (2.13) рассчитывается и МВСК, и концентрация горючего в точке флегматизации.

Контрольные задачи
1. По предельной теплоте сгорания определить, как изменится нижний концентрационный предел воспламенения в воздухе от положения пре-дельных углеводородов (этан, пропан, бутан, гептан, гексан) в гомологиче-ском ряду. Построить график зависимости НКПВ от молекулярной массы горючего.
2. По аппроксимационной формуле рассчитать, как изменяются кон-центрационные пределы жирных спиртов (метилового, этилового, гекси-лового, октилового) в воздухе. Построить график зависимости нижнего и верхнего пределов воспламенения от молекулярной массы горючего.
3. Определить концентрационные пределы восплеменения сероугле-рода при атмосферном давлении, равном 99000 Па, если его температур-ные пределы составляют 223-299 К.
4. Рассчитать концентрационные пределы воспламенения бензола, ес-ли его температурные пределы составляют 259–283 К. Определить ошибку расчета.
5. Определить концентрационные пределы воспламенения парогазо-вой смеси, состоящей из 20 % этана, 60 % этилена 20 % паров этилового спирта.
6. Определить концентрационные пределы воспламенения в воздухе смеси паров, состоящей из 50 % бензола, 35 % толуола и 15 % фенола при увеличении температуры с 298 до 373 К.
7. Определить, образуется ли взрывоопасная концентрация при испа-рении в помещении объемом 220 м3 15 кг деканола, если температура 310 К, давление 110500 Па.
8. Определить, возможно ли образование взрывоопасной концентра-ции при температуре 298 К над поверхностью жидкой фазы, состоящей из 25 % уксуснометилового эфира, 40 % уксусного альдегида и 35 % амило-вого спирта.
9. Определить состав двухкомпонентой газовой смеси, cостоящей из паров аммиака и сероводорода, если известно, что ее нижний концентра-ционный предел воспламенения в воздухе составляет 5,8%.
10. Определить безопасную концентрацию кислорода при разбавле-нии паров уксуснопропилового эфира (Δ H 0 j = 513,7×103 кДж/моль) в возду-хе двуокисью углерода, водяным паром и азотом. Объяснить причину раз-личной флегматизирующей эффективности инертных газов.
Домашнее задание Рассчитать концентрационные пределы воспламенения паров i-го ве-щества в воздухе. Результаты расчета сравнить с имеющимися справочны-ми данными и определить относительную ошибку (табл. 2.2).
Т а б л и ц а 2.2
| Вариант | Горючее вещество | Химическая формула | Условие задачи* |
| 1 | Г ептан | C7H16 | По предельной теплоте сгорания |
| 2 | Смесь газов | C8H18 - 40 %, СбН14 - 60 % | По формуле Ле-Шателье |
| 3 | Ацетилен | C2H2 | По аппроксимационной формуле |
| 4 | Уксусный альдегид | C2H4O | По предельной теплоте сгорания |
| 5 | Бензол | C6H6 | По температурным пределам воспламенения |
| 6 | Ацетон | C3H5O | По температурным пределам воспламенения |
| 7 | Смесь газов | CH4 - 40 %, CO - 50 %, C3H8 - 10 % | По формуле Ле-Шателье |
| 8 | Амиловый спирт | C5H12O | По температурным пределам воспламенения |
| 9 | Этан | C2H6 | По предельной теплоте сгорания |
| 10 | Толуол | C7H8 | По температурным пределам воспламенения |
| 11 | Смесь газов | CO - 70 %, CH4 - 25 %, C2H6 - 5 % | По формуле Ле-Шателье |
| 12 | Уксусная кислота | C2H4O2 | По аппроксимационной формуле |
| 13 | Уксусноэтиловый эфир | C4H8O2 | По температурным пределам воспламенения |
| 14 | Глицерин | C3H8O3 | По аппроксимационной формуле |
| 15 | Ацетон | C3H6O | По аппроксимационной формуле |
| 16 | Смесь газов | C3H8 - 70 %, CH4 - 30 % | По формуле Ле-Шателье |
| 17 | Метиловый спирт | CH4O | По температурным пределам воспламенения |
| О к о н ч а н и е т а б л. 2.2 | |||
| Вариант | Горючее вещество | Химическая формула | Условие задачи* |
| 18 | Стирол | C8H8 | По температурным пределам воспламенения |
| 19 | Фенол | СбНбО | По предельной теплоте сгорания |
| 20 | Гексиловый спирт | СбНмО | По аппроксимационной формуле |
| 21 | Смесь газов | СО - 12 %, C2H2 - 78 %, CH4 - 10 % | По формуле Ле-Шателье |
| 22 | Диэтиловый спирт | (С2ВД2О | По температурным пре-делам воспламенения |
| 23 | Сероуглерод | CS2 | По температурным пределам воспламенения |
| 24 | Масляная кислота | C4H8O2 | По аппроксимационной формуле |
| 25 | Бензиловый спирт | CvH8O | По температурным пределам воспламенения |
| 26 | Метилэтил кетон | C4H8O | По аппроксимационной формуле |
| 27 | Анилин | C6H7N | По предельной теплоте сгорания |
|
|
|

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!