Расчетные формулы
Для практических расчетов принимают, что воздух состоит из 21% кислорода и 79% азота. Таким образом, объемное соотношение азота и кислорода в воздухе составит:
 , ,
| (1.1)
|
где 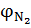 ,
,  – соответственно объемное (% об.) содержание азота и кислорода в окислительной среде.
– соответственно объемное (% об.) содержание азота и кислорода в окислительной среде.
Следовательно, на  (кмоль) кислорода в воздухе приходится
(кмоль) кислорода в воздухе приходится  (кмоля) азота.
(кмоля) азота.
Массовое соотношение азота и кислорода в воздухе составляет 23,3%  и 76,6%
и 76,6% 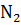 . Его можно определить, исходя из выражения:
. Его можно определить, исходя из выражения:
 , ,
| (1.2)
|
где  ,
,  – молекулярные массы соответственно кислорода и азота.
– молекулярные массы соответственно кислорода и азота.
Для удобства расчетов горючие вещества разделяют на три типа (табл. 1.1): индивидуальные химические соединения (метан, уксусная кислота и т.п.), вещества сложного состава (древесина, торф, сланцы, нефть и т.п.), смесь газов (генераторный газ и т.д.).
Т а б л и ц а 1.1
Здесь  – теоретическое количество воздуха:
– теоретическое количество воздуха:  ,
,  ,
,  – количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль;
– количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль;  – молекулярная масса горючего;
– молекулярная масса горючего; 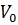 – объем 1 кмоля газа при нормальных условиях (
– объем 1 кмоля газа при нормальных условиях ( ); C, H, S, O – массовое содержание соответствующих элементов в составе горючего, %;
); C, H, S, O – массовое содержание соответствующих элементов в составе горючего, %;  – концентрация кислорода в составе горючего газа, % об.;
– концентрация кислорода в составе горючего газа, % об.;  – количество кислорода, необходимое для окисления одного кмоля i -го горючего компонента, кмоль.
– количество кислорода, необходимое для окисления одного кмоля i -го горючего компонента, кмоль.
Для определения объема воздуха при горении в условиях, отличных от нормальных, пользуются уравнением состояния идеальных газов
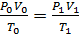 , ,
| (1.6)
|
где  – нормальное давление, Па;
– нормальное давление, Па; 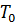 – нормальная температура, К;
– нормальная температура, К; 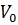 – объем воздуха при нормальных условиях;
– объем воздуха при нормальных условиях; 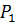 ,
,  ,
,  – соответственно давление, объем и температура воздуха, характеризующиеся заданные условия горения.
– соответственно давление, объем и температура воздуха, характеризующиеся заданные условия горения.
Практическое количество воздуха  – объем воздуха, фактивчески поступивший в зону горения. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха
– объем воздуха, фактивчески поступивший в зону горения. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха  :
:
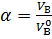 . .
| (1.7)
|
Разность между практическим и теоретическим объемами воздуха называется избытком воздуха  :
:
 . .
| (1.8)
|
Из уравнений (1.7) и (1.8) следует, что
 . .
| (1.9)
|
Если известно содержание кислорода в продуктах горения, то коэффициент избытка воздуха определяется по формуле
 , ,
| (1.10)
|
где  – концентрация кислорода в продуктах горения, % об.;
– концентрация кислорода в продуктах горения, % об.;  – теоретический объем продуктов горения.
– теоретический объем продуктов горения.
Для веществ, у которых обьем продуктов горения равен обьему израсходованного воздуха (например, углерод), формула (1.10) упрощается:
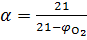 . .
| (1.11)
|
В случае образования продуктов неполного сгорания (CO,  ,
,  и др.) формула (1.11) приобретает вид
и др.) формула (1.11) приобретает вид
 , ,
| (1.11, а)
|
где  ,
,  ,
, 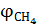 ,
, 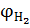 – содержание соответствующих веществ в продуктах горения, % об.
– содержание соответствующих веществ в продуктах горения, % об.
Если содержание кислорода в окислительной среде отличается от содержания его в воздухе, то формулу (1.10) можно записать в виде:
 , ,
| (1.12)
|
и соответственно формулу (1.11)
 , ,
| (1.13)
|
где  – исходное содержание кислорода в окислительной среде, % об.;
– исходное содержание кислорода в окислительной среде, % об.;  – теоретический обьем окислительной среды.
– теоретический обьем окислительной среды.
Часто в пожарно-технических расчетах требуется определить массу воздуха, пошедшего на горение,
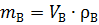 , ,
| (1.14)
|
где  – плотность воздуха, кг/
– плотность воздуха, кг/ 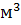 .
.
Очевидно, что
 . .
| (1.15)
|
После подстановки постоянных значений в формулу (1.15) получим
 , ,
| (1.16)
|
где Р – атмосферное давление, Па; Т – температура воздуха, К.
П р и м е р 1. Определить теоретическую массу и объем воздуха, необходимого для горения 1 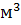 метана при нормальных условиях.
метана при нормальных условиях.
Р е ш е н и е. Горючее вещество является индивидуальным химическим соединением, поэтому для расчета объема воздуха надо пользоваться формулой (1.3, а). запишем уравнение химической реакции горения  в воздухе
в воздухе
 .
.
Из уравнения находим  ;
; 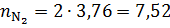 ;
;  , тогда
, тогда 
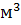 /
/ 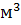 или кмоль/кмоль.
или кмоль/кмоль.
По формуле (1.14) с учетом уравнения (1.15) рассчитываем массу воздуха
 кг/
кг/ 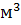 .
.
П р и м е р 2. Определить теоретический объем воздуха, необходимого для горения 1 кг бензола.
Р е ш е н и е. Горючее – индивидуальное химическое соединение, поэтому для расчета по формуле (1.3, б) запишем уравнение химической реакции горения
 ,
,
найдем n = 1;  ;
;  .
.
Молекулярная масса бензола 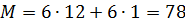 .
.
Объем 1 кмоля газа при нормальных условиях составляет 22,4 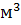
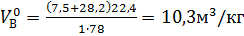 .
.
П р и м е р 3. Определить объем и массу воздуха, необходимого для горения 1 кг органической массы состава С – 60%, Н – 5%, О – 25%, N – 5%, W – 5% (влажность), если коэффициент избытка воздуха 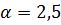 ; температура воздуха 305 К, давление 99500 Па.
; температура воздуха 305 К, давление 99500 Па.
Р е ш е н и е. Так как горючее вещество сложного состава, то теоретическое количество воздуха при нормальных условиях определим по формуле (1.4)
 .
.
Из формулы (1.7) рассчитаем практическое количество воздуха при нормальных условиях
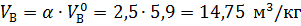 .
.
Находим количество воздуха, пошедшего на горение вещества при заданных условиях горения. Используя формулу (1.6), получим
 ,
,
 .
.
П р и м е р 4. Определить объем воздуха, необходимого для горения 5 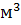 смеси газов, состоящих из 20%
смеси газов, состоящих из 20%  ; 40%
; 40%  ; 10% СО; 5%
; 10% СО; 5% 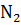 и 25%
и 25%  , если коэффициент избытка воздуха равен 1,8.
, если коэффициент избытка воздуха равен 1,8.
Р е ш е н и е. Горючее – смесь газов, поэтому для расчета объема воздуха, пошедшего на горение, воспользуемся формулой (1.5). Для определения стехиометрических коэффициентов при кислороде запишем уравнение реакций горения горючих компонентов в кислороде
 ,
,
 ,
,
 ,
,
тогда  .
.
Для горения 5 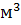 газовой смеси необходимый теоретический объем воздуха составит
газовой смеси необходимый теоретический объем воздуха составит  . Практическое количество воздуха:
. Практическое количество воздуха:  .
.
П р и м е р 5. Определить коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1 кг поступило 3 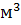 воздуха.
воздуха.
Р е ш е н и е. Для определения коэффициента избытка воздуха по формуле (1.7) необходимо рассчитать его теоретическое количество. Молекулярная масса уксусной кислоты 60.
 ;
;
 .
.
Тогда коэффициент избытка воздуха по формуле (1.7) равен
 .
.
Горение протекало при недостатке воздуха.
П р и м е р 6. Определить объем воздуха, пошедшего на окисление 1 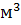 аммиака, если в продуктах горения содержание кислорода составило 18%.
аммиака, если в продуктах горения содержание кислорода составило 18%.
Р е ш е н и е. Определяем теоретическое количество воздуха, необходимого для горения 1 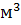 аммиака:
аммиака:
 ,
,
тогда
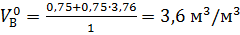 .
.
Для определения коэффициента избытка воздухе по формуле (1.10) необходимо рассчитать теоретическое количество продуктов горения 1 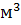 аммиака (§ 1.2, формула 1.14)
аммиака (§ 1.2, формула 1.14)
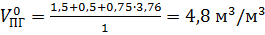 .
.
Коэффициент избытка воздуха
 .
.
Объем воздуха, участвующего в процессе горения 1 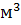 аммиака, определим из формулы (1.7)
аммиака, определим из формулы (1.7)
 .
.
П р и м е р 7. Определить объем окислительной среды, состоящей из 60%  и 40%
и 40% 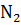 , необходимый для горения 1 кг изопропилового спирта, если ее температура равна 295 К, давление 62,0 кПа.
, необходимый для горения 1 кг изопропилового спирта, если ее температура равна 295 К, давление 62,0 кПа.
Р е ш е н и е. Так как окислительная среда отличается по составу от воздуха, определим по формуле (1.1) объемное соотношение кислорода и азота 40:60=0,67.
Уравнение реакции горения изопропилового спирта
 .
.
Теоретический объем окислительной среды при нормальных условиях рассчитаем по формуле (1.3, б). Молекулярная масса горючего равна 60:
 .
.
Объем окислительной среды при заданных условиях горения определим из формула (1.6)
 .
.
П р и м е р 8. Определить массу динитротолуола, 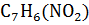 , сгоревшего в герметичном обьеме 100
, сгоревшего в герметичном обьеме 100 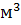 , если содержание кислорода в продуктах горения составило 12%.
, если содержание кислорода в продуктах горения составило 12%.
Р е ш е н и е. Так как в продуктах горения содержится кислород, то горение протекало в избытке воздуха. Коэффициент избытка определим по формуле (1.10).
 .
.
Молекулярная масса горючего 182. Теоретический объем воздуха
 .
.
Теоретический объем продуктов горения (формула 1.14)
 ,
,
 .
.
Практический объем воздуха, пошедший на горение
 .
.
Тогда массу сгоревшего динитротолуола определим из соотношения
 .
.
Контрольные задачи
1. Определить массу и объем (теоретический) воздуха, необходимого для горения 1 кг метилового, этилового, пропилового и амилового спиртов построить график зависимости объема воздуха от молекулярной массы спирта.
2. Определить теоретический объем воздуха, необходимого для горения 1 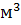 метана, этана, пропана, бутана и пентана. Построить график зависимости объема воздуха от положения вещества в гомологическом ряду (содержания углерода в молекуле вещества).
метана, этана, пропана, бутана и пентана. Построить график зависимости объема воздуха от положения вещества в гомологическом ряду (содержания углерода в молекуле вещества).
3. Определить теоретическую массу воздуха, пошедшего на горение 1 кг метана, метилового спирта, муравьиного альдегида, муравьиной кислоты. Объяснить причину влияния состава вещества на объем воздуха, требуемого для их горения.
4. Определить объем и массу воздуха, пошедшего на горения 1 кг древесины состава: С – 47%, Н – 8%, О – 40%, W – 5%, если коэффициент избытка воздуха равен 2,8; давление 900 ГПа, температура 285 К.
5. Сколько воздуха, кг, поступило на горение 1 кг углерода, если в продуктах горения содержание кислорода составило 17%?
6. Сколько воздуха, кг, требуется подать на сжигание 200  генераторного газа состава: СО – 29%,
генераторного газа состава: СО – 29%,  – 14%, С
– 14%, С  – 3%,
– 3%,  – 6,5%,
– 6,5%, 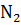 – 45%,
– 45%,  – 2,5%, если коэффициент избытка воздуха равен 2,5?
– 2,5%, если коэффициент избытка воздуха равен 2,5?
7. Определить количество сгоревшего толуола, кг, в помещении объемом 400  если после пожара при отсутствии газообмена установлено, что содержание кислорода снизилось до 17%.
если после пожара при отсутствии газообмена установлено, что содержание кислорода снизилось до 17%.
8. Сколько хлора,  , поступило на горение 300
, поступило на горение 300  водорода, если в продуктах горения избыток окислителя составил 80
водорода, если в продуктах горения избыток окислителя составил 80  ?
?
9. Определить избыток воздуха в продуктах горения газовой смеси состава: СО – 15%,  – 45%,
– 45%,  – 30%,
– 30%, 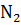 – 10%, если коэффициент избытка равен 1,2; температура 265 К, давления 850 ГПа.
– 10%, если коэффициент избытка равен 1,2; температура 265 К, давления 850 ГПа.
10. Сколько окислительной среды,  , состоящей из 50% кислорода и 50% азота, необходимо для горения 8 кг этилацетата, если коэффициент избытка равен 1,2; температура 265 К, давление 850 ГПа.
, состоящей из 50% кислорода и 50% азота, необходимо для горения 8 кг этилацетата, если коэффициент избытка равен 1,2; температура 265 К, давление 850 ГПа.
11. Определить коэффициент избытка окислительной среды, состоящей из 70% кислорода и 30% азота, если при горении серы содержание кислорода снизилось до 55%. Определить количество сгоревшей серы (кг), если объем помещения равен 180  .
.
12. Сколько антрацита (принять, что содержание углерода равно 100%) сгорело в помещении объемом 150  , если прекращение горения наступило при снижении кислорода до 13%. Газообмен не учитывать.
, если прекращение горения наступило при снижении кислорода до 13%. Газообмен не учитывать.
13. Рассчитать массовый и объемный расход воздуха, необходимый для горения фонтана дебитом 30 млн.  /сут., состоящего из
/сут., состоящего из  – 80%,
– 80%,  – 10%,
– 10%,  – 5%,
– 5%,  – 5% при температуре воздуха 27
– 5% при температуре воздуха 27  и давлении 105 КПа.
и давлении 105 КПа.
Домашнее задание
Рассчитать обьем и массу окислительной среды, необходимые для горения i -го горючего вещества (табл. 1.2).
Т а б л и ц а 1.2
| Номер варианта
| Горючее вещество
| Химическая формула
| Кол-во горючего
| Состав окислительной среды
| Условия горения
|
| 1
| Метиловой спирт
| 
| 2 кг
| Воздух
| Т = 300 К
Р = 101325 Па
 = 3 = 3
|
| 2
| Анилин
| 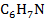
| 5 кг
|  – 70% – 70%
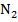 – 30% – 30%
| Т = 290 К
Р = 90000 Па
 = 2,5 = 2,5
|
| 3
| Смесь
газов
| СО – 45%
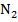 – 15% – 15%
 – 10% – 10%
 – 30% – 30%
| 3 
| Воздух
| Нормальные
 = 1,8 = 1,8
|
| 4
| Нитробензол
| 
| 30 кг
| Воздух
| Т = 280 К
Р = 98000 Па
 = 2,5 = 2,5
|
| 5
| Сложное вещество
| С – 65%
О – 20%
Н – 5%
S – 10%
| 200 г
| Воздух
| Нормальные
 = 1,4 = 1,4
|
| 6
| Этилен
| 
| 5 
|  – 25% – 25%
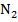 – 75% – 75%
| Нормальные
 = 2,5 = 2,5
|
| 7
| Сера
|
S
| 2 кг
|  – 60% – 60%
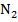 – 40% – 40%
| Т = 350 К
Р = 120000 Па
 = 1,8 = 1,8
|
| 8
| Сложное вещество
| С – 90%
Н – 3%
N – 5%
О – 2%
| 1 кг
| Воздух
| Т = 300 К
Р = 95000 Па
 = 1,5 = 1,5
|
П р о д о л ж е н и е т а б л и ц ы 1.2
| Номер вариант
| Горючее вещество
| Химическая формула
| Кол-во горючего
| Состав окислительной среды
| Условия горения
|
| 9
| Смесь газов
|  – 15% – 15%
 – 70% – 70%
 – 10% – 10%
 – 5% – 5%
|
5 
|
Воздух
|
Нормальные
 = 1,9 = 1,9
|
| 10
| Алюминий
| Al
| 15 кг
|  – 42% – 42%
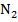 – 58% – 58%
| Нормальный
 = 2,8 = 2,8
|
| 11
| Сплав
| Mg – 20%
Al – 80%
| 8 кг
| Воздух
| Т = 265 К
Р = 92000 Па
 = 1,5 = 1,5
|
| 12
| Муравьиная кислота
| 
| 5 кг
| Воздух
| Нормальные
 = 1,2 = 1,2
|
| 13
| Диметиловый эфир
|

|
10 кг
|
Воздух
| Т = 300 К
Р = 95000 Па
 = 1,5 = 1,5
|
| 14
| Смесь газов
|  – 25% – 25%
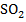 – 15% – 15%
 – 15% – 15%
 – 30% – 30%
 – 15% – 15%
|
15 
|
Воздух
|
Нормальные
 = 1,4 = 1,4
|
| 15
| Сложное вещество
| С – 82%
Н – 8%
W – 10%
|
0,7 кг
|
Воздух
| Т = 260 К
Р = 110000 Па
 = 1,4 = 1,4
|
| 16
| Глицерин
|

|
1 кг
|
Воздух
| Т = 305 К
Р = 101300 Па
 = 1,9 = 1,9
|
| 17
| Ацетилен
| 
| 150 л
|  – 18% – 18%
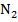 – 82% – 82%
| Нормальные
 = 1,8 = 1,8
|
| 18
| Смесь газов
|  – 30% – 30%
 – 8% – 8%
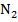 – 15% – 15%
 – 47% – 47%
|
3 
|
Воздух
|
Нормальные
 = 1,4 = 1,4
|
| 19
| Этиловый эфир уксусной кислоты
|

|
5 кг
|
Воздух
| Т = 270 К
Р = 85000 Па
 = 1,5 = 1,5
|
| 20
| Метилэтил кетон
| 
| 5 кг
| Воздух
| Нормальные
 = 2,5 = 2,5
|
| 21
| Хлорбензол
|

|
7 кг
|
Воздух
| Т = 305 К
Р = 1000 Па
 = 2,8 = 2,8
|
| 22
| Нитротолуол
| 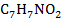
| 1 кг
|  – 25% – 25%
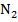 – 75% – 75%
| Т = 280 К
Р = 98000 Па
 = 1,4 = 1,4
|
О к о н ч а н и е т а б л и ц ы 1.2
| Номер варианта
| Горючее вещество
| Химическая формула
| Кол-во горючего
| Состав окислительной среды
| Условия горения
|
| 23
| Смесь газов
|  – 25 % – 25 %
 – 25 % – 25 %
 – 15 % – 15 %
 – 30 % – 30 %
 – 5 % – 5 %
|
200 л
|
Воздух
|
Нормальные
 = 1,8 = 1,8
|
| 24
| Бутиловый спирт
|

|
4 кг
|
Воздух
| Т = 265 К
Р = 120000 Па
 = 1,8 = 1,8
|
| 25
| Дибром-гексан
|

|
3 кг
|  – 65 % – 65 %
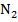 – 35 % – 35 %
| Т = 280 К
Р = 98000 Па
 = 1,7 = 1,7
|
| 26
| Сложное вещество
| С – 70 %
S – 5 %
Н – 5%
О – 20 %
|
15 кг
|
Воздух
| Т = 285 К
Р = 100000 Па
 = 2,8 = 2,8
|
| 27
| Смесь газов
|  – 10 %
СО – 79 % – 10 %
СО – 79 %
 – 5 % – 5 %
 – 5 % – 5 %
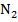 – 10 % – 10 %
|
10 
|
Воздух
|
Нормальные
 = 3,5 = 3,5
|



 ,
,
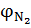 ,
,  – соответственно объемное (% об.) содержание азота и кислорода в окислительной среде.
– соответственно объемное (% об.) содержание азота и кислорода в окислительной среде. (кмоль) кислорода в воздухе приходится
(кмоль) кислорода в воздухе приходится  (кмоля) азота.
(кмоля) азота. и 76,6%
и 76,6% 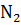 . Его можно определить, исходя из выражения:
. Его можно определить, исходя из выражения: ,
,
 ,
,  – молекулярные массы соответственно кислорода и азота.
– молекулярные массы соответственно кислорода и азота.


 ;
;

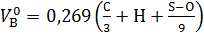
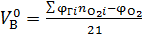
 – теоретическое количество воздуха:
– теоретическое количество воздуха:  ,
,  ,
,  – количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль;
– количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль;  – молекулярная масса горючего;
– молекулярная масса горючего; 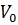 – объем 1 кмоля газа при нормальных условиях (
– объем 1 кмоля газа при нормальных условиях ( ); C, H, S, O – массовое содержание соответствующих элементов в составе горючего, %;
); C, H, S, O – массовое содержание соответствующих элементов в составе горючего, %;  – концентрация кислорода в составе горючего газа, % об.;
– концентрация кислорода в составе горючего газа, % об.;  – количество кислорода, необходимое для окисления одного кмоля i -го горючего компонента, кмоль.
– количество кислорода, необходимое для окисления одного кмоля i -го горючего компонента, кмоль.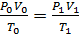 ,
,
 – нормальное давление, Па;
– нормальное давление, Па; 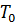 – нормальная температура, К;
– нормальная температура, К; 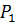 ,
,  ,
,  – соответственно давление, объем и температура воздуха, характеризующиеся заданные условия горения.
– соответственно давление, объем и температура воздуха, характеризующиеся заданные условия горения. – объем воздуха, фактивчески поступивший в зону горения. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха
– объем воздуха, фактивчески поступивший в зону горения. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха  :
: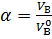 .
.
 :
: .
.
 .
.
 ,
,
 – концентрация кислорода в продуктах горения, % об.;
– концентрация кислорода в продуктах горения, % об.;  – теоретический объем продуктов горения.
– теоретический объем продуктов горения.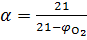 .
.
 ,
,  и др.) формула (1.11) приобретает вид
и др.) формула (1.11) приобретает вид ,
,
 ,
,  ,
, 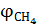 ,
, 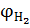 – содержание соответствующих веществ в продуктах горения, % об.
– содержание соответствующих веществ в продуктах горения, % об. ,
,
 ,
,
 – исходное содержание кислорода в окислительной среде, % об.;
– исходное содержание кислорода в окислительной среде, % об.; 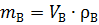 ,
,
 – плотность воздуха, кг/
– плотность воздуха, кг/ 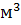 .
. .
.
 ,
,
 .
. ;
; 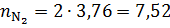 ;
;  , тогда
, тогда 
 кг/
кг/  ,
, ;
;  .
.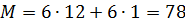 .
.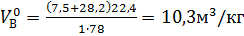 .
.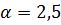 ; температура воздуха 305 К, давление 99500 Па.
; температура воздуха 305 К, давление 99500 Па. .
.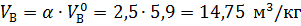 .
. ,
, .
. ; 10% СО; 5%
; 10% СО; 5%  ,
, ,
, ,
, .
. . Практическое количество воздуха:
. Практическое количество воздуха:  .
. ;
; .
. .
. ,
,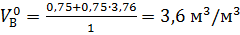 .
.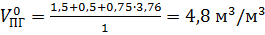 .
. .
. .
. .
. .
. .
.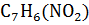 , сгоревшего в герметичном обьеме 100
, сгоревшего в герметичном обьеме 100  .
. .
. ,
, .
. .
. .
. генераторного газа состава: СО – 29%,
генераторного газа состава: СО – 29%,  – 3%,
– 3%,  – 6,5%,
– 6,5%,  – 45%,
– 45%,  – 5%,
– 5%,  и давлении 105 КПа.
и давлении 105 КПа.
 = 3
= 3
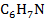
 – 70%
– 70%
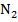 – 30%
– 30%
 – 10%
– 10%



 – 15%
– 15%
 – 70%
– 70%
 – 5%
– 5%


 – 25%
– 25%
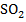 – 15%
– 15%
 – 15%
– 15%


 – 18%
– 18%



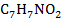
 – 25 %
– 25 %
 – 25 %
– 25 %





