

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
МИНОБРНАУКИ РОССИИ
«Ижевский государственный технический университет имени М.Т. Калашникова»
У Т В Е Р Ж Д А Ю
Ректор
_____________ В.П.Грахов
_______________________2017 г.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
По дисциплине: «Теория горения и взрыва»
для направления 20.03.01 "Техносферная безопасность"
профили: "Безопасность технологических процессов и производств",
"Защита в чрезвычайных ситуациях",
"Инженерная защита окружающей среды"
Форма обучения: очная
Общая трудоемкость дисциплины составляет: 3 зачётных единицы
Кафедра «Техносферная безопасность»
Составитель: Шадрин Роберт Олегович, к.т.н., доцент
Методические указания составлены на основании федерального государственного образовательного стандарта высшего образования и утверждена на заседании кафедры
Протокол от 15 мая 2018 г. №____________________
Заведующийкафедрой __________________ Б.В.Севастьянов
_______________________________2018 г.
СОГЛАСОВАНО
Председатель учебно-методического совета по направлению 20.03.01 "Техносферная безопасность"
профили: "Безопасность технологических процессов и производств",
"Защита в чрезвычайных ситуациях",
"Инженерная защита окружающей среды"
__________________ Б.В.Севастьянов
_______________________________2018 г.
Начальник учебно-инженерного отдела ____________ Н.В.Гайдай
_________________________________2017 г.
Содержание
| Глава 1. Материальный и тепловой баланс процессов горения | 4 |
| 1.1.Расчет количества воздуха, необходимого для горения вещества | 4 |
| 1.2.Расчет объема и состава продуктов горения | 14 |
| 1.3.Расчет теплоты сгорания веществ | 24 |
| 1.4.Расчет температуры горения и взрыва | 28 |
| Глава 2. Концентрационные пределы распространения пламени (воспламенения) | 35 |
| Глава 3. Температурные показатели пожарной опасности | 46 |
| 3.1. Расчет температурных пределов распространения пламени (воспламенения) | 46 |
| 3.2. Расчет температур вспышки и воспламенения | 48 |
| 3.3. Расчет стандартной температуры самовоспламенения | 53 |
| Глава 4. Параметры взрыва парогазовых смесей | 62 |
| Глава 5. Организация самостоятельной работы студента | 68 |
| Список литературы | 82 |
| Приложения | 84 |
Глава 1. Материальный и тепловой балансы
|
|
Процессов горения
Теоретической базой для расчетов материального и теплового балансов являются фундаментальные законы сохранения вещества и энергии.
Расчет количества воздуха, необходимого для горения вещества
Расчетные формулы
Для практических расчетов принимают, что воздух состоит из 21% кислорода и 79% азота. Таким образом, объемное соотношение азота и кислорода в воздухе составит:
 , ,
| (1.1) |
где 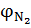 ,
,  – соответственно объемное (% об.) содержание азота и кислорода в окислительной среде.
– соответственно объемное (% об.) содержание азота и кислорода в окислительной среде.
Следовательно, на  (кмоль) кислорода в воздухе приходится
(кмоль) кислорода в воздухе приходится  (кмоля) азота.
(кмоля) азота.
Массовое соотношение азота и кислорода в воздухе составляет 23,3%  и 76,6%
и 76,6% 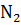 . Его можно определить, исходя из выражения:
. Его можно определить, исходя из выражения:
 , ,
| (1.2) |
где  ,
,  – молекулярные массы соответственно кислорода и азота.
– молекулярные массы соответственно кислорода и азота.
Для удобства расчетов горючие вещества разделяют на три типа (табл. 1.1): индивидуальные химические соединения (метан, уксусная кислота и т.п.), вещества сложного состава (древесина, торф, сланцы, нефть и т.п.), смесь газов (генераторный газ и т.д.).
Т а б л и ц а 1.1
| Тип горючего вещества | Расчетные формулы | Размерность | |
| Индивидуальное вещество | 

| (1.3, а) (1.3, б) |   ; ;

|
| Вещество сложного состава | 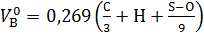
| (1.4) | 
|
| Смесь газов | 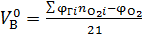
| (1.5) |   ; ;
|
Здесь  – теоретическое количество воздуха:
– теоретическое количество воздуха:  ,
,  ,
,  – количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль;
– количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль;  – молекулярная масса горючего;
– молекулярная масса горючего; 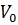 – объем 1 кмоля газа при нормальных условиях (
– объем 1 кмоля газа при нормальных условиях ( ); C, H, S, O – массовое содержание соответствующих элементов в составе горючего, %;
); C, H, S, O – массовое содержание соответствующих элементов в составе горючего, %;  – концентрация кислорода в составе горючего газа, % об.;
– концентрация кислорода в составе горючего газа, % об.;  – количество кислорода, необходимое для окисления одного кмоля i -го горючего компонента, кмоль.
– количество кислорода, необходимое для окисления одного кмоля i -го горючего компонента, кмоль.
|
|
Для определения объема воздуха при горении в условиях, отличных от нормальных, пользуются уравнением состояния идеальных газов
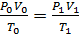 , ,
| (1.6) |
где  – нормальное давление, Па;
– нормальное давление, Па; 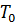 – нормальная температура, К;
– нормальная температура, К; 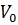 – объем воздуха при нормальных условиях;
– объем воздуха при нормальных условиях; 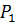 ,
,  ,
,  – соответственно давление, объем и температура воздуха, характеризующиеся заданные условия горения.
– соответственно давление, объем и температура воздуха, характеризующиеся заданные условия горения.
Практическое количество воздуха  – объем воздуха, фактивчески поступивший в зону горения. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха
– объем воздуха, фактивчески поступивший в зону горения. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха  :
:
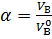 . .
| (1.7) |
Разность между практическим и теоретическим объемами воздуха называется избытком воздуха  :
:
 . .
| (1.8) |
Из уравнений (1.7) и (1.8) следует, что
 . .
| (1.9) |
Если известно содержание кислорода в продуктах горения, то коэффициент избытка воздуха определяется по формуле
 , ,
| (1.10) |
где  – концентрация кислорода в продуктах горения, % об.;
– концентрация кислорода в продуктах горения, % об.;  – теоретический объем продуктов горения.
– теоретический объем продуктов горения.
Для веществ, у которых обьем продуктов горения равен обьему израсходованного воздуха (например, углерод), формула (1.10) упрощается:
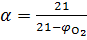 . .
| (1.11) |
В случае образования продуктов неполного сгорания (CO,  ,
,  и др.) формула (1.11) приобретает вид
и др.) формула (1.11) приобретает вид
 , ,
| (1.11, а) |
где  ,
,  ,
, 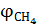 ,
, 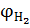 – содержание соответствующих веществ в продуктах горения, % об.
– содержание соответствующих веществ в продуктах горения, % об.
Если содержание кислорода в окислительной среде отличается от содержания его в воздухе, то формулу (1.10) можно записать в виде:
 , ,
| (1.12) |
и соответственно формулу (1.11)
 , ,
| (1.13) |
где  – исходное содержание кислорода в окислительной среде, % об.;
– исходное содержание кислорода в окислительной среде, % об.;  – теоретический обьем окислительной среды.
– теоретический обьем окислительной среды.
Часто в пожарно-технических расчетах требуется определить массу воздуха, пошедшего на горение,
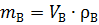 , ,
| (1.14) |
где  – плотность воздуха, кг/
– плотность воздуха, кг/ 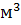 .
.
|
|
Очевидно, что
 . .
| (1.15) |
После подстановки постоянных значений в формулу (1.15) получим
 , ,
| (1.16) |
где Р – атмосферное давление, Па; Т – температура воздуха, К.
П р и м е р 1. Определить теоретическую массу и объем воздуха, необходимого для горения 1 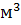 метана при нормальных условиях.
метана при нормальных условиях.
Р е ш е н и е. Горючее вещество является индивидуальным химическим соединением, поэтому для расчета объема воздуха надо пользоваться формулой (1.3, а). запишем уравнение химической реакции горения  в воздухе
в воздухе
 .
.
Из уравнения находим  ;
; 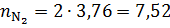 ;
;  , тогда
, тогда 
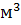 /
/ 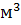 или кмоль/кмоль.
или кмоль/кмоль.
По формуле (1.14) с учетом уравнения (1.15) рассчитываем массу воздуха
 кг/
кг/ 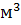 .
.
П р и м е р 2. Определить теоретический объем воздуха, необходимого для горения 1 кг бензола.
Р е ш е н и е. Горючее – индивидуальное химическое соединение, поэтому для расчета по формуле (1.3, б) запишем уравнение химической реакции горения
 ,
,
найдем n = 1;  ;
;  .
.
Молекулярная масса бензола 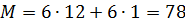 .
.
Объем 1 кмоля газа при нормальных условиях составляет 22,4 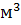
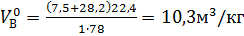 .
.
П р и м е р 3. Определить объем и массу воздуха, необходимого для горения 1 кг органической массы состава С – 60%, Н – 5%, О – 25%, N – 5%, W – 5% (влажность), если коэффициент избытка воздуха 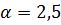 ; температура воздуха 305 К, давление 99500 Па.
; температура воздуха 305 К, давление 99500 Па.
Р е ш е н и е. Так как горючее вещество сложного состава, то теоретическое количество воздуха при нормальных условиях определим по формуле (1.4)
 .
.
Из формулы (1.7) рассчитаем практическое количество воздуха при нормальных условиях
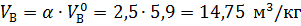 .
.
Находим количество воздуха, пошедшего на горение вещества при заданных условиях горения. Используя формулу (1.6), получим
 ,
,
 .
.
П р и м е р 4. Определить объем воздуха, необходимого для горения 5 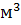 смеси газов, состоящих из 20%
смеси газов, состоящих из 20%  ; 40%
; 40%  ; 10% СО; 5%
; 10% СО; 5% 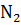 и 25%
и 25%  , если коэффициент избытка воздуха равен 1,8.
, если коэффициент избытка воздуха равен 1,8.
Р е ш е н и е. Горючее – смесь газов, поэтому для расчета объема воздуха, пошедшего на горение, воспользуемся формулой (1.5). Для определения стехиометрических коэффициентов при кислороде запишем уравнение реакций горения горючих компонентов в кислороде
 ,
,
 ,
,
 ,
,
тогда  .
.
Для горения 5 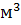 газовой смеси необходимый теоретический объем воздуха составит
газовой смеси необходимый теоретический объем воздуха составит  . Практическое количество воздуха:
. Практическое количество воздуха:  .
.
|
|
П р и м е р 5. Определить коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1 кг поступило 3 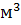 воздуха.
воздуха.
Р е ш е н и е. Для определения коэффициента избытка воздуха по формуле (1.7) необходимо рассчитать его теоретическое количество. Молекулярная масса уксусной кислоты 60.
 ;
;
 .
.
Тогда коэффициент избытка воздуха по формуле (1.7) равен
 .
.
Горение протекало при недостатке воздуха.
П р и м е р 6. Определить объем воздуха, пошедшего на окисление 1 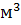 аммиака, если в продуктах горения содержание кислорода составило 18%.
аммиака, если в продуктах горения содержание кислорода составило 18%.
Р е ш е н и е. Определяем теоретическое количество воздуха, необходимого для горения 1 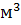 аммиака:
аммиака:
 ,
,
тогда
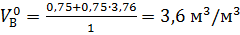 .
.
Для определения коэффициента избытка воздухе по формуле (1.10) необходимо рассчитать теоретическое количество продуктов горения 1 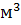 аммиака (§ 1.2, формула 1.14)
аммиака (§ 1.2, формула 1.14)
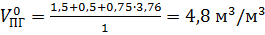 .
.
Коэффициент избытка воздуха
 .
.
Объем воздуха, участвующего в процессе горения 1 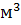 аммиака, определим из формулы (1.7)
аммиака, определим из формулы (1.7)
 .
.
П р и м е р 7. Определить объем окислительной среды, состоящей из 60%  и 40%
и 40% 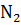 , необходимый для горения 1 кг изопропилового спирта, если ее температура равна 295 К, давление 62,0 кПа.
, необходимый для горения 1 кг изопропилового спирта, если ее температура равна 295 К, давление 62,0 кПа.
Р е ш е н и е. Так как окислительная среда отличается по составу от воздуха, определим по формуле (1.1) объемное соотношение кислорода и азота 40:60=0,67.
Уравнение реакции горения изопропилового спирта
 .
.
Теоретический объем окислительной среды при нормальных условиях рассчитаем по формуле (1.3, б). Молекулярная масса горючего равна 60:
 .
.
Объем окислительной среды при заданных условиях горения определим из формула (1.6)
 .
.
П р и м е р 8. Определить массу динитротолуола, 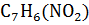 , сгоревшего в герметичном обьеме 100
, сгоревшего в герметичном обьеме 100 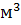 , если содержание кислорода в продуктах горения составило 12%.
, если содержание кислорода в продуктах горения составило 12%.
Р е ш е н и е. Так как в продуктах горения содержится кислород, то горение протекало в избытке воздуха. Коэффициент избытка определим по формуле (1.10).
 .
.
Молекулярная масса горючего 182. Теоретический объем воздуха
 .
.
Теоретический объем продуктов горения (формула 1.14)
 ,
,
 .
.
Практический объем воздуха, пошедший на горение
 .
.
Тогда массу сгоревшего динитротолуола определим из соотношения
 .
.
Контрольные задачи
1. Определить массу и объем (теоретический) воздуха, необходимого для горения 1 кг метилового, этилового, пропилового и амилового спиртов построить график зависимости объема воздуха от молекулярной массы спирта.
2. Определить теоретический объем воздуха, необходимого для горения 1 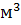 метана, этана, пропана, бутана и пентана. Построить график зависимости объема воздуха от положения вещества в гомологическом ряду (содержания углерода в молекуле вещества).
метана, этана, пропана, бутана и пентана. Построить график зависимости объема воздуха от положения вещества в гомологическом ряду (содержания углерода в молекуле вещества).
3. Определить теоретическую массу воздуха, пошедшего на горение 1 кг метана, метилового спирта, муравьиного альдегида, муравьиной кислоты. Объяснить причину влияния состава вещества на объем воздуха, требуемого для их горения.
|
|
4. Определить объем и массу воздуха, пошедшего на горения 1 кг древесины состава: С – 47%, Н – 8%, О – 40%, W – 5%, если коэффициент избытка воздуха равен 2,8; давление 900 ГПа, температура 285 К.
5. Сколько воздуха, кг, поступило на горение 1 кг углерода, если в продуктах горения содержание кислорода составило 17%?
6. Сколько воздуха, кг, требуется подать на сжигание 200  генераторного газа состава: СО – 29%,
генераторного газа состава: СО – 29%,  – 14%, С
– 14%, С  – 3%,
– 3%,  – 6,5%,
– 6,5%, 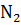 – 45%,
– 45%,  – 2,5%, если коэффициент избытка воздуха равен 2,5?
– 2,5%, если коэффициент избытка воздуха равен 2,5?
7. Определить количество сгоревшего толуола, кг, в помещении объемом 400  если после пожара при отсутствии газообмена установлено, что содержание кислорода снизилось до 17%.
если после пожара при отсутствии газообмена установлено, что содержание кислорода снизилось до 17%.
8. Сколько хлора,  , поступило на горение 300
, поступило на горение 300  водорода, если в продуктах горения избыток окислителя составил 80
водорода, если в продуктах горения избыток окислителя составил 80  ?
?
9. Определить избыток воздуха в продуктах горения газовой смеси состава: СО – 15%,  – 45%,
– 45%,  – 30%,
– 30%, 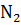 – 10%, если коэффициент избытка равен 1,2; температура 265 К, давления 850 ГПа.
– 10%, если коэффициент избытка равен 1,2; температура 265 К, давления 850 ГПа.
10. Сколько окислительной среды,  , состоящей из 50% кислорода и 50% азота, необходимо для горения 8 кг этилацетата, если коэффициент избытка равен 1,2; температура 265 К, давление 850 ГПа.
, состоящей из 50% кислорода и 50% азота, необходимо для горения 8 кг этилацетата, если коэффициент избытка равен 1,2; температура 265 К, давление 850 ГПа.
11. Определить коэффициент избытка окислительной среды, состоящей из 70% кислорода и 30% азота, если при горении серы содержание кислорода снизилось до 55%. Определить количество сгоревшей серы (кг), если объем помещения равен 180  .
.
12. Сколько антрацита (принять, что содержание углерода равно 100%) сгорело в помещении объемом 150  , если прекращение горения наступило при снижении кислорода до 13%. Газообмен не учитывать.
, если прекращение горения наступило при снижении кислорода до 13%. Газообмен не учитывать.
13. Рассчитать массовый и объемный расход воздуха, необходимый для горения фонтана дебитом 30 млн.  /сут., состоящего из
/сут., состоящего из  – 80%,
– 80%,  – 10%,
– 10%,  – 5%,
– 5%,  – 5% при температуре воздуха 27
– 5% при температуре воздуха 27  и давлении 105 КПа.
и давлении 105 КПа.
Домашнее задание
Рассчитать обьем и массу окислительной среды, необходимые для горения i -го горючего вещества (табл. 1.2).
Т а б л и ц а 1.2
| Номер варианта | Горючее вещество | Химическая формула | Кол-во горючего | Состав окислительной среды | Условия горения |
| 1 | Метиловой спирт | 
| 2 кг | Воздух | Т = 300 К
Р = 101325 Па
 = 3 = 3
|
| 2 | Анилин | 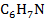
| 5 кг |  – 70% – 70%
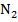 – 30% – 30%
| Т = 290 К
Р = 90000 Па
 = 2,5 = 2,5
|
| 3 | Смесь газов | СО – 45%
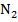 – 15% – 15%
 – 10% – 10%
 – 30% – 30%
| 3 
| Воздух | Нормальные
 = 1,8 = 1,8
|
| 4 | Нитробензол | 
| 30 кг | Воздух | Т = 280 К
Р = 98000 Па
 = 2,5 = 2,5
|
| 5 | Сложное вещество | С – 65% О – 20% Н – 5% S – 10% | 200 г | Воздух | Нормальные
 = 1,4 = 1,4
|
| 6 | Этилен | 
| 5 
|  – 25% – 25%
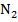 – 75% – 75%
| Нормальные
 = 2,5 = 2,5
|
| 7 | Сера | S | 2 кг |  – 60% – 60%
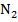 – 40% – 40%
| Т = 350 К
Р = 120000 Па
 = 1,8 = 1,8
|
| 8 | Сложное вещество | С – 90% Н – 3% N – 5% О – 2% | 1 кг | Воздух | Т = 300 К
Р = 95000 Па
 = 1,5 = 1,5
|
П р о д о л ж е н и е т а б л и ц ы 1.2
| Номер вариант | Горючее вещество | Химическая формула | Кол-во горючего | Состав окислительной среды | Условия горения |
| 9 | Смесь газов |  – 15% – 15%
 – 70% – 70%
 – 10% – 10%
 – 5% – 5%
|
5 
| Воздух |
Нормальные
 = 1,9 = 1,9
|
| 10 | Алюминий | Al | 15 кг |  – 42% – 42%
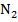 – 58% – 58%
| Нормальный
 = 2,8 = 2,8
|
| 11 | Сплав | Mg – 20% Al – 80% | 8 кг | Воздух | Т = 265 К
Р = 92000 Па
 = 1,5 = 1,5
|
| 12 | Муравьиная кислота | 
| 5 кг | Воздух | Нормальные
 = 1,2 = 1,2
|
| 13 | Диметиловый эфир |

| 10 кг | Воздух | Т = 300 К
Р = 95000 Па
 = 1,5 = 1,5
|
| 14 | Смесь газов |  – 25% – 25%
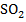 – 15% – 15%
 – 15% – 15%
 – 30% – 30%
 – 15% – 15%
|
15 
| Воздух |
Нормальные
 = 1,4 = 1,4
|
| 15 | Сложное вещество | С – 82% Н – 8% W – 10% | 0,7 кг | Воздух | Т = 260 К
Р = 110000 Па
 = 1,4 = 1,4
|
| 16 | Глицерин |

| 1 кг | Воздух | Т = 305 К
Р = 101300 Па
 = 1,9 = 1,9
|
| 17 | Ацетилен | 
| 150 л |  – 18% – 18%
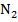 – 82% – 82%
| Нормальные
 = 1,8 = 1,8
|
| 18 | Смесь газов |  – 30% – 30%
 – 8% – 8%
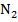 – 15% – 15%
 – 47% – 47%
|
3 
| Воздух |
Нормальные
 = 1,4 = 1,4
|
| 19 | Этиловый эфир уксусной кислоты |

| 5 кг | Воздух | Т = 270 К
Р = 85000 Па
 = 1,5 = 1,5
|
| 20 | Метилэтил кетон | 
| 5 кг | Воздух | Нормальные
 = 2,5 = 2,5
|
| 21 | Хлорбензол |

| 7 кг | Воздух | Т = 305 К
Р = 1000 Па
 = 2,8 = 2,8
|
| 22 | Нитротолуол | 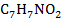
| 1 кг |  – 25% – 25%
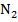 – 75% – 75%
| Т = 280 К
Р = 98000 Па
 = 1,4 = 1,4
|
О к о н ч а н и е т а б л и ц ы 1.2
| Номер варианта | Горючее вещество | Химическая формула | Кол-во горючего | Состав окислительной среды | Условия горения |
| 23 | Смесь газов |  – 25 % – 25 %
 – 25 % – 25 %
 – 15 % – 15 %
 – 30 % – 30 %
 – 5 % – 5 %
| 200 л | Воздух |
Нормальные
 = 1,8 = 1,8
|
| 24 | Бутиловый спирт |

| 4 кг | Воздух | Т = 265 К
Р = 120000 Па
 = 1,8 = 1,8
|
| 25 | Дибром-гексан |

| 3 кг |  – 65 % – 65 %
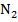 – 35 % – 35 %
| Т = 280 К
Р = 98000 Па
 = 1,7 = 1,7
|
| 26 | Сложное вещество | С – 70 % S – 5 % Н – 5% О – 20 % | 15 кг | Воздух | Т = 285 К
Р = 100000 Па
 = 2,8 = 2,8
|
| 27 | Смесь газов |  – 10 %
СО – 79 % – 10 %
СО – 79 %
 – 5 % – 5 %
 – 5 % – 5 %
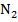 – 10 % – 10 %
|
10 
| Воздух |
Нормальные
 = 3,5 = 3,5
|
Примеры
П р и м е р 1. Какое количество продуктов горения выделится при сгорании 1 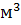 ацетилена в воздухе, если температура горения составила 1450 К.
ацетилена в воздухе, если температура горения составила 1450 К.
Р е ш е н и е. Горючее – индивидуальное химическое соединение (формула 1.17). Запишем уравнение химической реакции горения

Объем продуктов горения при нормальных условиях
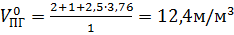 .
.
Объем продуктов горения при 1450 К
 .
.
П р и м е р 2. Определить объем продуктов горения при сгорании 1 кг фенола, если температура горения 1200 К, давление 95 00 Па, коэффициент избытка воздуха 1,5.
Р е ш е н и е. Горючее – индивидуальное химическое соединение (формула 1.18). Запишем уравнение химической реакции горения
 .
.
Молекулярная масса горючего 98.
Теоретический объем продуктов горения при нормальных условиях
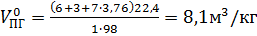 .
.
Практический объем воздуха при нормальных условиях (1.25)
 .
.
Объем продуктов горения при заданных условиях
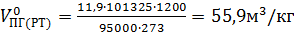 .
.
Пример 3. Определить объем продуктов горения при сгорании 1 кг органической массы состава: С – 55%, О – 13%, Н – 5%, S – 7%, N – 3%, W – 17%, если температура горения 1170 К, коэффициент избытка воздуха – 1,3.
Р е ш е н и е. горючее вещество сложного состава (формула 1.19 – 1.22). Теоретический состав продуктов горения при нормальных условиях
 ;
;
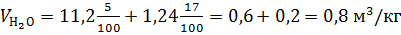 ;
;
 ;
;
 .
.
Полный теоретический объем продукт горения при нормальных условиях
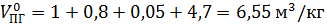 .
.
Практический объем продуктов горения при нормальных условиях
 .
.
Практически объем продуктов горения при температуре горения
 .
.
П р и м е р 4. Рассчитать объем продуктов горения при сгорании 1 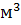 газовой смеси, состоящей из
газовой смеси, состоящей из  – 70%,
– 70%,  – 10%,
– 10%,  – 5%,
– 5%,  – 15%, если температура горения 1300 К, коэффициент избытка воздуха 2,8. Температура окружающей среды 298 К.
– 15%, если температура горения 1300 К, коэффициент избытка воздуха 2,8. Температура окружающей среды 298 К.
Р е ш е н и е. Горючее – смесь газов (формула 1.23)
 ,
,
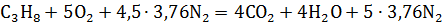 .
.
объем продуктов горения определим по формуле (1.23)
 ;
;
 .
.
Так как газовая смесь содержит в составе кислород, он будет окислять часть горючих компонентов, следовательно, понизится расход воздуха (формула 1.5).
В этом случае теоретический объем азота удобнее определять по формуле (1.29)
 .
.
Теоретический объем продуктов горения
 .
.
Практический объем продуктов горения (формулы 1.24, 1.25)
 .
.
Объем продуктов горения при температуре 1300 К
 .
.
П р и м е р 5. Определить состав продуктов горения метилэтилкетона.
Р е ш е н и е. При такой постановке задачи рациональнее определять непосредственно из уравнения горения объем продуктов в кмолях, выделившихся при сгорании 1 кмоля горючего
 ,
,
 кмоля;
кмоля; 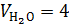 кмоля;
кмоля;  кмоля;
кмоля;  кмоля.
кмоля.
По формуле (1.26) находим состав продуктов горения
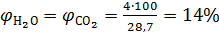 ,
,  .
.
П р и м е р 6. Определить объем и состав (% об.) продуктов горения 1 кг минерального масла состава: С – 85%, Н – 15%, если температура горения 1450 К, коэффициент избытка воздуха 1,9.
Р е ш е н и е. По формулам (1.19 – 1.22) определим объем продуктов горения
 ;
;
 ;
;
 .
.
Теоретический объем продуктов горения при нормальных условиях
 .
.
Практический объем продуктов горения при нормальных условиях (формула 1.25)
 .
.
объем продуктов горения при температуре 1450 К
 .
.
Очевидно, что состав продуктов горения не зависит от температуры горения, поэтому целесообразно определять его при нормальных условиях. По формулам (1.26, 1.28)
 ;
;  ;
;
 ;
;  .
.
П р и м е р 7. Определить количество сгоревшего ацетона, кг, если объем выделившейся двуокиси углерода, приведенный к нормальным условиям, составил 50 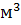 .
.
Р е ш е н и е. Запишем уравнение реакции горения ацетона в воздухе
 .
.
Из уравнения следует, что при горении из 58 кг (молекулярная масса ацетона) выделяется 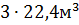 двуокиси углерода. Тогда для образования 50
двуокиси углерода. Тогда для образования 50 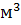 двуокиси углерода должно вступить в реакцию
двуокиси углерода должно вступить в реакцию  горючего
горючего
 .
.
П р и м е р 8. Определить количество сгоревшей органической массы состава: С – 58%, О – 22%, Н – 8%, N – 2%, W – 10% в помещении объемом 350 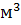 , если содержание двуокиси составило 5%.
, если содержание двуокиси составило 5%.
Р е ш е н и е. Определим объем выделившейся двуокиси углерода
 .
.
По формуле (1.19) для вещества сложного состава определим объем  , выделяющийся при горении 1 кг горючего,
, выделяющийся при горении 1 кг горючего,
 .
.
Определим количество
|
|
|

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!