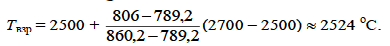Температура горения – температура продуктов горения в зоне химической реакции. Это максимальная температура зоны пламени.
Температура горения и взрыва определяется из уравнения теплового баланса

| (1.36)
|
При этом адиабатическая температура горения

| (1.37)
|
а действительная температура горения

| (1.38)
|
где  и
и 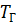 – соответственно адиабатическая и действительная температуры горения;
– соответственно адиабатическая и действительная температуры горения;  – начальная температура;
– начальная температура;  – объем i -го продукта горения;
– объем i -го продукта горения;  – низшая теплота горения вещества;
– низшая теплота горения вещества;  – теплота, пошедшая на нагрев продуктов горения;
– теплота, пошедшая на нагрев продуктов горения;  – теплоемкость i -го продукта горения при постоянном объеме.
– теплоемкость i -го продукта горения при постоянном объеме.
При этом

| (1.39)
|
где ƞ – доля теплопотерь в результате излучения энергии, химического и механического недожога.
Расчет температуры горения по формуле (1.37) или (1.38) может быть проведен только методом последовательных приближений, поскольку теплоемкость газов зависит от температуры горения (табл. 1.7)
Т а б л и ц а 1.7
| №
п/п
| Определенные параметры
| Примечание
| |
| 1
| объем и состав продуктов горения
|  (§1.2) (§1.2)
кмоль/кмоль,  /кг /кг
| |
| 2
| Низшая теплота сгорания или количество тепла, пошедшего на нагрев продуктов горения (при наличии теплопотерь)
|  или или  (§1.3) (§1.3)
кДж/кмоль, кДж/кг
| |
| 3
| Среднее значение энтальпии продуктов горения
| 
| (1.40)
| |
| 4
| Температура горения 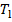 по средней энтальпии с помощью табл. 1 а или 1 б, ориентируясь на азот (наибольшее содержание в продуктах горения) по средней энтальпии с помощью табл. 1 а или 1 б, ориентируясь на азот (наибольшее содержание в продуктах горения)
|
|
| |
| 5
| Теплосодержание продуктов горения с температурой 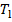 (табл. 1 а, 1 б прил.) (табл. 1 а, 1 б прил.)
| 
|
(1.41)
|
(1.41)
|
| 6
| Если  , то , то  (в том случае, если (в том случае, если  , то , то  ) )
|  – энтальпия i -го продукта горения; – энтальпия i -го продукта горения;  - объем i -го продукта горения - объем i -го продукта горения
| |
| 7
|  по формуле (1.41) по формуле (1.41)
|
| |
| 8
| Расчет проводим до получения неравенства 
|
| |
| 9
| Температура горения
| 
| (1.42)
| |
| | | | | | |
Температура взрыва, протекающего в изохорно-адиабатическом режиме (при постоянном объеме) рассчитывается по уравнению теплового баланса (1.36) по методике, приведенной в табл. 1.7. Отличие заключается в том, что при расчетах вместо средней энтальпии продуктов горения и их теплосодержания (пп. 3-7) используется значение внутренней энергии газов (табл. 2 приложения). Внутренняя энергия газов
 ,
,
где  – теплоемкость при постоянном объеме, кДж/(моль
– теплоемкость при постоянном объеме, кДж/(моль  К), кДж/(
К), кДж/(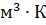 ).
).
Действительная температура горения на пожаре для большинства газообразных, жидких и твердых веществ изменяется в достаточно узких пределах (1300-1800 К). В связи в эти расчетная оценка действительной температуры горения может быть значительно упрощена, если теплоемкость продуктов горения выбирать при температуре 1500 К:
 , ,
| (1.43)
|
где  - теплоемкость i -го продукта при горении 1500 К (табл. 1.8).
- теплоемкость i -го продукта при горении 1500 К (табл. 1.8).
Т а б л и ц а 1.8
| Вещество
| Теплоемкость
|
кДж/( ) )
| кДж/( ) )
|

| 2,27
| 50,85 
|
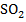
| 2,28
| 51,07 
|
 (пар) (пар)
| 1,78
| 39,87 
|
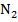
| 1,42
| 31,81 
|
| Воздух
| 1,44
| 32,27 
|
Примеры
П р и м е р 1. Определить адиабатическую температуру горения этилового спирта в воздухе.
Р е ш е н и е. Расчет проводим по схеме, приведенной в табл. 1.7.
1. Так как горючее – индивидуальное вещество, для определения обьема и состава продуктов горения запишем уравнение химической реакции горения
 .
.
Следовательно, продукты горения состоят из:  = 2 моля,
= 2 моля,  = 3 моля,
= 3 моля,  = 11,28 моля,
= 11,28 моля,  = 16,28 моля.
= 16,28 моля.
2. Низшую теплоту сгорания определим по формуле (1.30). Из табл. 3 приложения находим теплоту образования горючего – 287,2 кДж/моль
 .
.
3. Средняя энтальпия продуктов горения
 .
.
4. Так как  выражена в кДж/моль, по табл. 1 а приложения выбираем, ориентируясь на азот, первую приближенную температуру горения
выражена в кДж/моль, по табл. 1 а приложения выбираем, ориентируясь на азот, первую приближенную температуру горения  .
.
5. Рассчитываем теплосодержание продуктов горения при  по формуле (1.41).
по формуле (1.41).
 .
.
6. Сравниваем QH и Q'^, так как Q'^ > QH, выбираем температуру горения равной 2000 оС.
7. Рассчитываем теплосодержание продуктов горения при 2000 оС:
Q;r = 108,6-2 + 88,1,6-3 + 66,8-11,28 = 1235 кДж/моль.
8. Так как < Q < Q rr, определим температуру горения по
формуле (1.42)

П р и м е р 2. Определить адиабатическую температуру горения
органической массы, состоящей из С - 60 %, Н - 7 %, О - 25 %, W- 8 %.
Р е ш е н и е. 1. Так как горючее представляет собой сложное вещество, состав продуктов горения рассчитываем по формулам (1.19 -
1.21)

Общий объем продуктов горения равен V ir = 7,01 м3/кг.
9. Определим низшую теплоту сгорания вещества по формуле Д.И. Менделеева (1.31)
Q n = 339,4-60 + 1157-7 - 108,9-25 - 25,1(9-7 + 8)= 23958,4 кДж/кг.
10. Определим среднюю энтальпию продуктов горения

4. Так как величина энтальпии рассчитана в кДж/м3, первую приближенную температуру выбираем по табл. 1 б приложения. Ориентируясь на азот, принимаем Т 1 = 2100 оС.
5. Рассчитываем теплосодержание продуктов горения при 2100 оС по формуле (1.41)

6. Из сравнения  выбираем вторую
выбираем вторую
приближенную температуру, равную 1900 оС.
7. Рассчитываем теплосодержание продуктов горения при 19000С
Q ¢¢ = 4579,7×1,12 + 3693,5×0,88 + 2818,2×5,1 = 22498,8 кДж/кг. 8. Так как ПГ
ПГ Н
Q ¢¢ < Q < Q, определим температуру горения

П р и м е р 3. Рассчитать действительную температуру горения фенола (D H обр = 4,2 кДж/моль), если потери тепла излучением составили 25 % от Q н, а коэффициент избытка воздуха при горении 2,2.
Р е ш е н и е. 1. Определим состав продуктов горения:
C6H5OH + 7O2 + 7×3,76N2 = 6CO2 + 3H2O + 7×3,76N2,

2. Определим низшую теплоту сгорания фенола (формула 1.30):
Q Н = 7×396,9 + 3×242,2 - 1×4,2 = 3500,7 кДж/моль,
так как по условию задачи 25 % тепла теряется, определим количество тепла, пошедшее на нагрев продуктов горения (теплосодержание продуктов горения при температуре горения) (формула 1.39)
Q ПГ = 3500,7(1 - 0,25) = 2625,5 кДж/моль.
По формуле (1.43) определим действительную температуру горения

П р и м е р 4. Рассчитать температуру взрыва метановоздушной смеси стехиометрического состава.
Р е ш е н и е. Расчет проводим по схеме, представленной в табл. 1.7. 1. Объем и состав продуктов горения
СН4 + 2О2 + 2×3,76N2 = СО2 + 2Н2О + 2×3,76N2.
Продукты горения 
2×3,76 = 7,5 кмоль/кмоль.
2. Низшая теплота сгорания:
Q Н= 1×396,6 + 2×242,2 – 75 = 806 кДж/моль.
3. Средняя внутренняя энергия продуктов горения

4. По табл. 2 приложения принимаем первую приближенную температуру взрыва (по азоту) Т 1 = 2700 оС.
5. Рассчитываем внутреннюю энергию продуктов горения при
т1: U 1 = å V пг i × U i = 1×128,9 + 2×102,4 + 7,5×70,2 = 860,2 кДж/моль.
6. Сравнение значение Q Н и U 1 показывает, что Т 1 завышена.
7. Выбираем Т 2 = 2500 оС.
U 2 = 1×118,3 + 2×94,3 + 7,5×64,3 = 789,2 кДж/моль.
8. Так как U 1 > Q Н > U 2
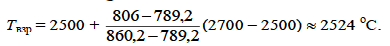
Контрольные задачи
1. Определить, как изменяется адиабатическая температура горения в гомологическом ряду предельных углеводородов (на примере метана, пропана, пентана и гептана). Построить график зависимости температуры горения от молекулярной массы горючего вещества.
2. Определить, как изменяется адиабатическая температура горения древесины состава: C – 49 %, H – 8 %, O – 43 %, если содержание влаги (сверх 100 %) cоставляет 0, 5, 15 %. Построить график зависимости температуры горения от влажности горючего.
П р и м е ч а н и е. При решении задачи необходимо состав древесины пересчитать так, чтобы количество всех компонентов (в том числе и воды) составляло 100 %
3. Определить, как изменится адиабатическая температура горения бензола в воздухе и окислительной среде, содержащей 25, 30, и 40% кислорода. Построить график зависимости температуры горения от содержания кислорода.
4. Рассчитать действительную температуру горения газовой смеси, состоящей из 45 % H2, 30 % C3H8, 15 % O2, 10 % N2, если потери тепла составили 30 % от Q Н, а коэффициент избытка воздуха при горении равен 1,8.
5. Определить количество сгоревшего антрацита (С = 100 %) в помещении объемом 180 м3, если среднеобъемная температура возросла с 305 до 625 К.
6. Рассчитать действительную температуру горения бутано-воздушной смеси стехиометрической концентрации на нижнем концент-рационном пределе воспламенения (1,9 % бутана и 98,1 % воздуха), если потери тепла излучением составили 20 % от низшей теплоты сгорания.
7. Определить, как изменится температура горения ацетилена при разбавлении его азотом в количестве 10, 20, 30 %, если потери тепла излучением составляют 25 % от низшей теплоты сгорания, коэффициент избытка воздуха 1,2. Построить график зависимости температуры от содержания азота в ацетилене.
8. Определить время горения толуола, при котором температура в помещении объемом 400 м3 повысится с 295 до 375 К, если скорость его выгорания 0,015 кг/(м2×с), а площадь пожара 50 м2. При расчете пренебречь приращением объема продуктов горения над расходуемым воздухом.
Домашнее задание
Рассчитать температуру горения i -го вещества (табл. 1.9).
| Номер
варианта
| Горючее вещество
| Химическая формула
| Состав
окислительной
среды
| Условия горения
|
| 1
| Смесь газов
| CO - 40 %,
CsHs - 50 %,
CO2 - 10 %
| Воздух
| a = 1,4 h = 0,25
|
| 2
| Вещество
| C - 80 %, H - 5 %,
|
| a = 1,6
|
|
| сложного состава
| S - 6 %, W - 9 %
| - «-
| h = 0,3
|
| 3
| Пропионовая
кислота
| СзН6О2
| O2 - 25 %,
N2 - 75 %
| a = 1,3 h = 0,4
|
| 4
| Глицерин
| C3H8O3
| Воздух
| a = 1,0 h = 0,35
|
| 5
| Уксуснобутиловый эфир
| C6H12O2
| - «-
| a = 1,4 h = 0,15
|
| 6
| Этилбензол
| СвНю
| - «-
| a = 1,5 h = 0,2
|
| 7
| Вещество
сложного состава
| С - 82 %, H - 8 %, О - 5 %, W - 5 %
| - «-
| a = 1,0 h = 0,35
|
| 8
| Смесь газов
| СО - 60 %,
H - 40 %
| - «-
| a = 1,8 h = 0,4
|
| 9
| Аммиак
| NH3
| - «-
| a = 1,0 h = 0,2
|
| 10
| Гексан
| GHm
| - «-
| a = 1,4 h = 0,15
|
| 11
| Нитроэтан
| C2H5NO2
| - «-
| a = 1,5 h = 0,2
|
| 12
| Гексиловый спирт
| C6H14O
| Воздух
| a = 2,0 h = 0,1
|
|
| О к о н ч а н и е т а б л. 1.9
|
| Номер
варианта
| Горючее вещество
| Химическая формула
| Состав
окислительной
среды
| Условия горения
|
| 14
| Вещество
сложного состава
| C - 75 %, H - 8 %,
C - 12 %, W - 5 %
| - «-
| a = 1,0 h = 0,4
|
| 15
| Смесь газов
| CH4 - 70 %,
NH3 - 20 %,
O2 - 10 %
| - «-
| a = 1,8 h = 0,2
|
| 16
| Муравьиная
кислота
| CH2O2
| O2 - 25 %,
N2 - 75 %
| a = 2,2 h = 0,3
|
| 17
| Вещество сложного состава
| C - 56 %,
H - 14 %,
O - 20 %,
W - 10 %
| Воздух
| a = 1,0 h = 0,4
|
| 18
| Вещество сложного состава
| C - 78 %,
H - 12 %,
O - 10 %
| - «-
| a = 1,6 h = 0,15
|
| 19
| Смесь газов
| CO - 75 %,
CH4 - 25 %
| - «-
| a = 1,9 h = 0,2
|
| 20
| Смесь газов
| C3H8 - 70 %,
C4H10 - 20 %,
O2 - 10 %
| - «-
| a = 1,8 h = 0,2
|
| 21
| Вещество сложного состава
| C - 85 %,
H - 10 %, O - 5 %
| - «-
| a = 1,4 h = 0,3
|
| 22
| Смесь газов
| C2H6 - 75 %,
CH4 - 20 %,
O2 - 5 %
| - «-
| a = 1,7 h = 0,22
|
| 23
| Вещество сложного состава
| C - 70 %,
H - 16 %,
O - 14 %
| - «-
| a = 1,2 h = 0,35
|
| 24
| Смесь газов
| CO - 50 %,
CH4 - 30 %,
CO2 - 20 %
| - «-
| a = 1,9 h = 0,15
|
| 25
| Вещество сложного состава
| C - 77 %,
H - 13 %,
N - 4 %, O - 6 %
| - «-
| a = 1,0 h = 0,45
|
| 26
| Этилен
| C2H4
| O2 - 30 %
N2 - 70 %
| a = 1,5 h = 0,4
|
| 27
| Амиловый спирт
| C5H12O
| Воздух
| a = 2,0 h = 0,15
|






 и
и 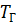 – соответственно адиабатическая и действительная температуры горения;
– соответственно адиабатическая и действительная температуры горения;  – начальная температура;
– начальная температура;  – объем i -го продукта горения;
– объем i -го продукта горения;  – низшая теплота горения вещества;
– низшая теплота горения вещества;  – теплота, пошедшая на нагрев продуктов горения;
– теплота, пошедшая на нагрев продуктов горения;  – теплоемкость i -го продукта горения при постоянном объеме.
– теплоемкость i -го продукта горения при постоянном объеме.
 (§1.2)
(§1.2) /кг
/кг или
или  (§1.3)
(§1.3)
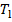 по средней энтальпии с помощью табл. 1 а или 1 б, ориентируясь на азот (наибольшее содержание в продуктах горения)
по средней энтальпии с помощью табл. 1 а или 1 б, ориентируясь на азот (наибольшее содержание в продуктах горения)

 , то
, то  (в том случае, если
(в том случае, если  , то
, то  )
)
 – энтальпия i -го продукта горения;
– энтальпия i -го продукта горения;  - объем i -го продукта горения
- объем i -го продукта горения по формуле (1.41)
по формуле (1.41)


 ,
, – теплоемкость при постоянном объеме, кДж/(моль
– теплоемкость при постоянном объеме, кДж/(моль  К), кДж/(
К), кДж/(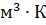 ).
). ,
,
 - теплоемкость i -го продукта при горении 1500 К (табл. 1.8).
- теплоемкость i -го продукта при горении 1500 К (табл. 1.8). )
)
 )
)


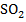
 (пар)
(пар)
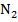
 .
. = 2 моля,
= 2 моля,  = 3 моля,
= 3 моля,  = 11,28 моля,
= 11,28 моля,  = 16,28 моля.
= 16,28 моля. .
. .
. выражена в кДж/моль, по табл. 1 а приложения выбираем, ориентируясь на азот, первую приближенную температуру горения
выражена в кДж/моль, по табл. 1 а приложения выбираем, ориентируясь на азот, первую приближенную температуру горения  .
. по формуле (1.41).
по формуле (1.41). .
.



 выбираем вторую
выбираем вторую