
откуда вытекает уравнение Р. Майера для идеального газа:
 . (6.12)
. (6.12)
Изотермический процесс
(Т = const) р V= const;(т = соnst, μ = const);
D T = 0, D U = 0, Q = A, (6.13)
т.е. теплота, сообщенная газу, полностью идет на совершение работы против внешних сил:
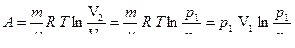 . (6.14)
. (6.14)
Адиабатный процесс
Адиабатным называется процесс, при котором отсутствует теплообмен (Q = 0) между термодинамической системой и окружающей средой.
Из первого начала термодинамики для адиабатного процесса следует
 (6.15)
(6.15)
т.е. работа газа против внешних сил совершается за счет убыли его внутренней энергии.
Соотношение между двумя параметрами состояния идеального газа при адиабатном процессе:
 ; (6.16)
; (6.16)


 (6.16а)
(6.16а)
где g =  - показатель адиабаты или коэффициент Пуассона.
- показатель адиабаты или коэффициент Пуассона.
Работа, совершаемая газом при адиабатном процессе:
 (6.17)
(6.17)
или, учитывая, что 
 ; (6.17а)
; (6.17а)
 . (6.17б)
. (6.17б)
Теплоемкость одного моля и удельная теплоемкость при постоянном объеме определяются соответственно по формулам

 ; (6.18)
; (6.18)

 . (6.19)
. (6.19)
Теплоемкость одного моля и удельная теплоемкость при постоянном давлении:

 ; (6.20)
; (6.20)
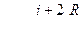
 . (6.21)
. (6.21)
Отношение теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме п показатель адиабаты:
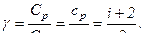 (6.22)
(6.22)
В формулах (6.18 - 6.22) i – число степеней свободы.
Методика решения задач
1. Определить вид процесса, происходящего в газе. Для этого найти, какая величина – р, V или Т - остается постоянной.
2. Записать первое начало термодинамики в интегральной форме.
3. Применить первое начало к данному процессу. Для этого: а) определить, совершается ли в данном процессе работа. Элементарная работа d А = р d V. Если происходит изменение объема, значит, работа совершается. Записать формулу полной работы, взяв интеграл 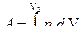 с учетом процесса; б) найти изменение внутренней энергии
с учетом процесса; б) найти изменение внутренней энергии  или
или  ; в) определить количество теплоты, сообщенное газу,
; в) определить количество теплоты, сообщенное газу,  или
или  .
.
4. Решить задачу численно, найдя нужные параметры, используя при этом уравнения изопроцессов или уравнение Менделеева – Клапейрона  .
.
I часть
Примеры решения задач
Задача 1. 10 г кислорода находятся под давлением 3 . 105 Па при температуре 100С. После нагревания при постоянном давлении газ занял объем 10 л. Найти: 1) количество тепла, полученное газом; 2) изменение внутренней энергии газа; 3) совершенную газом работу.

 Дано:
Дано:
т = 10 г = 10 –2 кг
m = 32 . 10-3 
р = 3 . 105 Па = const
t = 100 С; Т = 283 К
 V2 = 10 л = 10-2 м3
V2 = 10 л = 10-2 м3
А -?D U -? Q -?
где р – давление газа; d V – бесконечно малое изменение его объема. Из условия задачи видно, что d V> 0, т.е. газ расширяется, тогда работа d А > 0, т.е. работа совершается газом против внешних сил. Полная работа расширения
 .
.
б) Изменение внутренней энергии равно

где D Т – изменение температуры; i – число степеней свободы молекулы кислорода (i = 5, так как кислород – двухатомный газ).
в) Количество теплоты, полученное газом при нагревании, может быть найдено как сумма А и D U, или с помощью молярной теплоемкости Ср:

4. Решим задачу численно, сделав некоторые преобразования формул и вычислив недостающие параметры газа.

Используем два уравнения Менделеева – Клапейрона для состояния 1 и 2:


(Справедливо только для изобарного процесса).

Найдем D Т: D Т = Т 2 – Т 1;  – из уравнения Менделеева – Клапейрона для второго состояния.
– из уравнения Менделеева – Клапейрона для второго состояния.
D Т = Т 2 – Т 1 = 
Тогда работа
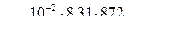 Дж.
Дж.
Изменение внутренней энергии
 Дж.
Дж.
Количество теплоты
 Дж.
Дж.
 .
.
Ответ: А = 2265 Дж; D U = 5660 Дж; Q = 7920 Дж.
Задача 2. В закрытом сосуде объемом V = 10 л находится воздух при давлении 105 Па. Какое количество теплоты нужно сообщить газу, чтобы повысить его давление в 5 раз?
 Дано: Решение
Дано: Решение
V = 10 –2 м3 1) Из условия задачи следует, что процесс изохорный,
р 1 = 10 5 Па так как сосуд закрытый. Следовательно, V = const.
р 2 = 5 р 1 2) Q = D U + A – первое начало термодинамики.
 i = 5 3) Применим I начало к изохорному процессу:
i = 5 3) Применим I начало к изохорному процессу:
Q -? а) 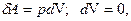 следовательно, d А = 0;
следовательно, d А = 0;
б)  ;
;
в)  .
.
4) Вычислим разность температур, пользуясь уравнениями состояния для 1 и 2 состояний:
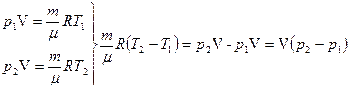 .
.
Тогда

Ответ: Q = 104 Дж.
Задача 3. Некоторая масса азота при давлении р 1 = 1 атм имела объем V1 = 5 л, а при давлении р 2 = 3 атм – объем V2 = 2 л. Переход от первого состояния ко второму сделан в два этапа – сначала по изохоре, затем по изобаре. Определить изменение внутренней энергии, количество теплоты и произведенную работу.
 Дано: Решение Решение
Дано: Решение Решение
 m = 28 . 10-3
m = 28 . 10-3 
i = 5
p 1 = 1 атм = 105Па
р 2 = 3 атм = 3 .105Па
V1 = 5 л = 5 .10-3м3
V2 = 2 л = 2 .10-3м3
 D U -? A -? Q -?
D U -? A -? Q -?
1) V = const – I процесс; р = сonst – II процесс.
I процесс – изохорное нагревание; II процесс – изобарное сжатие.
2) Первое начало термодинамики

3) а)  ;
;

Работа в изобарном сжатии на участке 2-3 отрицательна, так как объем газа уменьшается, газ сжимается под действием внешних сил:
 .
.
б) 

Изменение внутренней энергии зависит только от начального и конечного состояния системы и не зависит от пути перехода.
в) Q = D U + A.
Вычисления:

– работу совершают внешние силы.

Работа совершается над газом, тепло отводится от газа, газ нагревается (D U > 0).
Ответ: А = -900 Дж; D U = 250 Дж; Q = -750 Дж.
Задача 4. 10,5 г азота изотермически расширяются при температуре
–23 0С от р 1 = 2,5 атм до р 2 = 1 атм. Найти работу, совершенную при расширении, изменение внутренней энергии и количество тепла, переданное газу.
 Дано: Решение Решение
Дано: Решение Решение
 т = 10,5 г = 10,5 . 10-3 кг
т = 10,5 г = 10,5 . 10-3 кг
m = 28 . 10-3 
t 1 = -230C; T 1 = 250 К
р 1 = 2,5 атм = 2,5 . 105 Па
р 2 = 1 атм = 1 . 105 Па
 А -?D U -? Q -?
А -?D U -? Q -?

так как процесс изотермический, то  т.е.
т.е. 
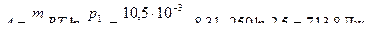
Ответ: А = 713,8 Дж.
Задача 5. 7 г углекислого газа СО2 было нагрето на D Т = 10 К в условиях свободного расширения. Найти работу расширения газа и изменение его внутренней энергии.
 Дано: Решение
Дано: Решение
 i = 6
i = 6
m = 7 . 10-3кг
m = 44 . 10-3 
D Т = 10 К
А -? D U -? 
 ;
;
T 2 – T 1 = D T;
б)  .
.
Вычисления:

Ответ: А = 13 Дж; D U = 39 Дж.
Задачи для самостоятельного решения
Задача 1. В баллоне емкостью V = 10 дм3 находится кислород при температуре 27 0С и давлении 107 Па. Нагреваясь солнечными лучами, кислород получил 8350 Дж тепла. Определить температуру и давление кислорода после нагревания.
Ответ: Т 2 = 310 К; р 2 = 1,03 . 107 Па.
Задача 2. В закрытом сосуде находится 28 г азота и 32 г кислорода. Найти изменение внутренней энергии этой смеси при ее охлаждении на 28 К.
Ответ: D U = 1163 Дж.
Задача 3. Движение одного из видов торпеды в воде вызывается действием сжатого воздуха, находящегося в резервуаре при торпеде. Какую работу произведет сжатый воздух в двигателе торпеды, если давление в резервуаре р 1 = 100 атм; р 2 = 1 атм, объем резервуара V1 = 5 л. Температуру считать постоянной.
Ответ: А = 2,3 .105 Дж.
Задача 4. Сколько теплоты поглощают 200 г водорода, нагреваясь в пределах 0…100 0С при постоянном давлении? Каков прирост внутренней энергии газа? Какую работу совершает газ?
Ответ: Q = 2,91 . 105 Дж; D U = 2,08 . 105 Дж; А = 8,32 . 104 Дж.
Задача 5. Азот массой т = 5 кг, нагретый на D Т = 150 К, сохранил неизменный объем V. Найти теплоту Q, сообщенную газу, изменение внутренней энергии D U, и совершенную газом работу А.
Ответ: Q = D U = 5,56 . 105 Дж; А = 0.
Задача 6. Водород занимает объем V = 10 м3 при давлении р 1 = 105 Па. Газ нагрели при постоянном объеме до давления р 2 = 3 .105 Па. Определить изменение внутренней энергии газа, работу, совершенную газом и теплоту, сообщенную газу.
Ответ: D U = 5 . 106 Дж; А = 0; Q = 5 . 106 Дж.
Задача 7. Кислород был нагрет при постоянном объеме V = 50 л. При этом давление газа изменилось на D р = 5 атм. Найти теплоту, сообщенную газу.
Ответ: Q = 63 кДж.
Задача 8. Баллон емкостью V = 20 л содержит водород при температуре t 1 = 27 0С под давлением р = 3,7 атм. Каковы будут температура и давление, если газу сообщить теплоту Q = 6,3 .103 Дж.
Ответ: t 2 =129 0С; р = 5,02 . 105 Па
Задача 9. Кислород при неизменном давлении р = 0,8 ×105 Па нагревается. Его объем увеличивается от V1 = 1 м3 до V2 = 3 м3. Определить изменение внутренней энергии кислорода, работу, совершенную им при расширении, а также теплоту, сообщенную газу.
Ответ: D U = 4 . 105 Дж; А = 1,6 . 105 Дж; Q = 5,6 .105 Дж.
Задача 10. Азот нагревался при постоянном давлении, причем ему была сообщена теплота Q = 2,1 . 104 Дж. Какую работу совершил при этом газ? Каково было изменение внутренней энергии?
Ответ: А = 6 . 103 Дж; D U = 1,5 . 104 Дж.
Задача 11. Гелий массой т = 1 г был нагрет на D Т = 100 К при постоянном давлении. Определить теплоту, переданную газу, работу расширения и приращение внутренней энергии газа.
Ответ: Q = 520 Дж; А = 208 Дж; D U = 312 Дж.
Задача 12. Кислород массой т = 2 кг занимает объем V1 = 1 м3 и находится под давлением р 1 = 2 атм. Газ был нагрет сначала при постоянном давлении до объема V2 = 3 м3, а затем при постоянном объеме до давления р 3 = 5 атм. Найти изменение внутренней энергии газа, совершенную газом работу, и теплоту, переданную газу. Построить график процесса.
Ответ: D U = 3,27 . 106 Дж; А = 4,04 . 105 Дж; Q = 3,67 . 106 Дж.
Задача 13. Водород массой т = 4 г нагрет на D Т = 10 К при постоянном давлении р. Определить работу расширения газа.
Ответ: А = 166 Дж.
Задача 14. Газ, занимавший объем V = 11 л под давлением р = 1 атм, был изобарически нагрет от t 1 = 20 0С до t 2 = 100 0С. Определить работу расширения газа.
Ответ: А = 303 Дж.
Задача 15*. Какая доля теплоты Q, подводимой к газу при изобарическом процессе, расходуется на увеличение внутренней энергии газа и какая – на работу расширения. Рассмотреть случаи: 1) одноатомного; 2) двухатомного и 3) трехатомного газа.
Ответ: 1) D U = 0,6 Q; A = 0,4 Q; 2) D U = 0,71 Q; A = 0,29 Q;
3) D U = 0,75 Q; A = 0,25 Q.
Задача 16. Углекислый газ расширяется при постоянном давлении. Определить работу расширения, если газу передана теплота Q = 4200 Дж.
Ответ: А = 1050 Дж.
Задача 17. На нагревание кислорода массой т = 160 г на D Т = 12 К была затрачена теплота Q = 1760 Дж. Как протекал процесс: при постоянном объеме или при постоянном давлении?
Ответ: при р = const.
Задача 18. Какая работа совершается при изотермическом расширении водорода массой т = 5 г, взятого при температуре t = 11 0С, если объем газа увеличивается в три раза.
Ответ: А = 6500 Дж.
Задача 19. Азот массой т = 200 г расширяется изотермически при температуре t = 7 0С, причем объем газа увеличивается в 2 раза. Найти:
1) изменение внутренней энергии газа; 2) совершенную при расширении работу; 3) теплоту, полученную газом.
Ответ: D U = 0; А = 11600 Дж; Q = 11600 Дж.
Задача 20. В цилиндре под поршнем находится азот массой
т = 0,6 кг, занимающий объем V1 = 1,2 м3 при температуре Т = 560 К. В результате расширения газ занял объем V2 = 4,2 м3, причем температура осталась неизменной. Найти изменение внутренней энергии газа, совершенную им работу, и теплоту, сообщенную газу.
Ответ: D U = 0; А = 1,26 . 105 Дж; Q = 1,26 . 105 Дж.
Задача 21. Водород массой 10 г нагрели на D Т = 200 К, причем газу была передана теплота Q = 3,35 . 104 Дж. Найти изменение внутренней энергии водорода и совершенную им работу.
Ответ: D U = 2,09 . 104 Дж; А = 1,26 . 104 Дж.
Задача 22. При изотермическом расширении водорода массой т = 1 г, имевшего температуру Т = 280 К, объем газа увеличился в три раза. Определить работу расширения газа.
Ответ: А = 1280 Дж.
Задача 23. Азот, занимавший объем V1 = 10 л под давлением
р = 2 атм, изотермически расширился до объема V2 = 28 л. Определить работу расширения газа.
Ответ: А = 2,08 . 103 Дж.
Задача 24. При изотермическом расширении одного моля кислорода, имевшего температуру Т = 300 К, газ поглотил теплоту Q = 1743 Дж. Во сколько раз увеличился объем газа?
Ответ:  .
.
Задача 25. Сколько теплоты выделится, если азот массой т = 1 г, взятый при температуре 273 К под давлением р 1 = 1 атм, изотермически сжать до давления р 2 = 10 атм?
Ответ: Q = 187 Дж.
Задача 26. Расширяясь, водород совершил работу А = 4185 Дж. Сколько теплоты Q было подведено к газу, если газ расширялся:
1) изобарически; 2) изотермически.
Ответ: 1) Q = 14700 Дж; 2) Q = 4185 Дж.
Задача 27. В процессе нагревания 10 г водорода сообщили 4,2 .104 Дж теплоты. При этом его температура поднялась на D Т = 200 К. Определить изменение внутренней энергии газа и совершенную им работу.
Ответ: D U = 2,08 . 104 Дж; А = 2,12 . 104 Дж.
Задача 28. При сжатии газовой смеси, содержащей по 160 г кислорода и метана, совершена работа А = 4,187 кДж. Температура смеси поднялась на D Т = 1 К. Сколько тепла выделилось в этом процессе?
Ответ: Q = 4540 Дж.
Задача 29. Некоторое количество идеального газа с одноатомными молекулами совершило при давлении р = 105 Па изобарический процесс, в ходе которого объем газа изменился от V1 = 10 л до V2 = 20 л. Определить изменение внутренней энергии газа; совершенную им работу; количество полученного газом тепла.
Ответ: D U = 1,5 . 103 Дж; А = 103 Дж; Q = 2,5 . 103 Дж.
Задача 30. Кислород нагрет при постоянном объеме V = 150 л. При этом давление газа изменилось на D р = 5 . 105 Па. Найти теплоту, сообщенную газу, и изменение его внутренней энергии.
Ответ: Q = D U = 1,875. 105 Дж.
Задача 31. Азот массой m =10 г находится при температуре Т = 290 К. Определите: 1) среднюю кинетическую энергию одной молекулы азота;
2) среднюю кинетическую энергию вращательного движения всех молекул азота. Газ считайте идеальным.
Ответ: 1)  Дж; 2)
Дж; 2)  Дж.
Дж.
Задача 32. Кислород массой m =1 кг находится при температуре
Т = 320 К. Определите: 1) внутреннюю энергию молекул кислорода;
2) среднюю кинетическую энергию вращательного движения молекул кислорода. Газ считайте идеальным.
Ответ: 1) U = 208 кДж; 2)  кДж.
кДж.
Задача 33. В закрытом сосуде находится смесь азота массой m 1 = 56 г и кислорода массой m 2 = 64 г. Определите изменение внутренней энергии этой смеси, если ее охладили на 20 °С.
Ответ:  кДж.
кДж.
Задача 34. Считая азот идеальным газом, определите его удельную теплоемкость: 1) для изохорного процесса; 2) для изобарного процесса.
Ответ: 1)  ; 2)
; 2)  .
.
Задача 35. Определите удельные теплоемкости с v и ср, если известно, что некоторый газ при нормальных условиях имеет удельный объем
v = 0,7  . Что это за газ?
. Что это за газ?
Ответ: кислород; cv = 649  , cp = 909
, cp = 909  .
.
Задача 36. Кислород массой 32 г находится в закрытом сосуде под давлением 0,1 МПа при температуре 290 К. После нагревания давление в сосуде повысилось в 4 раза. Определите: 1) объем сосуда; 2) температуру, до которой газ нагрели; 3) количество теплоты, сообщенное газом.
Ответ: 1) V = 2,41×10-2 м3; 2) Т = 1,16 кК; 3) Q = 18,1 кДж.
Задача 37. Кислород объемом 1 л находится под давлением 1МПа. Определите, какое количество теплоты необходимо сообщить газу, чтобы: 1) увеличить его объем вдвое в результате изобарного процесса; 2) увеличить его давление вдвое в результате изохорного процесса.
Ответ: 1) Q1 = 3,5 кДж; 2) Q2 = 2,5 кДж.
II часть
Примеры решения задач
Задача 1. Необходимо сжать воздух от объема 10–2 м3 до объема 2 .10–3 м3. Как выгоднее сжимать: адиабатически или изотермически?
 Дано: Решение
Дано: Решение
 V1 = 10–2 м3
V1 = 10–2 м3
V2 = 2 .10–3 м3


1. Построим графики изотермического и адиабатического сжатия в координатах p,V.
Начальное состояние воздуха определяется параметрами p 1 V1 T 1. Объем V2 для обоих процессов является конечным и задан в условии задачи.
Уравнение адиабаты  .
.
Уравнение изотермы  .
.
 Показатель адиабаты
Показатель адиабаты  где i = 5, так как воздух состоит в основном из двухатомных газов; g = 1,4. Отсюда следует, что адиабата круче изотермы; при сжатии давление в адиабатическом процессе изменяется на большую величину, т. е. р 2I > p 2 (рис. 6.1).
где i = 5, так как воздух состоит в основном из двухатомных газов; g = 1,4. Отсюда следует, что адиабата круче изотермы; при сжатии давление в адиабатическом процессе изменяется на большую величину, т. е. р 2I > p 2 (рис. 6.1).
Работа в любом процессе может быть найдена как 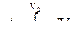 Интеграл графически изображается и может быть вычислен как площадь криволинейной трапеции, образованной кривой и ординатами V1 и V2. Из графика видно, что площадь, ограниченная адиабатой больше, чем площадь под изотермой. Следовательно, работа адиабатического сжатия больше, чем изотермического. Поскольку работу при сжатии газа совершают внешние силы, то сжимать газ выгоднее изотермически.
Интеграл графически изображается и может быть вычислен как площадь криволинейной трапеции, образованной кривой и ординатами V1 и V2. Из графика видно, что площадь, ограниченная адиабатой больше, чем площадь под изотермой. Следовательно, работа адиабатического сжатия больше, чем изотермического. Поскольку работу при сжатии газа совершают внешние силы, то сжимать газ выгоднее изотермически.
2. Аналитическое решение задачи позволяет найти численное отношение работ А 1 и А 2 (А 1 – работа изотермического сжатия; А 2 – работа адиабатического сжатия):

Вычислим отношение:
 .
.
Задача 2. Двухатомный газ занимает объем V1 = 0,5 л при давлении  = 0,5 .105 Па. Газ сжимают адиабатически до некоторого давления
= 0,5 .105 Па. Газ сжимают адиабатически до некоторого давления  и объема V2, затем при постоянном объеме V2 охлаждают до первоначальной температуры. При этом давление становится равным
и объема V2, затем при постоянном объеме V2 охлаждают до первоначальной температуры. При этом давление становится равным  = 105 Па. 1) Начертите график этого процесса; 2) найдите объем V2 и давление
= 105 Па. 1) Начертите график этого процесса; 2) найдите объем V2 и давление  .
.

 Дано:
Дано:
 = 0,5 . 105 Па
= 0,5 . 105 Па
 = 105 Па
= 105 Па
 V1 = 0,5 л = 0,5 . 10–3 м3
V1 = 0,5 л = 0,5 . 10–3 м3
V2 -?  -?
-?
Рис. 6.2
Решение
При построении графика нужно учесть: 1) газ сжимается, т. е. V2 < V1 1 - 2 - адиабата; 2) в процессе охлаждения V2 = V3 = const, следовательно, процесс изохорный, давление р уменьшается; 3) так как по условию Т 3 = Т 1, то через точки 1 и 3 можно провести изотерму. При решении используем уравнение изотермы р V = const, или  V1 =
V1 =  V2 (V2 = V3, так как процесс 2 - 3 изохорный).
V2 (V2 = V3, так как процесс 2 - 3 изохорный).
Тогда
 м3.
м3.
Давление  найдем из уравнения адиабаты:
найдем из уравнения адиабаты:
 .
.
Показатель адиабаты  , так как i = 5 (газ двухатомный).
, так как i = 5 (газ двухатомный).
 Па.
Па.
Ответ: V 2 = 0,25 .10–3 м3; Р 2 = 1,32 .105 Па.
Задача 3. В сосуде под поршнем находится гремучий газ, занимающий объем 10–4 м3 при нормальных условиях. При быстром сжатии газ воспламеняется. Найти температуру воспламенения гремучего газа, если работа сжатия равна 47,3 Дж.
Дано: Решение

 V = 10–4 м3
V = 10–4 м3
 = 105 Па
= 105 Па
Т 1 = 273 К
 А = 47,3 Дж
А = 47,3 Дж
Т 2-?
Применив первое начало термодинамики к адиабатическому процессу, получим
Q = 0; D U = - A.
Сжатие совершают внешние силы, работа внешних сил считается отрицательной; внутренняя энергия газа возрастает за счет совершенной внешними силами работы. Температура газа повышается
 ,
,
где D Т = Т 2 – Т 1.
Тогда работа

Согласно уравнению Менделеева – Клапейрона,

откуда

Тогда

 К.
К.
Ответ: Т 2 = 775 К.
Задача 4. Автомобильная шина была накачана до давления  = 2,2 атм при температуре t 1 = 15 0С; во время движения она нагрелась до t 2 = 55 0С и лопнула. На сколько градусов охладился вышедший из шины воздух (процесс считать адиабатическим).
= 2,2 атм при температуре t 1 = 15 0С; во время движения она нагрелась до t 2 = 55 0С и лопнула. На сколько градусов охладился вышедший из шины воздух (процесс считать адиабатическим).
 Дано: Решение
Дано: Решение

 = 2,2 атм
= 2,2 атм
t 1 = 15 0С; Т 1 = 288 К
t 2 = 55 0С; Т 2 = 328 К

 = 1 атм
= 1 атм
D Т 2-?
 . (1)
. (1)
3) для адиабатического процесса
 ;
;
 . (2)
. (2)
Из уравнения (1)

g = 1,4; Т 3 – температура после адиабатического расширения.
Вычислим
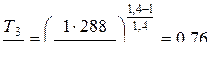 ;
;
Т 3 = 0,76 . Т 2 = 250 К;
D Т 2 = Т 3 – Т 2 = (250 – 328) К = – 78 К.
Ответ: воздух охладился на 78 К.
Задача 5. Чему равна теплоемкость идеального газа в изотермическом и в адиабатическом процессе.
 Дано:
Дано:
 а) T = const
а) T = const
б) Q = 0
 С 1-? С 2-?
С 1-? С 2-?
а) D Т = 0; С 1®¥.
б) Q = 0; С 2 = 0.
Ответ: С 1®¥; С 2 = 0.
Задача 6. На рис. 6.3 показан обратимый переход идеального двухатомного газа из состояния 1 в состояние 2. Процесс состоит из изотермического участка 1 - 3 и адиабатического участка 3 - 2. В начальном состоянии V1 = 10–3 м3,  = 3 .105 Па в конечном состоянии V2 = 2 .10–3 м3,
= 3 .105 Па в конечном состоянии V2 = 2 .10–3 м3,
 = 1,33 . 105 Па. Вычислить работу, совершенную газом в процессе перехода 1 - 3 - 2.
= 1,33 . 105 Па. Вычислить работу, совершенную газом в процессе перехода 1 - 3 - 2.

 Дано:
Дано:
V1 = 10–3 м3
V2 = 2 .10–3 м3
 = 3 . 105 Па
= 3 . 105 Па
 = 1,33 . 105 Па
= 1,33 . 105 Па
 А 1-2 –?
А 1-2 –?
Решение
При переходе 1 - 2 работа складывается из двух работ: А 1-3 – работа перехода из 1 в 3 состояние, и А 3 - 2 – работа перехода из 3 во 2 состояние, т.е.
 ,
,
1 – 3 – изотерма.
 ,
,
причем
 V1 =
V1 =  V3,
V3,
3 – 2 – адиабата.
Так как работа в адиабатном процессе равна изменению внутренней энергии:

 V3 =
V3 =  V1,
V1,
тогда

Полная работа перехода 1 - 2 равна
 . (1)
. (1)
Определим отношение  , решив систему уравнений:
, решив систему уравнений:
 .
.
Разделим второе уравнение на первое:

Домножив и разделив левую часть равенства на  , получим
, получим

Тогда
 (2)
(2)
Полученное выражение (2) подставим в формулу работы (1)

 отсюда
отсюда  g = 1,4 (двухатомный газ).
g = 1,4 (двухатомный газ).
Окончательно

После подстановки
 Дж.
Дж.
Ответ: А 1-2 = 203 Дж.
Задача 8. При адиабатическом сжатии кислорода массой т = 20 г его внутренняя энергия увеличилась на 8360 Дж и температура повысилась до t 2 = 643 0С. Найти: 1) повышение температуры D Т; 2) конечное давление газа  , если начальное давление
, если начальное давление  = 2 атм.
= 2 атм.
Дано: Решение

 т = 20 г = 2 .10–2 кг
т = 20 г = 2 .10–2 кг
m = 32 . 10–3 
i = 5
D U = 8360 Дж




 . (6.12)
. (6.12)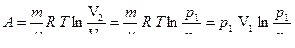 . (6.14)
. (6.14) (6.15)
(6.15) ; (6.16)
; (6.16) 

 (6.16а)
(6.16а) - показатель адиабаты или коэффициент Пуассона.
- показатель адиабаты или коэффициент Пуассона. (6.17)
(6.17) 
 ; (6.17а)
; (6.17а) . (6.17б)
. (6.17б)
 ; (6.18)
; (6.18)
 . (6.19)
. (6.19)
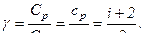 (6.22)
(6.22)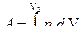 с учетом процесса; б) найти изменение внутренней энергии
с учетом процесса; б) найти изменение внутренней энергии  или
или  ; в) определить количество теплоты, сообщенное газу,
; в) определить количество теплоты, сообщенное газу,  или
или  .
. .
.
 Дано:
Дано: 
 V2 = 10 л = 10-2 м3
V2 = 10 л = 10-2 м3 .
.





 – из уравнения Менделеева – Клапейрона для второго состояния.
– из уравнения Менделеева – Клапейрона для второго состояния.
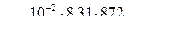 Дж.
Дж. Дж.
Дж. Дж.
Дж. .
. i = 5 3) Применим I начало к изохорному процессу:
i = 5 3) Применим I начало к изохорному процессу: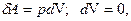 следовательно, d А = 0;
следовательно, d А = 0; ;
; .
.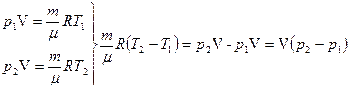 .
.
 m = 28 . 10-3
m = 28 . 10-3  D U -? A -? Q -?
D U -? A -? Q -?
 ;
;
 .
.



 т = 10,5 г = 10,5 . 10-3 кг
т = 10,5 г = 10,5 . 10-3 кг А -?D U -? Q -?
А -?D U -? Q -? 
 т.е.
т.е. 
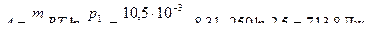
 i = 6
i = 6 
 ;
; .
.
 .
. Дж; 2)
Дж; 2)  Дж.
Дж. кДж.
кДж. кДж.
кДж. ; 2)
; 2)  .
. . Что это за газ?
. Что это за газ? V1 = 10–2 м3
V1 = 10–2 м3 

 .
. .
. Показатель адиабаты
Показатель адиабаты  где i = 5, так как воздух состоит в основном из двухатомных газов; g = 1,4. Отсюда следует, что адиабата круче изотермы; при сжатии давление в адиабатическом процессе изменяется на большую величину, т. е. р 2I > p 2 (рис. 6.1).
где i = 5, так как воздух состоит в основном из двухатомных газов; g = 1,4. Отсюда следует, что адиабата круче изотермы; при сжатии давление в адиабатическом процессе изменяется на большую величину, т. е. р 2I > p 2 (рис. 6.1). Интеграл графически изображается и может быть вычислен как площадь криволинейной трапеции, образованной кривой и ординатами V1 и V2. Из графика видно, что площадь, ограниченная адиабатой больше, чем площадь под изотермой. Следовательно, работа адиабатического сжатия больше, чем изотермического. Поскольку работу при сжатии газа совершают внешние силы, то сжимать газ выгоднее изотермически.
Интеграл графически изображается и может быть вычислен как площадь криволинейной трапеции, образованной кривой и ординатами V1 и V2. Из графика видно, что площадь, ограниченная адиабатой больше, чем площадь под изотермой. Следовательно, работа адиабатического сжатия больше, чем изотермического. Поскольку работу при сжатии газа совершают внешние силы, то сжимать газ выгоднее изотермически.
 .
. = 0,5 .105 Па. Газ сжимают адиабатически до некоторого давления
= 0,5 .105 Па. Газ сжимают адиабатически до некоторого давления  и объема V2, затем при постоянном объеме V2 охлаждают до первоначальной температуры. При этом давление становится равным
и объема V2, затем при постоянном объеме V2 охлаждают до первоначальной температуры. При этом давление становится равным  = 105 Па. 1) Начертите график этого процесса; 2) найдите объем V2 и давление
= 105 Па. 1) Начертите график этого процесса; 2) найдите объем V2 и давление 
 V1 = 0,5 л = 0,5 . 10–3 м3
V1 = 0,5 л = 0,5 . 10–3 м3 м3.
м3. .
. , так как i = 5 (газ двухатомный).
, так как i = 5 (газ двухатомный). Па.
Па.
 А = 47,3 Дж
А = 47,3 Дж ,
,



 К.
К.

 . (1)
. (1) ;
; . (2)
. (2)
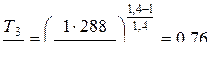 ;
; Дано:
Дано:  С 1-? С 2-?
С 1-? С 2-?
 А 1-2 –?
А 1-2 –? ,
, ,
,

 . (1)
. (1) , решив систему уравнений:
, решив систему уравнений: .
.
 , получим
, получим
 (2)
(2)
 отсюда
отсюда  g = 1,4 (двухатомный газ).
g = 1,4 (двухатомный газ).
 Дж.
Дж.



