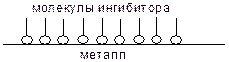Одним из способов защиты металлов от коррозии является изоляция их поверхности от действия деполяризаторов. Среди разновидностей такой защиты широкое распространение получило использование адсорбционных ингибиторов. Адсорбционные ингибиторы – это вещества, которые адсорбируются на поверхности металла, создавая на ней защитный слой молекулярного уровня. Тем самым они препятствуют выходу катионов металла с его поверхности в электролит, а также адсорбции деполяризатора на поверхности катода:
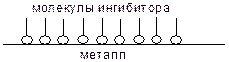
В данном опыте в качестве адсорбционного ингибитора электрохимической коррозии стали в кислой среде используется уротропин (гексаметилентетраамин):

Реактивы и материалы: 0,2 Н раствор H2SO4, две стальные полоски (или стержни), уротропин (или другой подобный ингибитор).
Посуда и принадлежности: две пробирки на 10 см3.
Методика проведения опыта. В две пробирки налейте по ½ объема раствора серной кислоты. В одну пробирку добавьте 1 см3 раствора ингибитора. В каждую пробирку опустите стальную полоску.
Наблюдайте выделение газа. Отметьте, в какой из пробирок газ выделяется более интенсивно, а следовательно, в каком случае (в присутствии ингибитора или без него) скорость коррозии выше.
Объясните причину различия в скорости коррозии, изобразите схему электрохимической коррозии железа и схему адсорбции и действия ингибитора.
Программа экзамена
Структура экзаменационных билетов и перечень теоретических вопросов, включенных в билеты, приводятся для ориентации студентов на темы, которые будут охвачены опросом на экзамене. Материал для подготовки к экзамену дан в разделах 1 и 2 и имеется в рекомендуемой литературе.
Содержание 1-го вопроса экзамена
Тема «Введение в дисциплину. Понятие о процессе коррозии и его сущность»
1. Что означает процесс коррозии, какие виды материалов могут ему подвергаться. Приведите определение процесса коррозии (дайте два определения: общее и с точки зрения химической природы данного процесса).
2. Перечислите основные негативные последствия воздействия коррозионных процессов на металлические материалы и оборудование. Приведите соответствующие количественные статистические данные.
3. Перечислите разновидности прямых и косвенных экономических потерь от коррозии. Приведите соответствующие количественные статистические данные.
4. Охарактеризуйте современное состояние нефтегазовой отрасли с точки зрения результатов воздействия коррозионных процессов на оборудование, трубопроводы и т.п. Приведите соответствующие количественные статистические данные.
Тема «Строение, физико-химические и коррозионные свойства металлов и металлических материалов».
1. Опишите строение металлической решетки (с приведением схемы) и сущность металлической связи. Перечислите особые физические и физико-химические свойства металлов, обусловленные свойствами металлической связи.
2. Укажите, какую роль в ОВР могут играть атомы и катионы металлов и объясните, почему (с приведением примеров). Поясните, какими физико-химическими свойствами металлов обусловливаются окислительно-восстановительные свойства атомов и катионов металлов.
3. Укажите, в реакциях какого типа могут участвовать атомы металлов, какую роль они в них выполняют и почему. В соответствии с этим перечислите все основные типы реагентов, с которыми могут реагировать атомы металлов, приведите примеры соответствующих реакций, лежащих в основе коррозионных разрушений.
4. Укажите, является коррозия самопроизвольным или не самопроизвольным процессом. Поясните свой ответ с позиций термодинамики (с приведением названий и определений DH, DS, DG и их знаков в процессе коррозии).
5. Опишите разновидности аллотропических форм железа. Перечислите металлы, относящиеся к черным и цветным металлам. Объясните, по какому принципу сплавы железа делятся на стали и чугуны.
6. Укажите, какие химические элементы могут входить в состав сплавов железа, и с какой целью их добавляют. Укажите, какие химические вещества образуются в углеродистых сплавах железа, и по какому принципу они делятся на стали и чугуны.
Тема «Классификация коррозионных процессов».
1. Дайте определения процессов химической и электрохимической коррозии и опишите их сущность. Укажите, в каких условиях может протекать каждый из этих процессов и почему (приведите соответствующие примеры).
2. Приведите классификацию коррозионных сред по степени их воздействия на металлы, дайте необходимые пояснения.
3. Приведите классификацию коррозионных процессов по типу агрессивной среды, дайте необходимые пояснения.
4. Опишите особенности подземной (почвенной) коррозии на примере нефтегазодобывающей отрасли.
5. Приведите классификацию коррозионных процессов по условиям их протекания, дайте необходимые пояснения.
6. Приведите классификацию коррозионных процессов по характеру агрессивной среды, дайте необходимые пояснения.
7. Приведите классификацию коррозионных процессов по типу разрушений, дайте необходимые пояснения.
8. Опишите разновидности общей коррозии, дайте необходимые пояснения с приведением соответствующих изображений.
9. Опишите разновидности местной коррозии, дайте необходимые пояснения с приведением соответствующих изображений.
10. Приведите и опишите разновидности коррозии в условиях механического воздействия.
Тема «Закономерности коррозионных процессов. Факторы, влияющие на процесс коррозии».
1. Перечислите и опишите внутренние факторы, влияющие на процессы коррозии.
2. Перечислите и подробно опишите химические типы (классы) и свойства защитных пленок, возникающих на поверхности металлов. Опишите особенности и закономерности их влияния на процесс коррозии.
3. Перечислите и опишите внешние факторы, влияющие на процессы коррозии.
Тема «Химическая коррозия».
1. Дайте определения процессов химической и электрохимической коррозии. Укажите, в каких условиях может протекать каждый из этих процессов и объясните, почему.
2. Опишите общие особенности процесса химической коррозии. Укажите, реакции какого типа лежат в основе данного процесса. Укажите, на какие две разновидности делится химическая коррозия по типу агрессивной среды и дайте их краткое описание.
3. Дайте описание газовой коррозии, укажите, в каких средах она протекает (с приведением примеров). Перечислите газообразные вещества, которые наиболее часто выступают окислителями в процессах газовой коррозии, напишите уравнения соответствующих реакций. Назовите продукты, которые при этом образуются.
4. Опишите возможные защитные свойства оксидных пленок, образующихся при химической коррозии металлов под действием кислорода. Укажите, от каких факторов и условий зависят их защитные свойства.
5. Опишите особенности влияния примеси ванадия на химическую коррозию углеродистых сталей, приведите уравнения соответствующих реакций.
6. Дайте описание коррозии в жидких неэлектролитах, укажите в каких средах она протекает (с приведением примеров, в т.ч. из нефтегазовой отрасли). Дайте определение электролитов и неэлектролитов, перечислите известные Вам промышленные жидкие неэлектролиты.
7. Опишите сущность и особенности кислородной и углекислотной коррозии нефтяного оборудования и трубопроводов. Опишите особенности влияния различных компонентов сырой нефти (углеводородов, воды, продуктов осмоления) на процесс коррозии металлов в жидких неэлектролитах.
8. Опишите сущность процесса сероводородной коррозии и виды негативного действия сероводорода и его органических производных в нефтегазовой отрасли.
Тема «Электрохимическая коррозия».
1. Опишите сущность процесса ЭХК, в каких средах и почему именно в них она может протекать (с приведением примеров). Укажите, какие структурные элементы образуюшихся микрогальванических элементов могут выполнять роль анода и катода и почему (приведите примеры).
2. Опишите основные принципы действия микрогальванических элементов, возникающих в процессах ЭХК.
3. Укажите условия, необходимые для возникновения микрогальванических элементов в процессах ЭХК, назовите факторы, влияющие на скорость ЭХК.
Содержание 2-го вопроса экзамена
Для заданной электрохимической микрогальванической системы (возможные варианты: а) условия неодинаковой аэрации; б) изделие из металла содержит определенную примесь (другого металла, углерода, карбида металла и т.п.) и контактирует с влажным воздухом или раствором заданного электролита; в) металл покрыт поврежденным слоем другого металла и контактирует с раствором электролита. Во всех заданиях дается уровень рН среды, содержащей электролит):
а) приведите полную схему проходящей в данной системе электрохимической коррозии с указанием анода, катода, двойных электрических слоев, деполяризатора, областей подхода деполяризатора и удаления продуктов его восстановления;
б) напишите уравнения первичных и вторичных реакций, назовите реагенты и процессы (окислитель, восстановитель; окисление, восстановление);
в) определите, какой компонент данной системы будет разрушаться в ходе коррозии и почему;
г) для металла, являющегося основным в Вашей системе:
– приведите уравнение реакции его возможной химической коррозии в заданных условиях (в зависимости от состава данной агрессивной среды в качестве окислителя может выступать кислород, раствор кислоты, раствор щелочи, раствор соли);
– объясните, каким образом продукт приведенной Вами реакции химической коррозии может влиять на скорость электрохимической коррозии в заданной системе.
Содержание 3-го вопроса экзамена
1. Приведите общую классификацию методов защиты металлов от коррозии. Уметь описать сущность любого из этих методов по заданию преподавателя при устном опросе.
2. Опишите сущность легирования металлов как способа защиты от коррозии. Укажите, как изменяется коррозионная стойкость железа в результате его легирования различными металлами.
3. Приведите классификацию, опишите сущность и назначение покрытий, используемых для защиты металлов от коррозии.
4. Опишите сущность, принцип действия и условия применения анодного и катодного покрытий для защиты металлов от ЭХК (с приведением схем ЭХК, проходящей при повреждении этих покрытий в средах с различным уровнем рН).
5. Перечислите основные требования к изоляционным покрытиям, применяемые на трубопроводах. Приведите типы (классы) полимерных материалов, используемых для изоляционного покрытия подземных трубопроводов, и объясните, почему именно они используются.
6. Перечислите основные способы электрохимической защиты металлов от коррозии и опишите сущность каждого из них.
7. Опишите сущность и принцип действия протекторной зашиты, укажите ее преимущества и недостатки. Приведите и поясните схему установки для протекторной защиты трубопроводов.
8. Опишите сущность и принцип действия анодной и катодной электрозащиты, укажите ее преимущества и недостатки. Приведите и поясните принципиальную схему катодной защиты трубопроводов.
9. Опишите сущность способов защиты металлов путем удаления из окружающей среды или снижения концентрации веществ, способствующих коррозии. Опишите сущность и назначение электродренажной защиты.
10. Опишите сущность и принципы защиты металлов от коррозии путем добавления ингибиторов в агрессивную среду. Дайте определение ингибитора. Приведите способы классификации ингибиторов и их описание.
Библиографический список
1. Семенова И. В., Флорианович Г. М., Хорошилов А. В. Коррозия и защита от коррозии: учеб. пособие. – М.: Физматлит, 2010 и др. годы изд. – 414 с. http://www.mirknig.com/knigi/estesstv_nauki/1181198627-korroziya-i-zashhita-ot-korrozii.html
2. Неверов А.С., Родченко Д.А., Цырлин М.И. Коррозия и защита материалов: учеб. пособие. – М.: Форум, 2014. – 224 с.
3. Кац Н.Г., Стариков В.П., Парфенова С.Н. Химическое сопротивление материалов и защита оборудования нефтегазопереработки от коррозии: учеб. пособие для студентов спец. «Машины и оборудование». – М.: Машиностроение, 2011. – С. 435. http://depositfiles.com
4. Мальцева Г.Н. Коррозия и защита оборудования от коррозии: учеб. пособие. – Пенза: Изд. Пенз. гос. ун-т, 2007 и др. годы изд. – 175 с.
5. Будкевич Р.Л. Защита оборудования от коррозии: учеб. пособие по дисциплине «Защита оборудования от коррозии». – Альметьевск: АГНИ, 2007 и др. годы изд. – 56 с.
6. Защита трубопроводов от коррозии. Том 1: учеб. пособие для студентов и магистров по направлению. «Нефтегазовое дело» / Ф.М. Мустафин и др. – С. -Пб.: Недра, 2005. – 617 с.
7. Защита трубопроводов от коррозии. Том 2: учеб. пособие для студентов и магистров по направлению. «Нефтегазовое дело» / Ф.М. Мустафин и др. – С. -Пб.: Недра, 2007. – 702 с.
8. Коровин Н.В. Общая химия. – М.: Высшая школа, 2013 и др. годы изд. – 558 с. (гл. 9 и 10).
9. Глинка Н.Л. Общая химия. – М.: Интеграл-пресс, 2013 и др. годы изд. – 727 с. (гл. 11, раздел 11,3; гл. 32, гл. 38, раздел 38.5).
Приложение А
Справочные материалы к тестовым заданиям
Таблица А.1 – Сплошность оксидных пленок на окисленных металлах и их защитное действие.
| Металл
| Оксид
| Сп
| Характеристика защитного действия пленки
|
| Калий
| K2O
| 0,45
| Металлы быстро окисляющиеся, с пористой оксидной пленкой, не защищающей от дальнейшего окисления.
|
| Натрий
| Na2O
| 0,55
|
| Кальций
| CaO
| 0,64
|
| Барий
| BaO
| 0,67
|
| Магний
| MgO
| 0,81
|
| Алюминий
| Al2O3
| 1,21
| Металлы, устойчивые к дальнейшему окислению, со сплошной оксидной пленкой.
|
| Титан
| TiO2
| 1,35
|
| Цинк
| ZnO
| 1,50
|
| Никель
| NiO
| 1,64
|
| Медь
| CuO
| 1,65
|
| Хром
| Cr2O3
| 2,07
|
| Железо
| Fe2O3
| 2,14
| Металлы с пониженной устойчивостью к дальнейшему окислению, т.к. из-за большого объема пленки в реальных условиях эксплуатации могут возникнуть растягивающие напряжения, нарушающие ее сплошность.
|
| Fe3O4
| 2,09
|
| Вольфрам
| WO3
| 3,35
|
Примечания:
а) экспериментально установлено, что лучшими защитными свойствами обладают оксидные пленки, имеющие значение Сп в пределах 1 < Vокс/Vмет < 2,5;
б) данные таблицы А.1 могут быть использованы для определения устойчивости металлов к коррозии с учетом сплошности образовавшейся на их поверхности оксидной пленки.
Таблица А.2 – Ряд стандартных электродных потенциалов металлов (электрохимический ряд напряжений)
для процессов М 0 – nе = Мn+
|
| Ряд
активности
(активные
металлы)
|
Li0/
Li+
|
Rb0/
Rb+
|
K0/
K+
|
Ba0/
Ba2+
|
Sr0/
Sr2+
|
Ca0/
Ca2+
|
Na0/
Na+
|
Mg0/
Mg2+
|
Be0/
Be2+
|
Al0/
Al3+
|
Ti0/
Ti2+
|
Zr0/
Zr4+
|
Mn0/
Mn2+
|
Cr0/
Cr2+
| Zn0/
Zn2+
(при комн.
t0)
|
Cr0/
Cr3+
|
| Значения
потенциалов,
В
|
-3,05
|
-2,93
|
-2,93
|
-2,91
|
-2,89
|
-2,87
|
-2,71
|
-2,36
|
-1,85
|
-1,66
|
-1,63
|
-1,54
|
-1,18
|
-0,91
|
-0,76
|
-0,74
|
| 86
| Ряд
активности
(металлы средней активности)
|
Fe0/
Fe2+
|
Cd0 /
Cd2+
|
In0/
In3+
|
Co0/
Co2+
|
Ni0/
Ni2+
|
Mo0/
Mo2+
|
Sn0/
Sn2+
|
Pb0 /
Pb2+
|
Fe0 /
Fe3+
|
H20 /
2H+
|
| Значения
потенциалов,
В
|
-0,44
|
-0,40
|
-0,34
|
-0,28
|
-0,25
|
-0,20
|
-0,14
|
-0,13
|
-0,04
|
0,00
|
|
| Ряд
активности
(неактивные
металлы)
|
W0/
W3+
|
Sb0/
Sb3+
|
Bi0/
Bi3+
|
Co0/
Co3+
|
Cu0/
Cu2+
|
Tc0/
Tc2+
|
Tl0/
Tl3+
|
Hg0/
Hg2+
|
Ag0/
Ag+
|
Pd0/
Pd2+
|
Ir0/
Ir3+
|
Рt0/
Pt2+
|
Au0/
Au3+
|
Аu0/
Au+
|
| Значения
потенциалов,
В
|
+0,11
|
+0,20
|
+0,22
|
+0,33
|
+0,34
|
+0,40
|
+0,71
|
+0,79
|
+0,80
|
+0,99
|
+1,15
|
+1,19
|
+1,50
|
+1,70
|
Таблица А.3 – Растворимость кислот, оснований и солей в воде
| 87
|
| H+
| Li+
| K+, Na+
| NH4+
| Sr2+
| Ba2+
| Ca2+
| Mg2+
| Al3+
| Cr3+
| Fe2+
| Fe3+
| Ni2+
| Co2+
| Mn2+
| Zn2+
| Ag+
| Hg2+
| Pb2+
| Be2+
| Cd2+
| Sn2+
| Cu2+
|
| OH-
|
| Р
| Р
| Р
| Р
| Р
| Ма
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| –
| –
| H
| H
| H
| H
| H
|
| F-
| Р
| Н
| Р
| Р
| Н
| М
| Н
| М
| М
| М
| М
| Н
| Р
| Р
| Р
| М
| Р
| –
| М
| Р
| Р
| Р
| Р
|
| Cl-
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Н
| Р
| М
| Р
| Р
| Р
| Р
|
| Br-
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Н
| М
| М
| Р
| Р
| Р
| Р
|
| I-
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| –
| Р
| Р
| Р
| Р
| Н
| Н
| Н
| Р
| Р
| М
| –
|
| S2-
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| –
| –
| Н
| –
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| –
| Н
| Н
| Н
|
| SO32-
| Р
| Р
| Р
| Р
| Н
| Н
| Н
| Н
| –
| –
| Н
| –
| Н
| Н
| Н
| Н
| Н
| –
| Н
| Н
| Р
| –
| –
|
| SO42-
| Р
| Р
| Р
| Р
| Н
| Н
| М
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| М
| Р
| Н
| Р
| Р
| Р
| Р
|
| CrO42-
| Р
| Р
| Р
| Р
| М
| Н
| М
| Р
| –
| –
| –
| –
| –
| –
| Н
| Н
| Н
| Н
| Н
| (?)
| (?)
| –
| Н
|
| PO43-
| Р
| Н
| Р
| Р
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
|
| CO32-
| Р
| Р
| Р
| Р
| Н
| Н
| Н
| Н
| –
| –
| Н
| –
| –
| –
| Н
| –
| Н
| –
| –
| –
| –
| –
| –
|
| SiO32-
| Н
| Р
| Р
| Н
| Н
| Н
| Н
| Н
| Н
| –
| Н
| Н
| –
| –
| Н
| Н
| –
| –
| Н
| (?)
| (?)
| –
| Н
|
| NO3-
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| –
| Р
|
| CH3COO-
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| М
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| +
| Р
| Р
| Р
|
а Ca(OH)2 – сильный электролит
Таблица А.4 – Характеристика катодных процессов
| Окислитель
| Электрохимический процесс на катоде
| рН среды
|
| Уравнение катодного процесса
(реакция восстановления)
| Электродный потенциал (Екатода), В
|
| Вода
| 2Н2О + 2е = 2ОН- + Н2
| Е02Н+/Н2 = -0,413
| ~7
|
| Кислота (протон)
| 2Н+ + 2е = Н2
| Е02Н+/Н2 = 0
| 0
|
| Кислород и вода
| О2 + 2Н2О + 4е = 4ОН-
| Е0О2 + 2Н2О/4ОН- = +0,816
| ~7
|
| Кислород и кислота (протон)
| О2 + 4Н+ + 4е = 2Н2О
| Е0О2 + 4Н+/2Н2О = +1,229
| 0
|
Таблица А.5 – Классификация электролитов по степени их диссоциации
| Вещество
| Сильные электролиты
α >30%
| Слабые электролиты
α <30%
|
| Основания
| KOH, NaOH, Ca(OH)2, Ba(OH)2, TlOH и др.
| NH4OH, все нерастворимые основания и амфотерные гидроксиды
|
| Кислоты
| HСl, HBr, HI, HNO3, H2SO4, H2MnO4, HСlO3, HClO4, H2Cr2O7 и др.
| HF, H2CO3, H2SO3, HNO2, H3PO4, HCN, H2S, H2SiO3, большинство органических кислот (CH3COOH и др.)
|
| Соли
| растворимые соли: все средние и кислые; гидроксонитраты (основные соли, содержащие группу NO3)
| все малорастворимые и нерастворимые соли – основные (кроме гидроксонитратов) и средние
|
Приложение Б
Таблица вариантов контрольных заданий
Таблица Б.1 – Номера контрольных заданий по темам, указанным в разделе 2
| Номера
контрольных заданий (работ)
| Тема 1
| Тема 2
| Тема 3
| Тема 4
|
| 1
| 30
| 31
| 61
| 91
|
| 2
| 29
| 32
| 62
| 92
|
| 3
| 28
| 33
| 63
| 93
|
| 4
| 27
| 34
| 64
| 94
|
| 5
| 26
| 35
| 65
| 95
|
| 6
| 25
| 36
| 66
| 96
|
| 7
| 24
| 37
| 67
| 97
|
| 8
| 23
| 38
| 68
| 98
|
| 9
| 22
| 39
| 69
| 99
|
| 10
| 21
| 40
| 70
| 100
|
| 11
| 20
| 41
| 71
| 101
|
| 12
| 19
| 42
| 72
| 102
|
| 13
| 18
| 43
| 73
| 103
|
| 14
| 17
| 44
| 74
| 104
|
| 15
| 16
| 45
| 75
| 105
|
| 16
| 15
| 46
| 76
| 106
|
| 17
| 14
| 47
| 77
| 107
|
| 18
| 13
| 48
| 78
| 108
|
| 19
| 12
| 49
| 79
| 109
|
| 20
| 11
| 50
| 80
| 110
|
| 21
| 10
| 51
| 81
| 111
|
| 22
| 9
| 52
| 82
| 112
|
| 23
| 8
| 53
| 83
| 113
|
| 24
| 7
| 54
| 84
| 114
|
| 25
| 6
| 55
| 85
| 115
|
| 26
| 5
| 56
| 86
| 116
|
| 27
| 4
| 57
| 87
| 117
|
| 28
| 3
| 58
| 88
| 118
|
| 29
| 2
| 59
| 89
| 119
|
| 30
| 1
| 60
| 90
| 120
|
| 31
| 15
| 45
| 71
| 104
|
Продолжение таблицы Б.1
| Номера вариантов
контрольных заданий (работ)
| Тема 1
| Тема 2
| Тема 3
| Тема 4
|
| 32
| 16
| 46
| 72
| 105
|
| 33
| 17
| 47
| 73
| 106
|
| 34
| 18
| 48
| 74
| 107
|
| 35
| 19
| 49
| 75
| 108
|
| 36
| 20
| 50
| 76
| 109
|
| 37
| 21
| 51
| 77
| 110
|
| 38
| 22
| 52
| 78
| 111
|
| 39
| 23
| 53
| 79
| 112
|
| 40
| 24
| 54
| 80
| 113
|
| 41
| 25
| 55
| 81
| 114
|
| 42
| 26
| 56
| 82
| 115
|
| 43
| 27
| 57
| 83
| 116
|
| 44
| 28
| 58
| 84
| 117
|
| 45
| 29
| 59
| 85
| 118
|
| 46
| 30
| 60
| 86
| 119
|
| 47
| 1
| 31
| 87
| 120
|
| 48
| 2
| 32
| 88
| 91
|
| 49
| 3
| 33
| 89
| 92
|
| 50
| 4
| 34
| 90
| 93
|
| 51
| 5
| 35
| 61
| 94
|
| 52
| 6
| 36
| 62
| 95
|
| 53
| 7
| 37
| 63
| 96
|
| 54
| 8
| 38
| 64
| 97
|
| 55
| 9
| 39
| 65
| 98
|
| 56
| 10
| 40
| 66
| 99
|
| 57
| 11
| 41
| 67
| 100
|
| 58
| 12
| 42
| 68
| 101
|
| 59
| 13
| 43
| 69
| 102
|
| 60
| 14
| 44
| 90
| 103
|
| 61
| 10
| 31
| 61
| 91
|
| 62
| 11
| 32
| 62
| 92
|
| 63
| 12
| 33
| 63
| 93
|
| 64
| 13
| 34
| 64
| 94
|
| 65
| 14
| 35
| 65
| 95
|
| 66
| 15
| 60
| 66
| 96
|
Окончание таблицы Б.1
| Номера вариантов
контрольных заданий (работ)
| Тема 1
| Тема 2
| Тема 3
| Тема 4
|
| 67
| 16
| 59
| 67
| 97
|
| 68
| 17
| 58
| 68
| 98
|
| 69
| 18
| 57
| 69
| 99
|
| 70
| 19
| 56
| 70
| 100
|
| 71
| 20
| 37
| 90
| 120
|
| 72
| 6
| 38
| 89
| 119
|
| 73
| 7
| 39
| 88
| 118
|
| 74
| 8
| 40
| 87
| 117
|
| 75
| 9
| 55
| 86
| 116
|
| 76
| 21
| 54
| 85
| 115
|
| 77
| 22
| 53
| 84
| 114
|
| 78
| 23
| 52
| 83
| 113
|
| 79
| 24
| 51
| 82
| 112
|
| 80
| 25
| 41
| 81
| 111
|
| 81
| 26
| 42
| 71
| 101
|
| 82
| 27
| 43
| 72
| 102
|
| 83
| 28
| 44
| 73
| 103
|
| 84
| 29
| 45
| 74
| 104
|
| 85
| 30
| 46
| 75
| 105
|
| 86
| 1
| 47
| 76
| 106
|
| 87
| 2
| 48
| 77
| 107
|
| 88
| 3
| 49
| 78
| 108
|
| 89
| 4
| 50
| 79
| 109
|
| 90
| 5
| 60
| 80
| 110
|
| 91
| 30
| 58
| 90
| 120
|
| 92
| 28
| 56
| 88
| 118
|
| 93
| 26
| 54
| 86
| 116
|
| 94
| 24
| 52
| 84
| 114
|
| 95
| 22
| 50
| 82
| 112
|
| 96
| 20
| 48
| 80
| 110
|
| 97
| 18
| 46
| 78
| 108
|
| 98
| 16
| 44
| 76
| 106
|
| 99
| 14
| 42
| 74
| 104
|
| 100
| 12
| 40
| 72
| 102
|
Бадовская Лариса Авксентьевна
Посконин Владимир Владимирович
КОРРОЗИЯ И ЗАЩИТА ОТ КОРРОЗИИ
Учебное пособие
План издания 2016 г.
Редактор Т.П. Горшкова
Компьютерная верстка В.В. Посконин
________________________________________________________________
Подписано в печать 2016 г. Формат 60х84/16
Бумага офсетная Офсетная печать
Печ. л. 6,0 Изд. № 35
Усл. печ. л. 5,6 Тираж 150 экз.
Уч.-изд. л. 4,1 Заказ №
Цена руб.
ФГБОУ ВПО «Кубанский государственный технологический университет»
350072, г. Краснодар, ул. Московская, 2, кор. А
Типография ФГБОУ ВПО «КубГТУ»: 350058, г. Краснодар,
ул. Старокубанская, 88/4