ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КАЗАНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ИММУНОСУПРЕССИЯ
ПРИ
ТРАНСПЛАНТАЦИИ ПОЧКИ
Учебное пособие для врачей
Казань 2009 г.
ББК 54.547
УДК 616.089.819.843
Учебное пособие подготовлено ассистентом кафедры урологии и нефрологии ГОУ ДПО «КГМА Росздрава», главным внештатным специалистом трансплантологом Министерства Здравоохранения Республики Татарстан, членом экспертного совета в сфере здравоохранения Министерства здравоохранения и социального развития Российской Федерации по «Трансплантологии» Галеевым Ш.Р.
В пособии приведены основные данные по современным иммуносупрессивным препаратам и их основным побочным действиям. В пособии обсуждены избранные вопросы с многокомпонентных схем иммуносупрессивной терапии у пациентов после трансплантации почки.
Пособие предназначено для врачей нефрологов, реаниматологов, терапевтов, хирургов и урологов, занимающихся лечением пациентов на разных сроках после трансплантации почки.
Рецензенты:
Цибулькин Анатолий Павлович, зав. кафедрой клинической лабораторной диагностики, д.м.н., профессор
Андрей Иванович Гурьянов Главный внештатный уролог г. Казани, зав. отделением урологии МУЗ «БСМП №2»
Учебное пособие утверждено и рекомендовано к изданию Методическим советом ГОУ ДПО КГМА от «__» _______ 200_ г. (протокол №______).
С учебным пособием можно ознакомиться в библиотеке ГОУ ДПО КГМА по адресу: 420012, г. Казань, ул. Муштари, д.11
СОДЕРЖАНИЕ
| Введение………………………………………………………….…………
| 4
|
| Глюкокортикоиды (преднизолон, метилпреднизолон)..………………
| 5
|
| Циклоспорин А (Сандиммун Неорал)……………………………………
| 7
|
| Такролимус (програф),……………………………………………………..
| 11
|
| Микофенолата мофетил (Селлсепт)………………………………………
| 16
|
| Микофеноловая кислота (Майфортик)……………………………………
| 19
|
| Сиролимус (Рапамун)………………………………………………………
| 20
|
| Эверолимус (Сертикан)…………………………………………………….
| 22
|
| Азатиоприн (Имуран)………………………………………………………
| 23
|
| Циклофосфамид…………………………………………………………….
| 24
|
| Поликлональные антитела (Атгам, АТГ фрезениус, Тимоглобилин)…..
| 26
|
| Моноклональные антитела (ОКТ-3)……………………………………
| 29
|
| Даклизумаб и базиликсимаб (Знапакс, Симулект)……………………….
| 31
|
| Список литературы…………………………………………………………
| 35
|
ВВЕДЕНИЕ
Увеличение выживаемости трансплантата и пациентов связано с внедрением в клиническую практику ингибитора кальциневрина — циклоспорина, что значительно увеличило как краткосрочную, так и долговременную выживаемость трансплантата. В последние годы арсенал иммуносупрессивных средств расширяется за счёт новых ингибиторов кальциневрина (такролимус), ингибиторов биосинтеза пуринов (микофеноловая кислота, микофенолата мофетил), поли- и моноклональных антител и ингибиторов пролиферативного сигнала (эверолимус). Клиническими наблюдениями подтверждено, что комбинированное назначение перечисленных препаратов уменьшает частоту острого отторжения и увеличивает дальнейшую выживаемость трансплантата. Оптимальные режимы обеспечивают приемлемый баланс между необходимым уровнем иммуносупрессии и нежелательными побочными эффектами (высокий риск развития инфекционных осложнений, сердечно-сосудистых заболеваний, малигнизация и нефротоксическое действие).
В настоящее время стандартный протокол иммуносупрессии в клинической практике включает неспецифические препараты нескольких типов:
1. глюкокортикоиды;
2. ингибиторы кальциневрина (циклоспорин, такролимус);
3. цитостатики — ингибиторы биосинтеза пуринов (микофенолата мофетил, микофеноловая кислота); ранее применяли антиметаболиты (азатиоприн), алкилирующие препараты (циклофосфамид);
4. ингибиторы пролиферативного сигнала (сиролимус, эверолимус).
5. биологические иммуносупрессивные препараты: поликлональные антитела (атгам, тимоглобулин, АТГ фрезениус);
6. гуманизированные моноклональные антитела — антагонисты рецепторов интерлейкина 2 (даклизумаб, базиликсимаб);
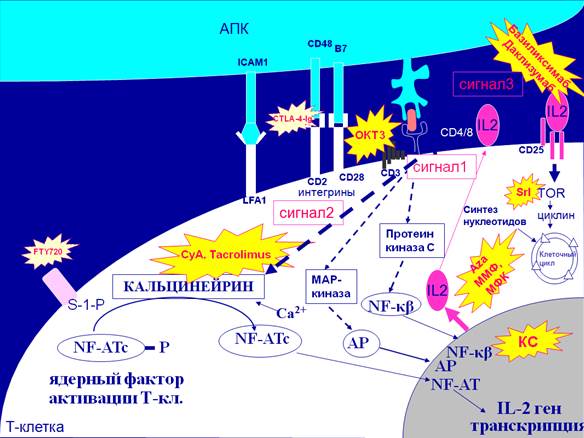
|
| Рисунок №1 Иммуносупрессивные препараты и точки их приложения.
CsA – циклоспорин А, Tacrolimus – такролимус, Aza – азатиоприн, ММФ – мофетила микофенолат, МФК – микофеноловая кислота
|
Несмотря на побочные эффекты, циклоспорин, на сегодняшний день, остаётся основой иммуносупрессии.
ТАКРОЛИМУС (ПРОГРАФ)
Поиск эффективных и хорошо переносимых средств иммуносупрессии после трансплантации органов в 1984 года ознаменовался успехом. В Японии из культуры почвенного микроорганизма Streptomyces tsukubaensis было выделено вещество, получившее название «такролимус» и кодовое обозначение FK-506. В экспериментах in vitro по ингибированию пролиферативного ответа Т-клеток, включая реактивность в смешанной культуре лимфоцитов и образование цитотоксических Т-клеток, эффективность такролимуса была в 100 раз выше, чем у циклоспорина. У крыс, собак и бабуинов такролимус предупреждал отторжение аллотрансплантата в концентрациях, в 10–100 раз более низких, чем концентрации циклоспорина.
Подобно циклоспорину действие такролимуса заключается в ингибировании кальциневрина. Для реализации эффекта, как уже было описано выше, необходимо связывание ингибиторов кальциневрина с особыми внутриклеточными белками иммунофилинами, которые различны для циклоспорина и такролимуса. Циклоспорин связывается с циклофиллином, а такролимус — с иммунофилином, получившим название FKВР12. Только в комплексе с указанными цитозольными белками такролимус и циклоспорин способны к ингибированию кальциневрина. По-видимому, клинические особенности такролимуса и циклоспорина связаны со способностью белков циклофиллина и FKBP12 действовать на различные внутриклеточные мишени. Специфическое конкурентное ингибирование кальциневрина комплексом FKBP12–такролимус приводит к зависимому от ионов кальция ингибированию Т-клеточных сигнальных путей трансдукции, предотвращая транскрипцию дискретной группы лимфокинных генов.
Такролимус — высокоактивный иммуносупрессивный препарат, он подавляет формирование цитотоксических лимфоцитов, играющих важную роль в отторжении трансплантата, снижает активацию Т-клеток, зависимую от Т-хелперов пролиферацию В-клеток, продукцию лимфокинов (ИЛ-2, ИЛ-3, γ-интерферон) и экспрессию рецептора ИЛ-2.
Основное место абсорбции такролимуса верхний отдел ЖКТ. Максимальная концентрации в крови достигается через 1-3 ч. После приёма внутрь (0,3 мг/кг в сут) пациентами после трансплантации почки равновесная концентрация препарата в крови достигается в течение 3 дней. При одновременном приёме препарата с пищей снижаются скорость и степень его абсорбции. Выделение желчи не влияет на абсорбцию такролимуса. Наблюдается корреляция между площадью под кривой концентрации и минимальными уровнями препарата в цельной крови при достижении равновесного состояния, поэтому мониторинг минимальных уровней препарата в цельной крови применяют для адекватной оценки системного воздействия препарата.
Такролимус в значительной степени метаболизируется печёночным микросомальным цитохромом Р450 3А4 изоэнзимом (CYP3A4). Именно поэтому вещества, которые влияют на функцию цитохрома, могут изменять концентрацию такролимуса в крови (табл. 1).
Таблица №1. Совместное действие некоторых препаратов и такролимуса
| Действие
| Препараты
|
| Препараты, повышающие концентрацию такролимуса в крови
| Антагонисты кальция, противогрибковые средства, производные кетоконазола, макролидные антибиотики, прокинетики, метоклопрамид, хлорамфеникол, циклоспорин, даназол, этинилэстрадиол, метилпреднизолон, омепразол, ингибиторы протеаз, препараты гидроксидов магния и алюминия
|
| Препараты, снижающие концентрацию такролимуса в крови
| Противосудорожные препараты (карбамазепин, фенобарбитал, фенитоин), противотуберкулёзные препараты (рифабутин, каспофунгин), другие препараты (сиролимус)
|
| Препараты, усиливающие нефротоксичность такролимуса
| Аминогликозиды, сульфаниламиды, противогрибковые препараты, амфотерицин В, иммуносупрессанты, циклоспорин
|
Лекарственные формы и дозировки. Существуют формы как для приёма внутрь, так и внутривенного введения: капсулы по 0,5 мг, 1 мг, 5 мг и концентрат для приготовления раствора для инфузии по 5 мг/мл. Дозу такролимуса необходимо корректировать в соответствии с результатами мониторинга уровня препарата в крови больного. Суточную дозу препарата для приёма внутрь рекомендуется разделить на 2 части (например, утром и вечером). Для достижения максимальной абсорбции капсулы следует принимать натощак или, как минимум, за 1 ч до приёма пищи или через 2–3 ч после него. Концентрат для внутривенной инфузии следует использовать только после разведения соответствующим растворителем. При трансплантации почки детям для достижения терапевтических концентраций в пересчёте на единицу массы тела обычно требуются большие дозы. После трансплантации почки препарат рекомендуется назначать, начиная с 0,2–0,3 мг/кг в сутки; а детям — по 0,3 мг/кг в сутки.
После трансплантации почки дозы препарата для внутривенного введения составляют: у взрослых 0,05–0,10 мг/кг в сутки, у детей 0,075–0,100 мг/кг в сутки.
В ряде случаев требуется перевод больных с лечения циклоспорином на такролимус. При одновременном применении препаратов увеличивается период полувыведения циклоспорина и усиливаются его токсические эффекты. Лечение такролимусом следует начинать после оценки концентраций циклоспорина в крови и клинического состояния пациента. Применение препарата следует отложить при наличии повышенного уровня циклоспорина в крови больного. На практике обычно препарат назначают через 12–24 ч после отмены циклоспорина.
В раннем послеоперационном периоде важно контролировать минимальные уровни такролимуса в цельной крови. При приёме препарата внутрь для определения минимальных уровней такролимуса в крови необходимо получить образцы крови через 12 ч после его приёма, непосредственно до применения следующей дозы. Частота определения уровня препарата в крови должна зависеть от показаний. Минимальные уровни препарата в крови следует контролировать примерно 2 раза в неделю во время раннего посттрансплантационного периода и затем периодически в ходе поддерживающей терапии. В период подбора дозировки и достижения целевых концентраций такролимуса в сыворотки крови может потребоваться более частое определение концентрации препарата в крови. Минимальные уровни такролимуса в крови также необходимо контролировать после изменения его дозы, режима иммуносупрессии или после одновременного применения с препаратами, влияющими на концентрацию такролимуса в цельной крови. Результаты клинических исследований свидетельствуют о том, что лечение такролимусом наиболее эффективно в тех случаях, когда его минимальные концентрации в цельной крови не превышают 20 нг/мл. В клинической практике в ранний посттрансплантационный период минимальные уровни препарата в цельной крови обычно варьируют в пределах 10–20 нг/мл. Следовательно, в ходе поддерживающей терапии после трансплантации почки концентрации препарата в крови должны составлять от 5 до 15 нг/мл (таблица №2)
| Таблица №2.Рекомендуемые уровни такролимуса в сыворотке крови после трансплантации почки
|

|
Побочное действие препарата в раннем посттрансплантационном периоде, когда многие пациенты подвержены высоким уровням стресса, развитию инфекции и острого отторжения, а также вынуждены принимать многочисленные лекарственные препараты, отмечаются нарушения метаболизма глюкозы. Результаты исследований у пациентов после пересадки почки свидетельствуют о том, что нарушения метаболизма глюкозы часто обратимы, их выраженность уменьшается при снижении доз иммуносупрессантов, уменьшении уровней такролимуса в цельной крови и снижении доз или прекращения приёма кортикостероидов.
СИРОЛИМУС (РАПАМУН)
Сиролимус — макролидный антибиотик, впервые представленный в 1999 г. Предложен как мощный иммунодепрессант, механизм действия которого отличается от механизма действия циклоспорина и такролимуса, несмотря на то, что по своей структуре он гомологичен такролимусу. При назначении сиролимуса в комбинации с преднизолоном и циклоспорином значительно снижается количество эпизодов острого отторжения в раннем послеоперационном периоде по сравнению с применением азатиоприна.
Механизм действия сиролимуса отличен от циклоспорина и такролимуса. Сиролимус уменьшает активацию Т-клеток на поздней стадии клеточного цикла с фазы G1 по S, ингибируя пути трансдукции сигнала, индуцированного цитокином, что в результате приводит к подавлению зависимой от ИЛ-2 и ИЛ-4 пролиферации Т-клеток. Поскольку сиролимус занимает тот же связывающий белок, что и такролимус, первоначально было высказано предположение, что он будет уменьшать действие такролимуса и дополнять действие циклоспорина. Кроме того, сиролимус эффективен для предупреждения пролиферации гладкомышечных клеток сосудов и эндотелиальных клеток при заболевании сосудов аллотрансплантата. Препарат выпускается в виде раствора для приёма внутрь (концентрация 1 мг/мл). Препарат хорошо всасывается в ЖКТ, достигая терапевтической концентрации в течение 1–2 ч. Сиролимус назначают впервые 48 часа после трансплантации в виде нагрузочной дозы 6 мг с последующим переходом на поддерживающую дозу 2 мг/сут в один приём через 4 ч после утреннего приёма циклоспорина. В дальнейшем дозу сиролимуса подбирают таким образом, чтобы терапевтическая концентрация препарата в цельной крови была не ниже 5 нг/мл (контролируют методом иммуноанализа). У препарата длинный период полувыведения (в среднем 62 часа), для достижения постоянной минимальной концентрации требуется 24 ч. Сиролимус метаболизируется большей частью печенью через систему CYP3A. Экскреция почками минимальная, при почечной недостаточности коррекция дозы не требуется; при нарушении печёночной функции дозу необходимо уменьшить. При включении сиролимуса в протокол иммуносупрессии нет необходимости в мониторировании терапевтического уровня. Однако измерение концентрации препарата может быть полезным при использовании сиролимуса у детей, у пациентов с поражением печени и реципиентов, которым вводят взаимопотенциирующие препараты. При ежедневной дозе 2 мг средняя концентрация сиролимуса в среднем составляет 9 нг/мл. Необходимый минимальный уровень концентрации сиролимуса должен составлять в крови 5–15 нг/л. Ввиду того, что сиролимус и циклоспорин метаболизируются одними и теми же ферментными системами, одновременный прием этих двух препаратов значительно (на 230%) увеличивает площадь под кривой концентрации сиролимуса. По этой же причине рекомендован приём сиролимуса только через 4 часа после приёма утренней дозы циклоспорина. Взаимодействие сиролимуса с антагонистами кальция, противогрибковыми и противосудорожными препаратами аналогично циклоспорину.
Структурное сходство сиролимуса с такролимусом не влияет на его нефротоксический потенциал. Сиролимус не обладает нефротоксичностью ввиду иного механизма действия. Клинические испытания сиролимуса показали, что базисная терапия сиролимусом в комбинации с микофенолата мофетилом была более безопасной для почечной функции по сравнению с циклоспорином; показатели фильтрации (уровень креатинина, клиренс и СКФ) были лучше в группе больных, получавших сиролимус.
Более высокие дозы сиролимуса эффективны для предупреждения эпизодов острого отторжения, но обусловливают такие осложнения, как микроангиопатии, появление кожных язв и лимфоцеле, замедленное заживление ран, в редких случаях неинфекционные пневмониты. Все перечисленное позволяет предположить, что сиролимус может явиться важной альтернативой препаратам, действующим на кальциневрин (циклоспорин и такролимус).
ЭВЕРОЛИМУС (СЕРТИКАН)
Эверолимус — модификация сиролимуса, ингибитор пролиферативного сигнала, обладающий противоопухолевым действием, антицитомегаловирусной активностью и обеспечивающий защиту эндотелия, способствуя профилактике тяжёлых осложнений.
На первых этапах клинического применения этот препарат назначали одновременно с полными дозами ингибиторов кальциневрина. Однако при такой комбинации была выявлена тенденция к увеличению риска нефротоксического действия ингибиторов кальциневрина.
Результаты недавно проведённых исследований свидетельствуют о том, что иммуносупрессивные схемы с включением эверолимуса в дозе 1,5–3,0 мг/сут позволяют снизить уровень циклоспорина в крови, уменьшая таким образом нефротоксичность без ущерба для общей эффективности иммуносупрессии. Уже в ранние сроки после трансплантации назначение эверолимуса позволяет снизить дозы циклоспорина. Уровень циклоспорина в крови может быть снижен на 50% в течение 1 года при комбинированном применении эверолимуса. Среди побочных эффектов при назначении эверолимуса описаны артралгии, отёки и лимфоцеле. В целях максимального сохранения функции пересаженного органа назначение эверолимуса может быть полезным у пожилых пациентов или реципиентов из пар «пожилой донор –пожилой реципиент», а также «молодой реципиент–пожилой донор».
АЗАТИОПРИН (ИМУРАН)
Впервые P. Bent (1961) показал, что имидазольные производные 6-меркаптопурина (позднее названные азатиоприном) способны тормозить пролиферацию лимфоцитов. С 1962 года азатиоприн был включен в протокол иммунодепрессивной терапии при пересадке почки.
Азатиоприн в организме подвергается ферментативному расщеплению на меркаптопурин и тиоимидазольное соединение; иммуносупрессивное действие обусловлено каждым из образовавшихся соединений. Действие азатиоприна начинается через 2–4 дня и продолжается в течение 2–4 дней после прекращения приёма. Азатиоприн хорошо всасывается в желудке при приёме внутрь. В плазме до 30% препарата связывается с белками. Азатиоприн препятствует синтезу de novo пуриновых нуклеотидов. Вследствие включения препарата в синтез ДНК нарушается образование нуклеотидной цепи. Азатиоприн подавляет активность естественных клеток-киллеров и цитотоксический эффект клеток, опосредованных антителами; за счёт воздействия на клетки-предшественники ингибирует пролиферацию лимфоцитов. Отмена препарата приводит к нормализации этих показателей. Такое же действие азатиоприн оказывает на другие пролиферирующие клетки организма.
Измерение концентрации препарата не проводят; его доза определяется индивидуально. Когда азатиоприн используется как основной иммунодепрессант, дневная доза для приёма внутрь составляет 2–3 мг на 1 кг массы тела. В качестве дополнительной терапии с ингибиторами кальциневрина используется доза 1–2 мг на 1 кг массы тела. Эффективность препарата не зависит от концентрации в крови. Азатиоприн мало диализируется и не экскретируется почками.
У пациентов, впервые получающих азатиоприн в дозе более 2 мг на 1 кг массы тела, необходимо не реже 1 раза в неделю на протяжении первых месяцев иммунизации выполнять подсчёт тромбоцитов, лейкоцитов. Редко азатиоприн может стать причиной гепатита или холестаза, представленных обычно обратимым повышением трансаминаз и уровнем билирубина. Дозу азатиоприна в этом случае, как правило, снижают или отменяют приём препарата на время эпизода печёночной дисфункции. Панкреатит — редкое осложнение.
Поскольку азатиоприн конвертируется в неактивную 6-тиомочевую кислоту посредством ксантиноксидазы, следует осторожно комбинировать его с аллопуринолом (или исключать их совместное применение). С началом приёма аллопуринола доза азатиоприна должна быть снижена на 25–50% от её исходного уровня под контролем тромбоцитов и лейкоцитов в периферической крови.
Существуют ограничения, которые необходимо иметь в виду при применении азатиоприна. Он имеет низкий иммунодепрессивный индекс, вызывает лейко- и тромбоцитопению, обладает гепатотоксичностью и повышает риск малигнизации, особенно образования В-лимфом. Все это привело к разработке новых ингибиторов синтеза нуклеотидов.
ЦИКЛОФОСФАМИД
Циклофосфамид — алкилирующий цитостатик с характерным химическим строением: его молекула имеет две фосфатидные связи и одну фосфорно-эфирную. Сам препарат не обладает алкилирующими свойствами, однако, имея два активных участка, которые перекрёстно связывают цепи ДНК и препятствуют их расхождению во время деления клетки, способен останавливать пролиферацию любых быстро делящих клеток, в том числе иммунокомпетентных. Кроме того, циклофосфамид может ингибировать синтез рибонуклеиновой кислоты и белков, гликолиз и дыхание, функцию различных ферментов, тем самым, подавляя функцию неделящихся клеток. Препарат проявляет иммуносупрессивную активность в отношении практически всех клонов иммунокомпетентных клеток как пролиферирующих, так и покоящихся. В зависимости от дозы препарата, времени, типа антигенной стимуляции, частоты приёма циклофосфамид подавляет как гуморальный, так и клеточный иммунитет. В средних терапевтических дозах (2–5 мг/кг в сутки) препарат токсичен для В-лимфоцитов, угнетает их стимулированную пролиферацию. При его введении истощаются В-клеточнозависимые области селезёнки и лимфатических узлов без нарушения Т-клеточнозависимых регионов. Восстановление продукции антител В-клетками после прекращения введения препарата происходит медленнее, чем восстановление Т-клеточных функций. Циклофосфамид в дозе от 100 до 600 мг на 1 м2 поверхности тела вызывает кратковременное уменьшение количества В-лимфоцитов и избирательно влияет на их функцию, нормализует повышенное количество циркулирующих В-клеток, спонтанно секретирующих иммуноглобулины у больных, что служит одним из объяснений эффективности препарата при заболеваниях, обусловленных иммунными комплексами. Клетки-мишени для циклофосфамида — В-лимфоциты, Т-лимфоциты-хелперы, предшественники Т-лимфоцитов-супрессоров, зрелые Т-лимфоциты-супрессоры, предшественники эффекторных клеток, хотя все они различаются по чувствительности.
Супрессорная функция Т-лимфоцитов более чувствительна к действию циклофосфамида, чем хелперная, поэтому соотношение Тх/Тс на фоне приёма препарата временно повышается.
Положительный терапевтический эффект проявляется при ежедневном приёме препарата внутрь в низких дозах, при этом количество полиморфно-ядерных клеток практически не меняется. Пероральная терапия низкими дозами в большей степени влияет на клеточный иммунитет, тогда как периодическое одноразовое введение больших доз препарата — на антителообразование.
В дозе 600 мг на 1 м2 поверхности тела и более препарат снижает общее количество всех субпопуляций Т-лимфоцитов также, как и их соотношение, которое восстанавливается к 12-му дню после отмены препарата. Ингибирование эффекторных функций клеточного иммунитета — результат прямого повреждения циклофосфамидом незрелых компонентов костномозговой ткани, ведущего к уменьшению числа и активности зрелых эффекторных клеток.
При назначении циклофосфамида наблюдают характерные побочные эффекты:
· лейкопения (17% случаев);
· транзиторная алопеция (4% случаев);
· геморрагический цистит (2% случаев).
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КАЗАНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ИММУНОСУПРЕССИЯ
ПРИ
ТРАНСПЛАНТАЦИИ ПОЧКИ
Учебное пособие для врачей
Казань 2009 г.
ББК 54.547
УДК 616.089.819.843
Учебное пособие подготовлено ассистентом кафедры урологии и нефрологии ГОУ ДПО «КГМА Росздрава», главным внештатным специалистом трансплантологом Министерства Здравоохранения Республики Татарстан, членом экспертного совета в сфере здравоохранения Министерства здравоохранения и социального развития Российской Федерации по «Трансплантологии» Галеевым Ш.Р.
В пособии приведены основные данные по современным иммуносупрессивным препаратам и их основным побочным действиям. В пособии обсуждены избранные вопросы с многокомпонентных схем иммуносупрессивной терапии у пациентов после трансплантации почки.
Пособие предназначено для врачей нефрологов, реаниматологов, терапевтов, хирургов и урологов, занимающихся лечением пациентов на разных сроках после трансплантации почки.
Рецензенты:
Цибулькин Анатолий Павлович, зав. кафедрой клинической лабораторной диагностики, д.м.н., профессор
Андрей Иванович Гурьянов Главный внештатный уролог г. Казани, зав. отделением урологии МУЗ «БСМП №2»
Учебное пособие утверждено и рекомендовано к изданию Методическим советом ГОУ ДПО КГМА от «__» _______ 200_ г. (протокол №______).
С учебным пособием можно ознакомиться в библиотеке ГОУ ДПО КГМА по адресу: 420012, г. Казань, ул. Муштари, д.11
СОДЕРЖАНИЕ
| Введение………………………………………………………….…………
| 4
|
| Глюкокортикоиды (преднизолон, метилпреднизолон)..………………
| 5
|
| Циклоспорин А (Сандиммун Неорал)……………………………………
| 7
|
| Такролимус (програф),……………………………………………………..
| 11
|
| Микофенолата мофетил (Селлсепт)………………………………………
| 16
|
| Микофеноловая кислота (Майфортик)……………………………………
| 19
|
| Сиролимус (Рапамун)………………………………………………………
| 20
|
| Эверолимус (Сертикан)…………………………………………………….
| 22
|
| Азатиоприн (Имуран)………………………………………………………
| 23
|
| Циклофосфамид…………………………………………………………….
| 24
|
| Поликлональные антитела (Атгам, АТГ фрезениус, Тимоглобилин)…..
| 26
|
| Моноклональные антитела (ОКТ-3)……………………………………
| 29
|
| Даклизумаб и базиликсимаб (Знапакс, Симулект)……………………….
| 31
|
| Список литературы…………………………………………………………
| 35
|
ВВЕДЕНИЕ
Увеличение выживаемости трансплантата и пациентов связано с внедрением в клиническую практику ингибитора кальциневрина — циклоспорина, что значительно увеличило как краткосрочную, так и долговременную выживаемость трансплантата. В последние годы арсенал иммуносупрессивных средств расширяется за счёт новых ингибиторов кальциневрина (такролимус), ингибиторов биосинтеза пуринов (микофеноловая кислота, микофенолата мофетил), поли- и моноклональных антител и ингибиторов пролиферативного сигнала (эверолимус). Клиническими наблюдениями подтверждено, что комбинированное назначение перечисленных препаратов уменьшает частоту острого отторжения и увеличивает дальнейшую выживаемость трансплантата. Оптимальные режимы обеспечивают приемлемый баланс между необходимым уровнем иммуносупрессии и нежелательными побочными эффектами (высокий риск развития инфекционных осложнений, сердечно-сосудистых заболеваний, малигнизация и нефротоксическое действие).
В настоящее время стандартный протокол иммуносупрессии в клинической практике включает неспецифические препараты нескольких типов:
1. глюкокортикоиды;
2. ингибиторы кальциневрина (циклоспорин, такролимус);
3. цитостатики — ингибиторы биосинтеза пуринов (микофенолата мофетил, микофеноловая кислота); ранее применяли антиметаболиты (азатиоприн), алкилирующие препараты (циклофосфамид);
4. ингибиторы пролиферативного сигнала (сиролимус, эверолимус).
5. биологические иммуносупрессивные препараты: поликлональные антитела (атгам, тимоглобулин, АТГ фрезениус);
6. гуманизированные моноклональные антитела — антагонисты рецепторов интерлейкина 2 (даклизумаб, базиликсимаб);

|
| Рисунок №1 Иммуносупрессивные препараты и точки их приложения.
CsA – циклоспорин А, Tacrolimus – такролимус, Aza – азатиоприн, ММФ – мофетила микофенолат, МФК – микофеноловая кислота
|
ГЛЮКОКОРТИКОИДЫ (ПРЕДНИЗОЛОН, МЕТИЛПРЕДНИЗОЛОН)
Назначать глюкокортикоиды при трансплантации органов начали более 45 лет назад. В отличие от других иммунодепрессантов с более ограниченным диапазоном действия, влияние препаратов данной группы на иммунный ответ осуществляется по многофакторному механизму (специфическое воздействие на макрофаги и Т-клетки, неспецифическое и противовоспалительное воздействие). Глюкокортикоиды ингибируют экспрессию γ-интерферона и ИЛ-1, в большей степени ИЛ-2, ИЛ-3, ИЛ-6, фактор некроза опухоли α. В результате ингибируются все стадии процесса активации Т-клеток.
Глюкокортикоиды — жирорастворимые соединения, поэтому они свободно проникают через клеточную мембрану в цитозоль, где связываются с рецепторным белком с последующей трансформацией и активацией комплекса. После транслокации в ядре комплекс связывается со специфическим участком ДНК и тормозит транскрипцию генов цитокинов. Часто при остром отторжении выброс цитокинов проявляется лихорадкой, легко купируемой при применении больших доз глюкокортикоидов.
Один из неспецифических иммунодепрессивных эффектов глюкокортикоидов — лимфопения. Препараты данной группы исключительно быстро депонируют лимфоциты из сосудистого русла в центральные лимфоидные органы, что способствует предохранению трансплантата от проникновения в него цитотоксических Т-лимфоцитов. Влияние глюкокортикоидов на моноциты и полиморфноядерные лейкоциты оказывается благоприятным при остром отторжении, когда в трансплантате находится избыток подобных клеток. Под воздействием данных препаратов ингибируется миграция моноцитов в области воспаления, кроме того, они блокируют синтез, высвобождение и действие некоторых хемокинов — агентов повышенной проницаемости и вазодилятаторов, чем и обусловливают противовоспалительный эффект.
Глюкокортикоиды инактивируются и превращаются в печени ферментами системы цитохрома Р450, конъюгированные производные выделяются главным образом с мочой, а не с желчью или калом.
В клинической трансплантологии применяют различные способы введения глюкокортикоидов:
1. внутривенно (пульстерапия) в течение 3–5 дней в больших дозах;
2. приём внутрь ежедневно в течение длительного срока после аллотрансплантации с целью профилактики реакции острого отторжения.
3. Профилактическое лечение глюкортикоидами снижает частоту отторжения. Возможность отмены данных препаратов следует рассматривать только через несколько месяцев или лет после аллотрансплантации, у пациентов без повторных кризов отторжения и с хорошей функцией трансплантата.
4. Комбинации такролимуса в качестве основного компонента иммуносупрессивной терапии индукция моноклональными антителами позволяют в ряде случаев проводить раннюю отмену глюкокортикостероидов.
При длительном применении глюкокортикоидов наряду с иммунодепрессивным действием чётко проявляются побочные эффекты, которые зависят от дозы и длительности лечения. К грозным осложнениям гормонального лечения относят:
1. замедление роста (особенно у детей после аллотрансплантации почки);
2. заболевания костной ткани (асептические некрозы; остеопороз у 15% больных, которые применяли высокие дозы глюкокортикоидов, и у 1–2% реципиентов при использовании низких доз);
3. задняя лентикулярная катаракта в 60% случаев спустя 6–8 месяцев после аллотрансплантации, особенно в случаях использования высоких доз глюкокортикоидов;
4. гипергликемия и нарушение толерантности к глюкозе.
Одно из тяжёлых осложнений — увеличение массы тела и ожирение спустя 2–3 месяца после пересадки органа. Гиперлипидемия, гиперхолестеринемия, гипертриглицеридемия с последующими признаками развития атеросклероза и заболеваний коронарных и церебральных сосудов являются осложнениями, которые могут играть роль в хронической реакции отторжения и снижении функции трансплантата. Кроме того, в ряде случаев отмечают артериальную гипертензию, язвенную болезнь желудка и двенадцатиперстной кишки, плохое заживление ран, психопатологические состояния, как в раннем, так и в более отдалённом периоде.








