

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Оснащения врачебно-сестринской бригады.
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
1) Активное дыхание или крик.
Хороший тонус.
ЧСС более 100 в 1 мин.
Такие дети не требуют вмешательств кроме обтирания, укрывания теплым полотенцем и, если возможно, выкладывания к матери. Ребенок будет оставаться теплым благодаря контакту кожа к коже и может быть приложен к груди на этом этапе.
2) Дыхание неадекватное или апноэ.
Нормальный или сниженный тонус.
ЧСС менее 100.
Обсушить и укрыть. Такому ребенку может быть достаточно масочной вентиляции, но если на фоне этого не повышается ЧСС, может потребоваться компрессия грудной клетки.
3) Дыхание неадекватное или апноэ.
Атония.
Низкая или неопределяемая ЧСС.
Часто бледность вследствие плохой перфузии.
Обсушить и накрыть. Такой ребенок требует немедленной оценки проходимости дыхательных путей и вентиляции. Также может потребоваться компрессия грудной клетки и введение препаратов.
Также имеется небольшая группа детей, у которые при адекватном дыхании и нормальной ЧСС сохраняется гипоксемия. Эта группа включает следующие возможные состояния: диафрагмальная грыжа, дефицит сурфактанта, врожденная пневмония, пневмоторакс, «синие» ВПС.
Реанимация новорожденных
Начинайте проводить реанимационные мероприятия, если у ребенка не установилось регулярное адекватное нормальное дыхание или ЧСС менее 100 в 1 мин. Обычно необходимо обеспечение проходимости дыхательных путей и аэрация легких. Если эти 2 шага не будут успешно проведены, последующие действия также могут не принести результата.
Воздухоносные пути
Положите ребенка на спину с головой в нейтральном положении. Если положить под плечи ребенка одеяло или полотенце слоем толщиной 2 см, это поможет придать голове ребенка правильное положение.
|
|
Санация необходима лишь в случае обструкции дыхательных путей. Обструкция может быть обусловлена частицами мекония, сгустками крови, вязкой слизью или смазкой (даже при светлых околоплодных водах). Однако агрессивная санация может отсрочить начало самостоятельного дыхания и вызвать ларингеальный спазм и брадикардию. Показанием к немедленной санации является рождение неактивного ребенка с водами, густо окрашенными меконием. Если санацию проводить необходимо, это лучше сделать под контролем зрения. Присоедините отсосный катетер 12–14 Fr или отсос Yankauer к отсосу, создающим разрежение, не превышающее – 100 мм рт. ст.
Дыхание
При отсутствии попыток дыхания или их неадекватности необходимо проведение вентиляции легких. У доношенных детей начинайте вентиляцию воздухом. Первичной мерой адекватности вентиляции является нарастание ЧСС; оценивайте экскурсию грудной клетки, если ЧСС не увеличивается.
Для первых пяти вдохов удерживайте первичное давление в течении 2–3 секунд. Это будет способствовать расправлению легких. Большинство детей ответят на ИВЛ увеличением ЧСС в течение первых 30 секунд. Если ЧСС увеличилась, но адекватное дыхание не установилось, продолжайте дышать с частотой 30 в 1 минуту (давая примерно 1 с на каждый вдох), до установления самостоятельного дыхания. Отсутствие ответа на аэрацию чаще всего связано с неадекватной вентиляцией. Обратите внимание на движение грудной клетки в момент попытки вдоха. Если экскурсия присутствует, значит аэрация легких была выполнена, если отсутствует, значит или проходимость дыхательных путей не обеспечена, или аэрация не достаточна. Без адекватной вентиляции легких компрессия грудной клетки не будет эффективна, поэтому убедитесь в аэрации легких до начала циркуляторной поддержки.
Некоторые доктора обеспечивают контроль за проходимостью дыхательных путей путем интубации трахеи, однако это требует тренировки и опыта. Если вы не владеете этими навыками, а ЧСС снижается, то перепроверьте положение дыхательных путей и продолжайте дышать, пока не придет ваш коллега, который владеет навыками интубации.
|
|
Продолжайте дыхательную поддержку до тех пор, пока у ребенка не установится адекватное регулярное дыхание.
Циркуляторная поддержка
Циркуляторная поддержка с проведением компрессии грудной клетки эффективна только в случае адекватной вентиляции. Начинайте компрессию в том случае, если ЧСС менее 60 в 1 минуту несмотря на адекватную вентиляцию.
Самой эффективной техникой выполнения компрессии грудной клетки является следующая. Положите 2 больших пальца рядом друг с другом в нижней трети грудины (чуть ниже линии, соединяющей соски), а остальными пальцами обхватите грудь ребенка, смыкая их на его спине. Другим способом найти правильное положение больших пальцев является нащупать мечевидный отросток и подняться на ширину одного пальца выше него. Грудина сдавливается на глубину примерно 1/3 от переднезаднего размера грудной клетки. Давайте возможность грудине возвращаться в исходное положение между компрессиями.
Используйте соотношение 3 сжатия к 1 вдоху, стремясь обеспечить 120 приемов в минуту, то есть выполнить примерно 90 компрессий и 30 вдохов. Однако качество выполнения компрессий и вдохов, вероятно, важнее их количества.
Посчитайте ЧСС через 30 с, затем каждые 30 с. Прекратите компрессию, когда ЧСС превысит 60 в 1 минуту.
Лекарственные препараты
Лекарственные препараты редко показаны при проведении реанимации новорожденных. Брадикардия в большинстве случаев связана с неадекватной вентиляцией и глубокой гипоксией и обеспечение адекватной вентиляции является самым важным шагом в борьбе с брадикардией. Однако, если ЧСС остается менее 60 в 1 минуту на фоне адекватной вентиляции и компрессии грудной клетки, имеет смысл применять лекарственные препараты. Лучше всего вводить их через катетер, установленный в пупочную вену.
Адреналин
Адреналин можно использовать в случае, если на фоне адекватной вентиляции и компрессии грудной клетки ЧСС снижается меньше 60 в 1 мин. Адреналин вводится внутривенно в дозе 10–30 мкг/кг как можно быстрее.
Эндотрахеальное введение не рекомендуется, но если препарат все‑таки вводится через интубационную трубку, должны применяться дозы 50‑100 мкг/кг. Ни эффективность, ни безопасность таких доз не была изучена. Не вводите такие дозы внутривенно.
|
|
Бикарбонат
Если несмотря на адекватную вентиляцию и компрессию грудной клетки сердечный выброс недостаточен, устранение ацидоза может улучшить функциональную способность миокарда. Недостаточно данных для того, чтобы рекомендовать рутинное введение бикарбоната при реанимации новорожденных. Гиперосмолярность соды и ее способность усиливать продукцию диоксида углерода может ухудшать миокардиальную и церебральную функции. Использование соды при кратковременных реанимационных мероприятиях дискутабельно. Ее можно вводить при длительной реанимации, если нет ответа на другие манипуляции. Сода должна вводиться только после обеспечения адекватной вентиляции и циркуляции. Доза 1–2 ммоль/кг должна вводиться внутривенно медленно.
Жидкость
Если предполагается потеря крови или у ребенка при рождении отмечаются клинические признаки шока (бледность, плохая перфузия, слабый пульс) и не отмечается ответа на все остальные реанимационные мероприятия, то необходимо вводить жидкость. Это случается редко. Если в наличии нет подходящей крови (облученной и лейкоцит‑фильтрованной О (I)Rh группы крови), то лучше вводить изотонические кристаллоиды, чем альбумин. Введите болюсно 10 мл/кг, затем могут потребоваться повторные введения.
Прекращение реанимационных мероприятий
Местные и национальные комитеты должны определять показания к прекращению реанимационных мероприятий. Если у новорожденного не выслушиваются тоны сердца при рождении и на протяжении 10 минут после этого, необходимо принимать решение о прекращении реанимации. При принятии этого решения следует также опираться на следующие факторы: предполагаемая этиология, срок гестации, потенциальная обратимость ситуации, мнение родителей о возможном риске развития серьезных заболеваний.
В тех случаях, когда ЧСС при рождении и на протяжении 10–15 минут менее 60 в 1 минуту на фоне адекватных реанимационных мероприятий, принятие решения о прекращении реанимации еще более сложно.
|
|
Общение с родителями
Важно, чтобы команда, оказывающая помощь новорожденному, информировала родителей о состоянии ребенка. Положите ребенка с матерью как только появится такая возможность. Если ребенок нуждается в реанимационных мероприятиях, информируйте родителей о своих действиях и о целях их выполнения.
В идеале решение о прекращении реанимационных мероприятий должно приниматься вместе с вышестоящими коллегами. При возможности решение о необходимости проведения реанимационных мероприятий глубоконедоношенным детям должно приниматься консилиумом, в состав которого входят зав. детским отделением, акушеры и гинеколог. Когда возможные проблемы прогнозируемы, например при выявленных врожденных пороках, необходимо обсудить вопрос с родителями, акушерками, акушерами до родов. Тщательно запишите все вопросы и решения в историю родов и историю развития новорожденного.
Специфические вопросы, обсуждаемые консенсусом по реанимации (2010)
Поддержание нормальной температуры недоношенных детей .
У глубоконедоношенных детей часто отмечается гипотермия, несмотря на соблюдение стандартных теплосберегающих методик (обтирание, укрывание, помещение под источник лучистого тепла). Некоторые рандомизированные контролируемые исследования и обсервационные наблюдения показали, что помещение ребенка под ИЛТ и обертывание его пищевой пленкой без предварительного обтирания положительно влияет на температуру ребенка при поступлении в ОРИТ. Температура ребенка должна тщательно мониторироваться, так как существует (хоть и небольшой) риск развития гипотермии при использовании этой технологии. Все манипуляции, включая интубацию, компрессию грудной клетки, обеспечение венозного доступа должны осуществляться без снятия пленки. Глубоконедоношенные дети поддерживают свою температуру лучше, если температура воздуха в помещении 26 °C и выше.
Среди детей, рожденных от матерей, у которых выявлена лихорадка, чаще отмечаются перинатальная дыхательная депрессия, неонатальные судороги, ранняя смертность и ДЦП. Исследования на животных показали, что гипертермия во время или после ишемии ассоциируется с прогрессированием повреждения мозга. Следует избегать гипертермии.
Меконий
Раньше считалось, что очищение дыхательных путей ребенка при рождении снижает частоту развития и тяжесть САМ. Однако все исследования, подтверждающие это мнение, были сделаны ретроспективно. Кроме того, другие исследователи не нашли каких‑либо доказательств пользы от проведения этой процедуры. В 2000 году, мультицентровое рандомизированное контролируемое исследование показало, что рутинная интубация и санация новорожденных, активных при рождении, не снижает частоту возникновения САМ, а рандомизированное исследование 2004 года показало, что санация рта и носа ребенка до его полного рождения неэффективна. Такого рода санация, а также санация ТБД детям, активным при рождении, не рекомендуется. Остается нерешенным вопрос о том, что делать в такой ситуации с детьми, которые не активны при рождении. Обсервационные исследования подтвердили, что среди этих детей повышен риск развития САМ, однако не выполнено рандомизированных исследований, в которых бы оценивалась роль интубации путем сравнения с группой, в которой дети не были интубированы.
|
|
Рекомендации: в условиях отсутствия рандомизированных контролируемых исследований не возможно рекомендовать менять существующую практику проведения прямой орофарингеальной и трахеальной санации детям с синдромом угнетения ЦНС. Однако, если выполнение интубации затягивается или производится неуспешно, необходимо начать масочную вентиляцию, особенно, если отмечается брадикардия.
Воздух или 100 % кислород
При реанимации новорожденного ребенка в родильном зале ключевой задачей является обеспечение газообмена в легких, который сменяет плацентарный газообмен. Ранее считалось, что высокие концентрации кислорода в тканях могут помочь снизить количество клеток, поврежденных в результате анаэробных процессов. Однако в последние 30 лет был открыт феномен «кислородного парадокса», заключающийся в том, что клетки и ткани повреждаются при воздействии кислородных радикалов; обсуждалась роль свободных радикалов, антиоксидантов и связь с апоптозом и реперфузионными повреждениями тканей. В свете этих знаний, стало трудно поддерживать идею, что высокие концентрации кислорода, даже при кратковременном применении, безвредны. Кроме того, рандомизированные исследования показали, что применение воздуха для вентиляции детей, рожденных в состоянии асфиксии, по крайней мере не менее эффективно, чем применение кислорода.
Также имеется большое количество доказательств, полученных в ходе исследований на животных и с участием людей, того, что гипероксия сама по себе повреждает мозг и другие органы на клеточном уровне, особенно после асфиксии. Исследования на животных показали, что риск развития таких повреждений выше при незрелом мозге на протяжении его активного роста (с середины беременности до 3 лет). Этот риск включает в себя повреждение клеток‑предшественниц глиального ростка и нарушение миелинизации.
Применение высоких концентраций кислорода при рождении приводит к образованию активных радикалов кислорода, которые, в свою очередь, снижают способность легочной артерии к релаксации в дальнейшем.
На сегодняшний день существует большое количество работ, в которых отражены данные оксиметрии новорожденных сразу после рождения. У доношенных детей, не входящих в группу риска, Sp02 составляла около 60 % в родах и повышалась до 90 % к 10‑й минуте. 25‑й центиль находится на уровне 40 % при рождении и около 80 % через 10 минут. Эти показатели ниже у детей, рожденных путем кесарева сечения. Недоношенным детям требуется больше времени для достижения уровня сатурации более 90 %. При подаче кислорода частота сатурации более 95 % значительно выше, даже в тех случаях, когда используется методика постепенного снижения Fi02
Рекомендации: Если доношенный ребенок нуждается в проведении реанимации с положительным давлением, лучше начинать с воздуха, чем со 100 %) кислорода. В том случае, если несмотря на эффективную вентиляцию, не отмечается увеличения ЧСС и оксигенации (при возможности измеренной с помощью пульсоксиметра), используйте более высокие концентрации кислорода.
Так как у недоношенных со сроком гестации менее 32 недель целевых уровней сатурации трудно достичь при использовании воздуха, необходимо применять кислородно‑воздушную смесь (в идеале под контролем пульсоксиметрии).
Следует избегать как гипероксии, так и гипоксии. Если нет возможности создать кислородно‑воздушную смесь, начинайте реанимацию с воздуха.
Время пережатия пуповины
Видеорадиографические исследования показали, что у новорожденных, пуповина которых была пережата до первого вдоха, отмечается немедленное снижение размеров сердца в течение первых 3–4 сердечных циклов. Затем сердце увеличивается до размеров, соответствующих размерам сердца плода. Brady и James обратили внимание на брадикардию, связанную, вероятно, с пережатием пуповины до первого вдоха. Может ли раннее пережатие пуповины у глубоконедоношенных детей привести к созданию отрицательного давления в грудной полости и вызвать или удлинить период брадикардии, что приведет к необходимости проведения реанимационных мероприятий?
Исследования, проведенные у доношенных детей, показали, что отсроченное пережатие пуповины положительно влияет на содержание железа в организме, а также на количество различных клеток крови на протяжении первых 3–6 месяцев. Также было показано, что в группе детей с отсроченным пережатием пуповины чаще применялась фототерапия для лечения желтухи, однако возможно другие факторы вызвали повышение билирубина.
Исследования у недоношенных детей выявили повышение стабильности в раннем постнатальном периоде и снижение числа гемотрансфузий в последующие недели. В ряде исследований предполагается связь снижения частоты ВЖК и позднего сепсиса. Также ряд исследований сообщает об увеличении частоты желтух и фототерапий, однако частота ЗПК не увеличивалась.
В исследованиях не было изучено влияние времени пережатия пуповины на частоту реанимационных мероприятий, потому что такие дети были исключены.
Рекомендации: отсрочка пережатия пуповины по крайней мере на 1 минуту рекомендуется у детей, не требующих реанимационных мероприятий. Такая же тактика может быть применена у стабильных недоношенных детей. Для детей, нуждающихся в реанимации, важнее начать реанимационные мероприятия.
Первые вдохи и ВИВЛ
У доношенных детей самостоятельные вдохи или вдохи с помощью ВИВЛ создают функциональную остаточную емкость. Оптимальное давление, время вдоха и поток, требующиеся для создания эффективной остаточной емкости, не определены. Обычно среднее пиковое давление составляет 30–40 мм (время вдоха не определено) или больше у некоторых доношенных детей. Если пиковое давление не может мониторироваться, а используется лишь клапан сброса, то применяйте минимальное давление, достаточное для увеличения ЧСС. Нет достоверных доказательств для рекомендации какого‑либо времени вдоха. Частота дыхания при проведении ИВЛ должна составлять около 60 в 1 минуту для достижения или поддержания ЧСС на уровне больше 100 в 1 мин.
ВИВЛ у недоношенных
Исследования на животных показали, что незрелые легкие легче повредить большим объемом сразу после рождения и что поддержание давления на выдохе сразу после рождения защищает от повреждения легких. Положительное давление в конце выдоха также улучшает комплайнс легких и газообмен.
Как перераздутие, так и повторные спадения альвеол вызывали повреждение легких у экспериментальных животных. В идеале дыхательный объем должен измеряться и после аэрации легких составлять 4–8 мл/кг для предотвращения перерастяжения.
При вентиляции недоношенных детей следует избегать выраженных пассивных движений грудной клетки, так как они могут свидетельствовать об избыточном дыхательном объеме. Мониторирование давления может помочь создать постоянное расправление и избежать создания высокого давления. Если недоношенному ребенку требуется ИВЛ, то начальное давление на вдохе должно быть 20–25 мм. Если на фоне этого не отмечается увеличения ЧСС и экскурсий грудной клетки, то может потребоваться большее давление. Применение ПДКВ может быть полезно при продолжающейся ИВЛ. СРАР может применяться у недоношенных детей с самостоятельным дыханием после проведения ИВЛ.
Устройства
Для эффективной вентиляции могут быть использованы: потоком расправляющиеся мешки, саморасправляющиеся мешки и Т‑адаптер. Клапан сброса в саморасправляющихся мешках зависит от потока, поэтому создаваемое таким мешком давление при активном сжатии может превышать давление, указанное производителем как максимальное. Необходимое давление вдоха и время вдоха более постоянны при использовании Т‑адаптера, чем при использовании мешка, хотя достоверных данных о клинических преимуществах не имеется. Использование мешков, расправляемых потоком, требует больших навыков, чем использование саморасправляющихся мешков. Все эти 3 типа устройств способны ограничивать пиковое давление, создаваемое в дыхательных путях, могут быть использованы для вентиляции новорожденных.
Ларингеальные маски
В большом количестве исследований было показано, что использование ларингеальной маски может быть эффективно для вентиляции новорожденных с весом более 2000 г, сроком гестации более 33 недель. Было опубликовано несколько случаев, когда ларингеальная маска успешно применялась при неудачной интубации, однако были сообщения и о неудачном использовании. О применении этого метода у детей с меньшим сроком гестации сообщений немного.
Рекомендации: Ларингеальная маска может быть использована при реанимации новорожденных, особенно в тех случаях, когда лицевая маска неэффективна, а интубация неуспешна или невозможна. Ларингеальная маска может быть рассмотрена как альтернатива лицевой маске при проведении ИВЛ у детей с весом более 2000 г и сроком гестации 34 недели и более. Однако доказательств эффективности ее использования у детей с весом менее 2000 г и сроком гестации менее 34 недель недостаточно. Также ларингеальная маска может быть использована как альтернатива интубации у детей с весом более 2000 г и сроком гестации 34 недели и более. Использование ларингеальной маски не оценивалось при наличии мекония в водах, проведении массажа сердца и эндотрахеальном введении препаратов.
Определение диоксида углерода при использовании лицевой или ларингеальной маски
Колориметрические детекторы оксида углерода в выдыхаемом воздухе используются при масочной вентиляции недоношенных в ОРИТ и в родильном зале. Они могут помочь выявить обструкцию дыхательных путей. Ни дополнительной информации (свыше клинических признаков), ни увеличения риска не было выявлено. Данных об использовании детекторов при проведении ВИВЛ в родильном зале с помощью назальных канюлей, ларингеальной маски, опубликовано не было.
Подтверждение положения эндотрахеальной трубки
Интубация трахеи при проведении неонатальной реанимации может потребоваться в следующих случаях:
• для проведения санации трахеи (удаление мекония или других блокирующих элементов);
• если масочная вентиляция неэффективна или затянута;
• если выполняется компрессия грудной клетки;
• специальные состояния (врожденная диафрагмальная грыжа, вес менее 1000 г).
Применение и время интубации зависит от опыта и навыков человека, проводящего реанимацию. Длина интубационной трубки в соответствии с гестационным возрастом представлена в таблице:
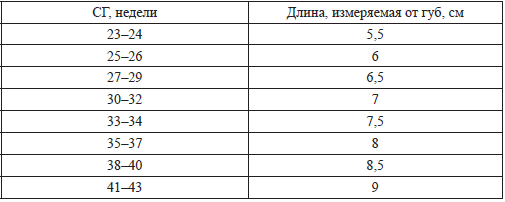
Положение интубационной трубки должно быть оценено визуально во время проведения интубации. Следующее за интубацией и началом ИВЛ увеличение ЧСС – хороший показатель того, что трубка находится в трахеобронхиальном дереве. Детекторы диоксида углерода в выдыхаемом воздухе эффективны для подтверждения положения интубационной трубки у новорожденных, включая детей с ОНМТ. В ряде исследований показано, что использование детекторов более точно и быстро определяет положение трубки по сравнению с использованием только лишь клинических признаков. Отсутствие оксида углерода в выдыхаемом воздухе указывает на эзофагеальную интубацию, однако отмечались случаи ложнонегативных результатов при остановке сердца и у детей с ОНМТ. Ложнеположительные результаты могут отмечаться, если в детектор попали адреналин, сурфактант или атропин. Обедненный легочный кровоток или его отсутствие, обструкция трахеи могут влиять на определение оксида углерода, несмотря на правильное положение интубационной трубки. Положение интубационной трубки правильно определяется почти у всех пациентов, однако у новорожденных в критическом состоянии с небольшим сердечным выбросом отсутствие оксида углерода в выдыхаемом воздухе может привести к ненужной экс‑тубации. Другие клинические показатели положения трубки (запотевание стенок трубки, экскурсия грудной клетки) не были оценены систематически.
Рекомендации: Определение оксида углерода в выдыхаемом воздухе вместе с клиническими признаками рекомендуется как наиболее точный метод определения положения интубационной трубки у новорожденных с установившимся кровообращением.
Способ введения и доза адреналина
Несмотря на широкое применения адреналина при реанимации, не проведено плацебо‑контролируемых клинических исследований, доказывающих его эффективность, не разработаны оптимальные дозы и путь введения.
Описания серий клинических случаев показывают, что доза адреналина, вводимого эндотрахеально, широко варьирует (3‑250 мкг/кг). Эти дозы могут восстановить сердечную деятельность или увеличить ЧСС.
Эндотрахеальное введение адреналина в дозе 10 мкг/кг менее эффективно, чем введение такой же дозы внутривенно. Это подтверждается данными, полученными в исследованиях на животных, где было показано, что эндотрахеально необходимо вводить адреналин в большей дозе (50‑100 мг) для достижения такой же концентрации в крови и такого же гемодинамического ответа. Исследования на взрослых животных показывают, что концентрация адреналина в крови значительно ниже после эндотрахеального введения по сравнению с внутривенным и дозы 50‑100 мкг/кг эндотрахеально могут использоваться при проведении реанимации.
Хотя широко распространенным является мнение, что адреналин эндотрахеально может быть дан быстрее, чем внутривенно, клинических исследований, доказывающих эту гипотезу, нет. В двух отчетах были описаны серии случаев о нецелесообразном введении адреналина до обеспечения адекватной вентиляции. В одной серии случаев, описывающей применение адреналина при отсутствии сердечной деятельности, было показано, что выживаемость выше в группе детей, получивших первую дозу адреналина эндотрахеально, однако время введения первой дозы эндотрахеально и внутривенно не описывается.
Исследования с участием детей и новорожденных животных показали, что при применении высоких доз адреналина (100 мкг/кг) внутривенно отмечалась тенденция к снижению выживаемости и ухудшению неврологических исходов. Есть также работы, показывающие обратное. Однако в мета‑анализе, в который вошли 5 клинических исследований с участием взрослых, было показано, что высокие дозы внутривенного адреналина не оказывают положительного эффекта на выживаемость.
Рекомендации: При необходимости использовать адреналин, введите его как можно раньше внутривенно в дозе 10–30 мкг/кг. Более высокие дозы адреналина внутривенно не должны использоваться и могут быть опасны. Если нет возможности обеспечить венозный доступ, можно попробовать эндотрахеальное введение адреналина. При введении адреналина эндотрахеально вводите большие дозы (50‑100 мкг/кг) для достижения эффекта, аналогичного эффекту внутривенного адреналина в дозе 10 мкг/кг.
Ведение в постреанимационном периоде
Состояние детей, потребовавшее проведения реанимации, может ухудшиться позже. После установления адекватной вентиляции и циркуляции, ребенок должен переводиться в отделение, где есть возможность тщательного мониторирования его состояния и проведения предупреждающих мероприятий.
Глюкоза
Гипогликемия часто ассоциируется с плохими неврологическими исходами у экспериментальных новорожденных животных, родившихся в асфиксии и требующих реанимации. Новорожденные животные, у которых отмечалась гипогликемия во время аноксического или гипоксически‑ишемического инсульта, имеют большую поврежденную зону в головном мозге п/пли сниженную выживаемость по сравнению с контрольной группой. Одно клиническое исследование показывает ассоциацию между гипогликемией и плохими неврологическими исходами после перинатальной асфиксии. У взрослых, детей и новорожденных с ОНМТ, получавших интенсивную терапию, гипергликемия ассоциируется с худшими исходами. Однако у детей гипергликемия после гипоксии – ишемии не оказывает вредного воздействия, что подтверждается данными исследований на животных, в ряде из которых предполагается, что гипергликемия может носить защитный характер. У новорожденных, требовавших проведения реанимации, уровень глюкозы должен мониторироваться и поддерживаться на нормальном уровне.
Индуцированная гипотермия
Несколько рандомизированных контролируемых мультицентровых исследований с применением индуцированной гипотермии (33,5‑34,5 градуса) у новорожденных старше 36 недель гестации со среднетяжелой или тяжелой гипоксически‑ишемической энцефалопатией показали, что охлаждение значимо снижает смертность и неврологическую инвалидизацию в 18 месяцев. Общее охлаждение или локальное охлаждение головы дает сходные результаты. Умеренная гипотермия может ассоциироваться с брадикардией и снижением АД, которые обычно не требуют лечения, однако быстрое согревание может вызвать гипотензию. Глубокая гипотермия (центральная температура ниже 33 градусов) может вызвать
аритмию, кровотечения, тромбозы и сепсис; о таких осложнениях при применении умеренной гипотермии сообщений не было.
Новорожденным, родившимся на доношенном или близком к доношенному сроке, со среднетяжелой или тяжелой гипоксически‑ишемической энцефалопатией, должна применяться лечебная гипотермия (при наличии такой возможности). Как общее охлаждение, так и локальное охлаждение головы могут быть использованы. Терапия должна проводиться в соответствии с протоколами, используемыми в рандомизированных клинических исследованиях. Гипотермия представленная в клинических исследованиях начинается в течение 6 часов после рождения и может продолжаться в течение 72 часов после рождения, согревание должно занимать не менее 4 часов. Исследования на животных показали, что положительное влияние гипотермии строго зависит от раннего начала. Нет доказательств того, что охлаждение, начатое после 6 часов жизни у новорожденных, имеет какой‑то положительный эффект. Необходимо тщательное мониторирование показателей, которые могут изменяться при гипотермии – АД (гипотензия) и количество тромбоцитов (тромбоцитопения). Все дети, получавшие гипотермию, должны длительно находиться под наблюдением.
Ситуации, в которых реанимация не проводится и прекращение реанимации
Смертность и заболеваемость новорожденных варьирует в зависимости от региона и имеющихся ресурсов. Социальные научные исследования показывают, что родители играют большую роль в принятии решения
о реанимации и продолжении поддерживающих жизнь манипуляций у детей с серьезными заболеваниями.
Ситуации, в которых реанимация не проводится Решение о необходимости проведения реанимации при состояниях с высоким уровнем смертности и плохих исходов должно приниматься заранее с участием родителей (при наличии такой возможности).
Согласованное решение в каждом конкретном случае должно приниматься при участии акушеров, неонатологов и родителей. Следующие тактики могут применяться в соответствии с имеющимися в данном регионе исходами:
1) В тех случаях, когда срок гестации, вес при рождении и/или врожденные аномалии ассоциированы с очень высоким процентом смертности, а у немногих выживших развиваются тяжелые заболевания, реанимация не показана. К опубликованным примерам относятся: глубокая недоношенность (СГ менее 23 недель и/или вес при рождении менее 400 г) и такие аномалии, как анэнцефалии и подтвержденные трисомии по 13 и 18 паре хромосом;
2) Реанимация почти всегда показана при высоком уровне выживаемости и допустимом уровне заболеваемости. К этой группе относятся дети со СГ 25 недель и больше (за исключением подтвержденного инфицирования и гипоксически‑ишемического поражения) и дети с большинством врожденных мальформаций
3) При состояниях с неясным прогнозом, при пограничных показателях выживаемости решение о проведении реанимации должно приниматься родителями.
Среди детей, не имеющих при рождении и на протяжении 10 минут после рождения признаков жизни, уровень смертности и развития тяжелых неврологических нарушений очень высок. Если на протяжении 10 минут после рождения у ребенка не выслушиваются сердцебиения, реанимационные мероприятия стоит прекратить. Решение о продолжении реанимационных мероприятий при отсутствии сердцебиений более 10 минут должно быть комплексным, основанным на таких моментах, как предполагаемая причина отсутствия сердечной деятельности, срок гестации ребенка, потенциальная обратимость ситуации, а также мнение родителей.
Если при рождении ЧСС менее 60 в 1 мин и сохраняется на этом уровне 10–15 минут, то ситуация еще менее ясная и невозможно дать какие‑либо рекомендации.
Приложение 2 Стратегия определения смерти мозга у младенцев и детей
Усовершенствованные рекомендации экспертов 1987 года Американская академия педиатрии (2011 год)
(http://pediatrics.aappublications.Org/content/128/3/e720.long)
Nakagawa Т. A., Ashwal S., Mathur М, Mysore М., the Society of Critical Care Medicine, Section on Critical Care and Section on Neurology of the American Academy of Pediatrics, and the Child Neurology Society
В 1987 году были изданы рекомендации по определению смерти мозга у младенцев и детей, созданные международной комиссией. Они создавались в связи с отсутствием адекватных критериев смерти головного мозга у детей по заказу Комиссии при президенте. Рекомендации уделяли большое значение данным анамнеза и объективного обследования для определения этиологии комы, таким образом исключались корректируемые или обратимые изменения ЦНС. К тому же были введены различные периоды наблюдения, зависящие от возраста, а также были рекомендованы специальные нейродиагностические тесты для детей 1‑го года жизни. У детей старше 1 года было рекомендовано определять смерть мозга на основании лишь клинических данных, а лабораторные исследования являются дополнительными. Небольшое количество рекомендаций давалось по определению смерти мозга у новорожденных до 7 дней жизни, что объяснялось недостаточностью клинического опыта и достоверных данных. Те рекомендации являлись общепризнанными и использовались в клинической практике, однако с момента публикации они не дополнялись и не изменялись. Несколько важных недостатков было выявлено в той стратегии:
1) ограниченный объем клинической информации на момент публикации;
2) сомнительная чувствительность и специфичность используемых вспомогательных тестов;
3) биологическое обоснование при использовании возрастных критериев;
4) малое количество информации о том, как и когда диагноз смерти мозга может быть поставлен у новорожденных.
Все эти недостатки привели к тому, что, несмотря на существование национальных и юридических рекомендаций, стандартизованный подход к диагностике смерти мозга у детей отсутствовал. Данная ситуация касается не только определения критериев смерти мозга в педиатрической практике. Американская академия неврологии опубликовала стратегию определения смерти мозга у взрослых в 1995 году, в 2010 году вышла ее дополненная версия. Также критерии определения смерти мозга у детей и взрослых были опубликованы в Канаде.
Общество интенсивной терапии и реанимации (SCCM), а также отделения интенсивной терапии и реанимации и отделение неврологии Американской педиатрической академии в содружестве с Обществом детской неврологии, сформировали мультидисциплинарный комитет под покровительством Американской коллегии интенсивной терапии и реанимации для пересмотра руководства, созданного в 1987 году. Целью данной группы было провести анализ литературных данных и создать улучшенные рекомендации, касающиеся диагностики смерти мозга у новорожденных, младенцев и детей старшего возраста. Также необходимо было создать стандартизованную форму, позволяющую документировать смерть мозга. Однородность подхода в определении смерти мозга должна позволить врачам гарантировать, что все компоненты экспертизы у детей выполнены и соответствующим образом зарегистрированы.
В таблицах 2.1–2.3 представлены обновленные рекомендации данного комитета, классификационная система, клинические и неврологические критерии смерти мозга. В приложениях 2.1–2.7 представлена дополнительная информация, касающаяся диагностики смерти мозга у детей. Приложение 2.1 и приложение 2.2 (фармакологические данные о временном интервале тестирования после прекращения введения какого‑либо препарата)
|
|
|

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!