Цель работы. экспериментально определить коэффициент Пуассона для воздуха и сравнить полученное значение с теоретическим.
Приборы и принадлежности
1. Закрытый баллон с краном.
2. Водяной манометр.
3. Ручной насос.
Краткая теория
Системой тел или просто системой называется совокупность рассматриваемых тел или частиц. Некоторое количество газа, состоящего из определенного числа молекул (частиц), представляет собой термодинамическую систему.
Всякая система может находиться в различных состояниях, характеризующихся определенными параметрами. Основными параметрами, однозначно определяющими состояние газа, являются: объем  , давление
, давление  , температура
, температура  . Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона:
. Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона:
 ,
,
где R = 8,31  - универсальная газовая постоянная,
- универсальная газовая постоянная,  - число молей газа, которое в данном случае параметром не является, так как определенно задано.
- число молей газа, которое в данном случае параметром не является, так как определенно задано.
Равновесным называется такое состояние системы, при котором:
a) параметры во всех точках системы с течением времени не меняются;
b) нет внешних воздействий, которые поддерживали бы эти параметры неизменными.
Если хотя бы одно из этих условий не выполняется, то состояние системы является неравновесным.
Графически равновесное состояние системы можно изобразить точкой, отложив по осям координат значения двух параметров (третий параметр однозначно определяется из уравнения состояния).
Термодинамическим процессом называется изменение состояния рассматриваемой системы, например, данного количества газа  , характеризующееся изменением ее параметров. Процесс, состоящий из совокупности последовательных равновесных состояний, называется равновесным.
, характеризующееся изменением ее параметров. Процесс, состоящий из совокупности последовательных равновесных состояний, называется равновесным.
Известны следующие равновесные процессы.
1. Изохорический процесс ( ). Уравнение
). Уравнение  = const.
= const.
2. Изобарический процесс ( ). Уравнение
). Уравнение  = const.
= const.
3. Изотермический процесс (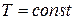 ). Уравнение
). Уравнение 
4. Адиабатический процесс – процесс, протекающий без теплообмена с внешней средой, (при этом процессе энтропия  , изоэнтропийный процесс). Уравнение
, изоэнтропийный процесс). Уравнение  Пуассона pV
Пуассона pV  = const.
= const.
Эти процессы можно графически изобразить на диаграммах непрерывными линиями, которые соответственно называют изохорой, изобарой, изотермой, адиабатой. Равновесные процессы являются обратимыми, так как их можно провести в обратном направлении через те же промежуточные состояния системы, что и при прямом ходе.
Одним из фундаментальных законов термодинамики есть закон сохранения энергии с учетом механической и тепловой энергии. Такая общая формулировка закона сохранения энергии называется первым законом (началом) термодинамики:
 .
.
Количество теплоты 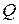 , сообщенное системе, идет на изменение (увеличение) ее внутренней энергии
, сообщенное системе, идет на изменение (увеличение) ее внутренней энергии  и на совершение системой работы
и на совершение системой работы  над внешними силами.
над внешними силами.
Внутренняя энергия идеального газа определяется суммарной кинетической энергией поступательного и вращательного движений составляющих его молекул:
 ,
,
где  - число степеней свободы молекул газа.
- число степеней свободы молекул газа.
Напомним, что числом степеней свободы 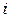 молекулы называется наименьшее число независимых координат, определяющих положение молекулы в пространстве, или число независимых движений, которые может совершать молекула. Для одноатомной молекулы
молекулы называется наименьшее число независимых координат, определяющих положение молекулы в пространстве, или число независимых движений, которые может совершать молекула. Для одноатомной молекулы  (три степени свободы поступательного движения), для двухатомной жесткой молекулы
(три степени свободы поступательного движения), для двухатомной жесткой молекулы  (три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы
(три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы  (три поступательные и три вращательные степени свободы).
(три поступательные и три вращательные степени свободы).
Для характеристики тепловых свойств газа (тела) пользуются физической величиной, называемой теплоемкостью (удельной  и молярной
и молярной  ).
).
Удельная теплоемкость  - это физическая величина, численно равная количеству теплоты, необходимого для нагревания единицы массы вещества на один Кельвин:
- это физическая величина, численно равная количеству теплоты, необходимого для нагревания единицы массы вещества на один Кельвин:
 ,
,
где  - масса вещества,
- масса вещества,  .
.
Молярная теплоемкость  - это физическая величина, численно равная количеству теплоты, необходимого для нагревания одного моля вещества на один Кельвин:
- это физическая величина, численно равная количеству теплоты, необходимого для нагревания одного моля вещества на один Кельвин:
 ,
,
где  - число молей вещества, [
- число молей вещества, [  ] =
] =  .
.
Между удельной  и молярной
и молярной  теплоемкостями существует очевидная связь
теплоемкостями существует очевидная связь
 ,
,
где  - молярная масса данного вещества (
- молярная масса данного вещества ( ).
).
Поскольку количество теплоты 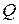 зависит от процесса, то для газов различают теплоемкости в зависимости от того, как идет нагревание: при постоянном объеме (
зависит от процесса, то для газов различают теплоемкости в зависимости от того, как идет нагревание: при постоянном объеме ( ) или при постоянном давлении (
) или при постоянном давлении (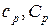 ).
).
Применяя первый закон термодинамики к изохорическому и изобарическому процессам и учитывая определение молярной теплоемкости, получим значения:
 ,
,  - формула Майера,
- формула Майера,
или  .
.
Отношение теплоемкостей при постоянном давлении и при постоянном объеме:

Эта величина называется коэффициентом Пуассона, или показателем адиабаты, так как входит в уравнение адиабатического процесса (уравнение Пуассона):
 .
.



 , давление
, давление  , температура
, температура  . Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона:
. Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона: ,
, - универсальная газовая постоянная,
- универсальная газовая постоянная,  - число молей газа, которое в данном случае параметром не является, так как определенно задано.
- число молей газа, которое в данном случае параметром не является, так как определенно задано. ). Уравнение
). Уравнение  = const.
= const. ). Уравнение
). Уравнение  = const.
= const.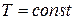 ). Уравнение
). Уравнение 
 , изоэнтропийный процесс). Уравнение
, изоэнтропийный процесс). Уравнение  Пуассона pV
Пуассона pV  = const.
= const. .
.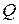 , сообщенное системе, идет на изменение (увеличение) ее внутренней энергии
, сообщенное системе, идет на изменение (увеличение) ее внутренней энергии  и на совершение системой работы
и на совершение системой работы  над внешними силами.
над внешними силами. ,
, - число степеней свободы молекул газа.
- число степеней свободы молекул газа.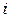 молекулы называется наименьшее число независимых координат, определяющих положение молекулы в пространстве, или число независимых движений, которые может совершать молекула. Для одноатомной молекулы
молекулы называется наименьшее число независимых координат, определяющих положение молекулы в пространстве, или число независимых движений, которые может совершать молекула. Для одноатомной молекулы  (три степени свободы поступательного движения), для двухатомной жесткой молекулы
(три степени свободы поступательного движения), для двухатомной жесткой молекулы  (три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы
(три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы  (три поступательные и три вращательные степени свободы).
(три поступательные и три вращательные степени свободы). и молярной
и молярной  ).
). ,
, - масса вещества,
- масса вещества,  .
. ,
, - число молей вещества, [
- число молей вещества, [  ] =
] =  .
. ,
, - молярная масса данного вещества (
- молярная масса данного вещества ( ).
). ) или при постоянном давлении (
) или при постоянном давлении (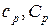 ).
). ,
,  - формула Майера,
- формула Майера, .
.
 .
.

