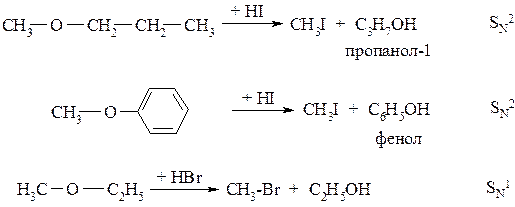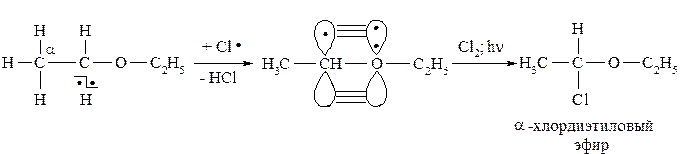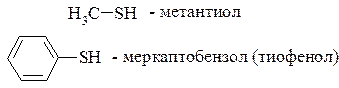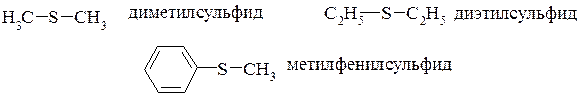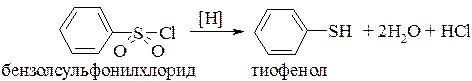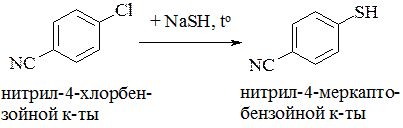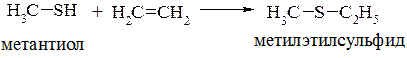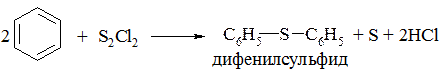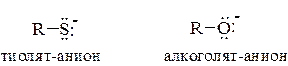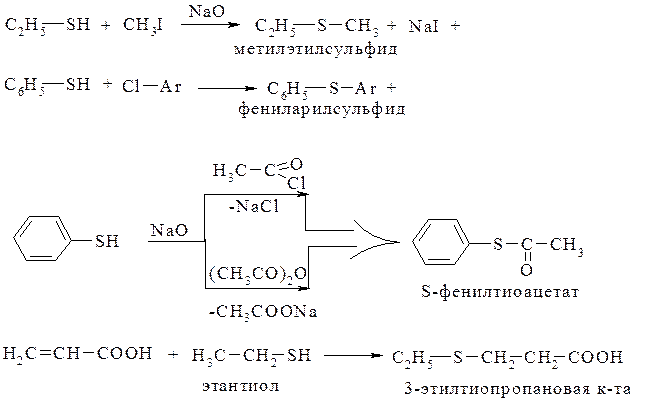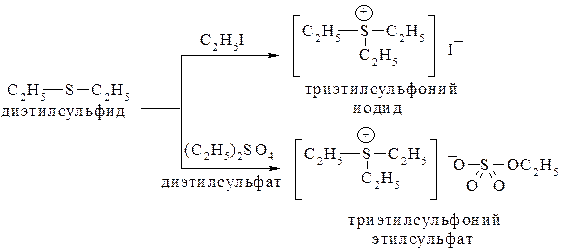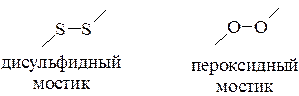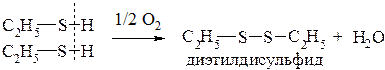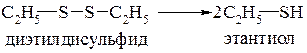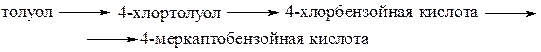Следовательно, они соответствуют общей формуле R–O–R1, в которой атом кислорода связан с двумя углеводородными остатками.
По заместительной номенклатуре к названию углеводорода, соответствующего наиболее длинной углеродной цепи, прибавляют в качестве префикса название алкоксигруппы (группа атомов R–O) или для эфиров фенолов – название арилоксигруппы (Ar–O):
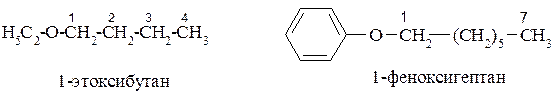
По радикально-функциональной номенклатуре после перечисления названия радикалов в алфавитном поряжке называют слово эфир:

Для эфиров помимо изомерии, обусловленной строением цепи углеводородных остатков, встречается другая разновидность структурной изомерии – метамерия: метамеры – это соединения, отвечающие одной общей формуле, но отличающиеся между собой радикалами, связанными с одинаковым атомом или группой атомов. Например, два простых эфира – диэтиловый и метилпропиловый эфир являются метамерами, поскольку отвечают одной общей формуле – С4Н10О, но различаются радикалами, связанными с атомом кислорода:
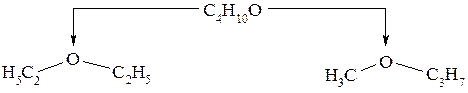
К простым эфирам можно относить и циклические соединения, содержащие гетероатом (или гетероатомы) кислорода:

Способы получения
Кислотно-катализируемый метод. Эфиры с двумя одинаковыми радикалами – симметричные эфиры – удобно получать путём межмолекулярной дегидратации в присутствии серной кислоты как водоотнимающего средства. По этому методу спирт берут в избытке. Таким способом получают диэтиловый эфир:

Из алкоголятов и алкилгалогенидов (синтез Вильямсона) (см. разд. 13.3.2. и 12.3.2.).
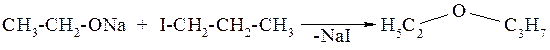
Из алкоголятов (фенолятов) действием диалкилсульфатов:

Присоединением алкенов (или алкинов) к спиртам и фенолам (по правилу Марковникова):
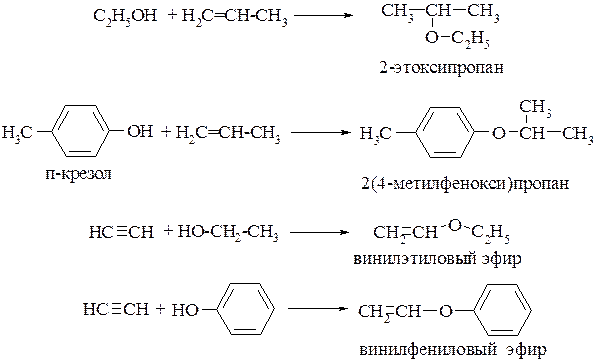
Физические свойства
Диметиловый и метилэтиловый эфиры в обычных условиях – газы. Начиная с диэтилового эфира и далее по мере увеличения молекулярной массы вещества представляют собой легколетучие жидкости с характерным запахом.
Температуры кипения простых эфиров гораздо ниже, чем у соответствующих спиртов. Объясняется это отсутствием межмолекулярных водородных связей. Простые эфиры по-разному растворимы в воде: растворимость диэтилового эфира составляет 7,5 г на 100 г воды, а диметиловый эфир и тетрагидрофуран хорошо смешиваются с водой.
Химические свойства
Анализ значений валентных углов С–О–С в простых эфирах свидетельствует о том, что в диалкиловых эфирах он приближается к тетраэдрическому и равен 109-112о.
В алкилариловых и диариловых эфирах валентный угол близок к 120о. По этой причине дипольные моменты связей С–О–С не компенсируют друг друга (молекула не линейная). Алкильные радикалы проявляют +I-эффект, благодаря чему связь С–О полярна. Длина связи С–О несколько меньше, чем С–С в алканах. Простые эфиры обладают более сильными электронодонорными свойствами, чем спирты, что объясняется влиянием двух алкильных радикалов (+I-эффект).
Основные свойства
На атоме кислорода имеются неподелённые пары электронов, поэтому эфиры могут проявлять свойства жёстких оснований (согласно определению Льюиса). В то же время нуклеофильность этого реакционного центра повышена из-за влияния алкильных радикалов.
Все эти особенности строения свидетельствуют о том, что простые эфиры способны в присутствии сильных кислот (серная, хлороводородная и т.д.) протонироваться с образованием солей оксония:

Такие оксониевые соединения представляют собой соли слабого основания – эфира и сильной кислоты и поэтому гидролизуются при разбавлении водой с выделением эфира.
Кислоты Льюиса, например, BF3, SnCl4, ZnCl2, MgCl2 с простыми эфирами образуют так называемые эфираты, которые по сути представляют собой оксониевые соединения. Они отличаются значительной устойчивостью:
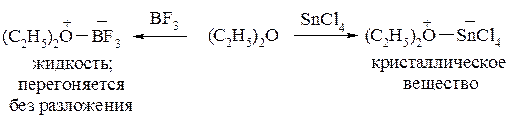
В эфиратах связь между атомом кислорода и кислотой Льюиса осуществляется за счёт неподелённой пары электронов кислорода, т.е. по донорно-акцепторному механизму.
Расщепление простых эфиров
Расщепление простой эфирной связи можно осуществить, если алкоксигруппу превратить в легко уходящую группу. Такое преобразование осуществляется путём перевода простых эфиров в оксониевые соединения под действием галогеноводорода. Галогенид-анион является нуклеофилом, атакующим α-углеродый атом. Уходящей группой является спирт.
Под действие галогеноводородных кислот эфирная связь легче всех разрывается под влиянием HI, поскольку нуклеофильность йодид аниона:I - наибольшая среди всех галогенид-анионов (I - > Br - > Cl - > F -).
Концентрированная йодистоводородная кислота разлагает простой эфир на холоду с образованием алкилйодида и спирта:
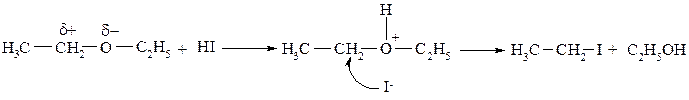 Расщепление простых эфиров под действием галогеноводородов может протекать как по SN2, так и по SN1 механизмам. По механизму реакции можно определить с участием какого алкильного радикала образуется галогеналкан, и какого – спирт (или фенол):
Расщепление простых эфиров под действием галогеноводородов может протекать как по SN2, так и по SN1 механизмам. По механизму реакции можно определить с участием какого алкильного радикала образуется галогеналкан, и какого – спирт (или фенол):
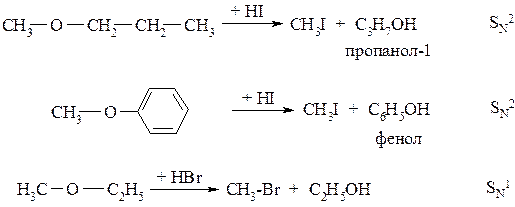
Концентрированная серная кислота разлагает простые эфиры либо до диалкилсульфата, либо до алкилсерной кислоты и спирта:

Металлический натрий при нагревании разлагает простые эфиры (реакция Шорыгина) с образованием алкоголята натрия и алкилнатрия:

14.3.3. Реакции по α-положению
В простых эфирах атом водорода в α-положении может замещаться по радикальному механизму. У образующегося свободного радикала орбиталь с неспаренным электроном взаимодействует с одной из двух несвязывающих р -орбиталей атома кислорода, заселённой парой электронов. Такая делокализация приводит к тому, что возникает выгодная электронная конфигурация, при которой три электрона распределены между двумя атомами – α-углеродным атомом и кислородом:
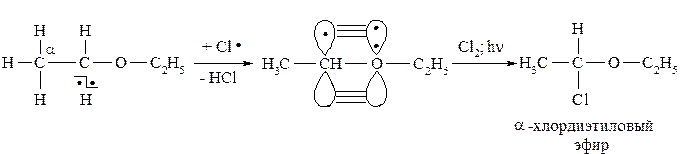
α-Положение простых эфиров легко окисляется по свободнорадикальному механизму замещения. Окисление легко происходит даже кислородом воздуха на свету. Продуктами реакции являются гидропероксиды, которые токсичны и взрывоопасны. Особенно легко гидропероксиды образует диизопропиловый эфир:

14.4. Оксираны (эпоксиды, α-оксиды)
Для трёхчленных циклических эфиров более целесообразно использовать название оксираны, поскольку это соответствует номенклатуре гетероциклических соединений.
Их ещё называют эпоксидами. Для простейших соединений сохраняются названия этиленоксид и пропиленоксид:

Получают оксираны из галогенгидринов действием оснований:

Оксиран является очень реакционоспособным соединением, взаимодействующим как с электрофильными, так и нуклеофильными реагентами:

Отдельные представители
Диэтиловый эфир Н5С2–О–С2Н5. Очень подвижная, летучая жидкость с сильным характерным запахом. Кипит при температуре 35о; температура воспламенения 160-165о. Пары эфира тяжелее воздуха в 2,5 раза. При работе с диэтиловым эфиром надо учитывать все его свойства: способность легко взрываться; при длительном контакте вызывать признаки сонливости; при хранении на свету окисляться с образованием токсических и взрывоопасных гидропероксидов. Перегонять эфир можно только на водяной бане. Используемый для медицинских целей «наркозный» эфир должен быть идеально очищенным от примесей и особенно от гидропероксидов.
Диглим СH3OCH2CH2O CH2CH2O СH3 (диметиловый эфир диэтиленгликоля, 2,2’-диметоксидиэтиловый эфир). Является хорошим растворителем и характеризуется высокой сольватирующей способностью по отношению к ионам металлов, что объясняется донорным эффектом трех атомов кислорода одновременно. Находит широкое применение в аналитической химии.
Вопросы для самоподготовки
1. Напишите формулы: этиленоксида; анизола; 2-метоксипентана; орто-крезола; 1-этоксибутана; гексанола-2. Какие из этих веществ являются изомерами, а какие относятся к простым эфирам?
2. Какие исходные вещества следует взять, чтобы получить: 1-этоксибутанол; анизол; 1,4- диоксан. Назовите исходные вещества.
3. Используя в качестве исходных веществ ацетилен и фенол получите винилфениловый эфир, а из него фенилэтиловый эфир.
4. Приведите уравнения реакций, по которым из этиленхлоргидрина (2-хлорэтанола) можно получить этиленгликоль, акрилонитрил и коламин.
5. Охарактеризуйте отношение диэтилого, фенилэтилого и дифенилового эфиров к кислотному и щелочному гидролизу.
6. Заполните схему и назовите все вещества.
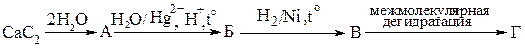
Глава 15. Тиолы и сульфиды
Из многочисленных групп сераорганических соединений, в молекулах которых атом углерода связан с атомом серы*, в данной главе будут рассмотрены тиолы и дисульфиды.
Тиолы (меркаптаны) – соединения, в которых углеводородный радикал связан с гидросульфидной группой –SH, называемой меркаптогруппой. Общая формула тиолов R–SH, где R – радикал алифатического или ароматического ряда. Алифатические тиолы иначе называются тиоспиртами, а ароматические – тиофенолами.
Сульфиды органические (тиоэфиры) – соединения общей формулы R–S–R1, которые можно рассматривать как производные сероводорода, в молекуле которого оба атома водорода замещены на углеводородные радикалы. Их следует считать серными аналогами простых эфиров.
Номенклатура тиолов аналогична номенклатуре гидроксипроизводных углеводородов, только вместо суффикса ол используют тиол, или вместо префикса гидрокси применяется префикс меркапто, но только в тех случаях, когда группа SH представляется в качестве заместителя:
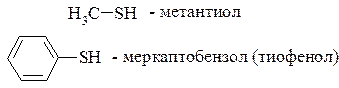
Номенклатура ИЮПАК не рекомендует использование названий меркаптаны, тиоспирты, тиофенолы. По радикально-функциональной номенклатуре в названиях сульфидов вначале перечисляют радикалы, а затем добавляется слово сульфид, которое пишется слитно:
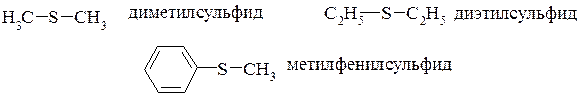
Название тиоэфир номенклатурой ИЮПАК также не рекомендуется.
Способы получения
В качестве препаративных методов используют взаимодействие сероводорода с алкенами, алкилбромидами и спиртами:

В реакциях с галогеналканами вместо сероводорода можно использовать гидросульфид натрия, что уменьшает протекание побочных реакций:

Ароматические тиолы можно получить восстановлением аренсульфонилхлоридов:
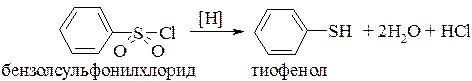
или взаимодействием галогенаренов с гидросульфидом натрия (калия). Замещение галогена на группу SH проходит значительно легче, если в ароматическом ядре содержатся электроноакцепторные заместители:
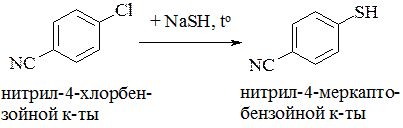
Традиционными методами получения сульфидов являются реакции алкилирования (или арилирования) с использованием сульфидов щелочных металлов. Из алкилгалогенидов образуются симметричные сульфиды:

Несимметричные сульфиды можно получить присоединением тиолов к алкенам (или алкинам):
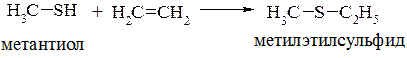
Для получения диарилсульфидов используют реакцию галогенидов серы с аренами в присутствии кислот Льюиса:
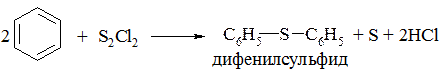
Физические свойства
В обычных условиях метантиол – газ, а его гомологи представляют собой жидкости, кипящие при температурах выше 35оС. Все тиолы и сульфиды характеризуются неприятным запахом. Тиолы и сульфиды плохо растворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Сера как элемент подгруппы кислорода является его электронным аналогом. Валентный угол в воде составляет 104,5о, а валентный угол в сероводороде составляет 92,2о. В спиртах валентный угол С–О–Н равен примерно ~109о, а в тиолах валентный угол С–S–H составляет 100 – 104о. Энергия связей Н–О 460 кДж/моль, а С–ОН 344кДж/моль. Энергия связей S–H и C–SH соответственно равны 339 кДж/моль и 260 кДж/моль. Полярность связи S–H значительно ниже, чем связи O–H. По сравнению со спиртами тиолы являются более сильными электронодонорами; межмолекулярные водородные связи у тиолов слабее, поэтому у них температуры кипения ниже, чем у спиртов.
Кислотные свойства
Кислотные свойства тиолов обусловлены ионизацией связи S–H. По сравнению со спиртами тиолы являются значительно более сильными кислотами и это объясняется особенностью строения тиолят-аниона, в котором отрицательный заряд делокализован в большей степени, чем в алкоголят-анионе.
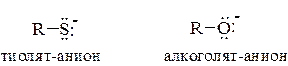
При взаимодействии с щелочами они образуют растворимые в воде тиоляты:

С катионами тяжелых металлов тиолы образуют нерастворимые тиоляты, которые, по сути, представляют собой соли ковалентного характера. С точки зрения принципа ЖМКО Пирсона тиолят-анион является «мягким» основанием, а катион ртути (II) – мягкой кислотой:

Нуклеофильные свойства
Тиолы и особенно тиолят-анионы являются более сильными нуклеофилами по сравнению с соответствующими алкоксид-анионами, что объясняется высокой поляризуемостью атома серы.
Тиолы и сульфиды как нуклеофилы проявляют высокую реакционную способность, вступая в реакции алкилирования (арилирования), ацилирования и присоединения:
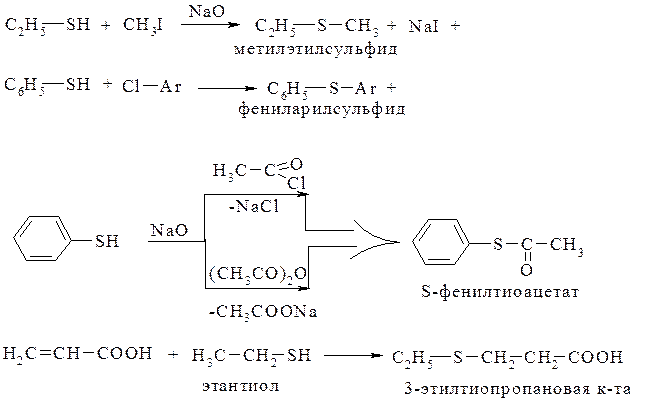
Сульфиды, будучи сильными нуклеофилами, способны взаимодействовать с алкилирующими реагентами с образованием устойчивых сульфониевых солей:
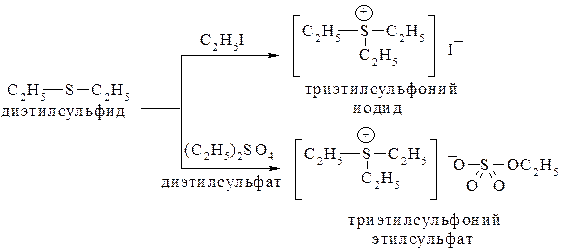
Окисление
Как тиолы, так и сульфиды способны окисляться и в зависимости от условий образуются разные продуты реакции:
в мягких условиях (кислород воздуха, гидроксиламин или йод) из тиолов образуются замещенные дисульфиды, содержащие дисульфидный мостик, являющийся аналогом пероксидного мостика.
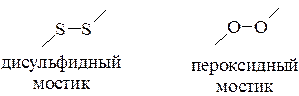
В отличие от органических пероксидов дисульфидная связь более прочная:
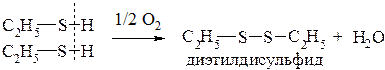
под действием более сильных окислителей из тиолов образуются соответствующие сульфоновые кислоты, а из сульфидов – сульфоксиды:

Восстановление
Применение каталитического гидрирования позволяет восстановить тиолы до соответствующих углеводородов:

Из дисульфидов в этом случае образуются тиолы:
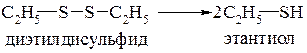
Вопросы для самоподготовки
1. Дайте определение следующим классам соединений: тиолы, сульфиды, дисульфиды. Приведите примеры соединенйи каждого ряда
2. Какие тиолы и спирты можно получить из углеводородов состава С4H8? Объясните, почему тиолы проявляют более выраженные кислотные свойства?
3. Запишите уравнениями реакций следующие превращения. 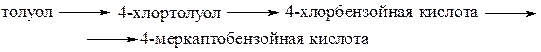
4. Объясните причину нуклеофильности тиолов? Сравните нуклеофильного свойства 2,4 –динитрофенола; n-(трет-бутил)-тиофенола, тиофенола.
5. Предложите реакции получения диэтилсульфида и охарактеризуйте его химические свойства.






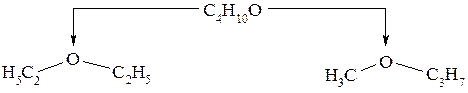


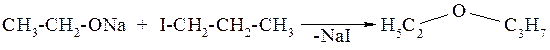

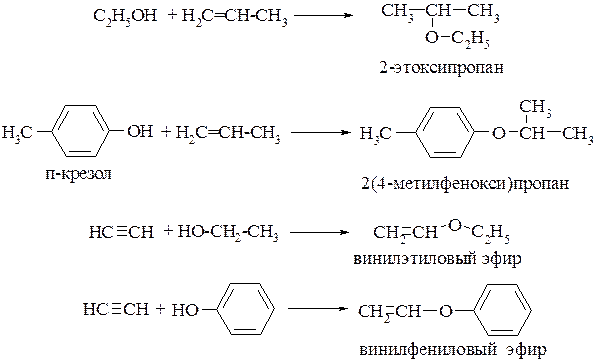

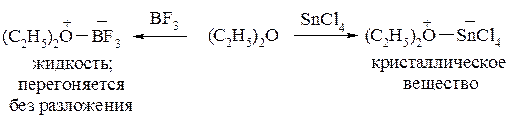
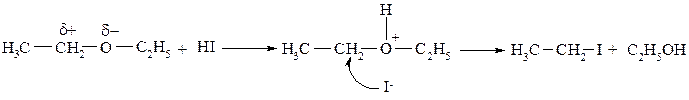 Расщепление простых эфиров под действием галогеноводородов может протекать как по SN2, так и по SN1 механизмам. По механизму реакции можно определить с участием какого алкильного радикала образуется галогеналкан, и какого – спирт (или фенол):
Расщепление простых эфиров под действием галогеноводородов может протекать как по SN2, так и по SN1 механизмам. По механизму реакции можно определить с участием какого алкильного радикала образуется галогеналкан, и какого – спирт (или фенол):