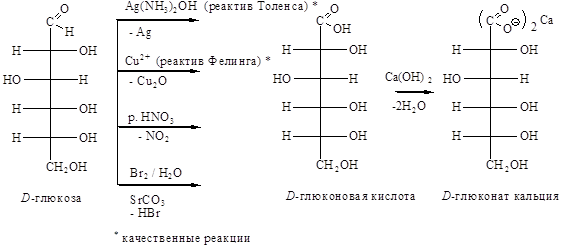Дезоксисахара – моносахариды, содержащие в молекуле один или несколько атомов водорода вместо гидроксильных групп, например, D-дезоксирибоза.
Аминосахара – образуются на основе моносахаридов, в молекулах которых OH-группа второго звена замещена аминогруппой - NH2, например, D-глюкозамин, D-галактозамин, D-маннозамин.В водном растворе они находятся в циклической форме: 2-амино-2-дезокси-D-глюкопираноза, 2-амино-2-дезокси-D-галактопираноза, 2-амино-2-дезокси-D-маннопираноза.

Аминогруппа часто ацилирована остатком уксусной кислоты, при этом образуется амидная группировка: -NH-CO-, например, N-ацетил-D-глюкозамин (2-ацетамидо-2-дезокси-D-глюкопираноза).

Аминосахара входят в состав групповых веществ крови, определяя их специфичность, и являются компонентами структурных полисахаридов.
Сахарные кислоты - образуются окислением первичной гидроксильной группы моносахарида. Например, при окислении первичной гидроксильной группы глюкозы в шестом углеродном звене образуется D-глюкуроновая кислота.
Глюкуроновая кислота является структурным компонентом полисахаридов. Самостоятельно участвует в обезвреживании токсических веществ, образуя с ними водорастворимые глюкурониды, и выводит их с мочой.
Выведение салициловой кислоты из организма в процессе воздействия лекарственных веществ происходит в виде О-глюкуронида, образующегося в результате взаимодействия полуацетатного гидроксила β-глюкуроновой кислоты и фенольного гидроксила салициловой кислоты.
Контрольные вопросы
1. Углеводы. Классификация по способности к гидролизу.
2. Моносахариды. Альдопентозы. Альдогексозы. Кетогексозы. Строение. Изомерия. Понятие об эпимерах.
3. Кольчато-цепная таутомерия моносахаридов. Аномеры.
4. Химические свойства моносахаридов: свойства многоатомных спиртов; реакции окисления и восстановления; свойства полуацеталей; реакция этерификации.
5. Строение производных моносахаридов. Дезоксисахара. Аминосахара.
Типовые задания
Задание 1. Приведите для α-D-глюкопиранозы строение ее диастереомеров: аномера, энантиомера, эпимера по С-2 и эпимера по С-4.
Решение: α-D-Глюкопираноза—представитель гексоз. В молекуле гексозы содержится несколько хиральных центров, поэтому она существует в виде большого числа стереоизомеров.
Известно, что в простейшем случае, когда молекула содержит только один хиральный центр (глицериновый альдегид, молочная кислота), она существует в виде пары энантиомеров, относящихся друг к другу как несовместимые в пространстве предмет и его зеркальное изображение.
При наличии в молекуле двух хиральных центров появляется возможность существования диастереомеров, различающихся конфигурацией одного хирального центра. По мере возрастания в молекуле числа хиральных центров увеличивается общее число диастереомеров с различной конфигурацией одного или нескольких хиральных центров.
В химии моносахаридов диастереомеры, различающиеся конфигурацией только одного углеродного атома, называются эпимерами. При этом, если речь идет о различии в конфигурации гликозидного (аномерного) атома углерода, то тогда диастереомеры называются аномерами. У альдоз таким углеродным атомом является С-1, у кетоз — С-2. Аномеры являются частным случаем эпимеров.
Этап 1. Из приведенного в условии задачи названия соединения видно, что молекула D-глюкозы находится в шестичленной циклической (пиранозной) форме в виде α-аномера.
В α-аномере D-глюкопиранозы атом углерода С-1 имеет конфигурацию, совпадающую с конфигурацией ее «концевого» хирального центра С-5, т.е. атома, определяющего принадлежность к стереохимическому ряду. При написании стереохимических формул углеводов конфигурация С-1 в α-аномере изображается таким образом, что полуацетальная гидроксильная группа в формуле Хеуорса располагается под плоскостью пиранозного цикла, в конформационной формуле занимает аксиальное положение.
Другой аномер D-глюкопиранозы (β-аномер) отличается от рассмотренного α-аномера противоположной конфигурацией хирального атома углерода С-1. Соответственно полуацетальная гидроксильная группа у β-аномера располагается над плоскостью пиранозного цикла в формуле Хеуорса и занимает экваториальное положение в конформационной формуле:


Этап 2. α-D-Глюкопираноза является одним из двух энантиомеров, а именно энантиомером, относящимся к D-стереохимическому ряду. Принадлежность к D-ряду означает, что конфигурация наиболее удаленного от оксогруппы асимметрического (хирального) атома углерода совпадает с конфигурацией хирального центра D-глицеринового альдегида (конфигурационный стандарт).
Другой энантиомер представляет собой зеркальное изображение молекулы α-D-глюкопиранозы и относится к L-стереохимическому ряду. У L-глюкозы конфигурация хиральных атомов С-2, С-3, С-4, С-5 противоположна конфигурации этих атомов у D-глюкозы. Запишем строение энантиомеров глюкозы в открытой форме:

В циклической (пиранозной) форме у того и другого энантиомера возникает дополнительный центр хиральности — аномерный атом углерода С-1. Тогда α-аномеру D-глюкопиранозы будет соответствовать энантиомер L-ряда, имеющий противоположную конфигурацию всех центров хиральности, включая С-1. Исходя из этого условия, полуацетальная ОН-группа энантиомера L-ряда должна располагаться в формуле Хеуорса над плоскостью пиранозного цикла. В этом случае конфигурация аномерного атома углерода С-1 в молекуле L-глюкопиранозы совпадает с конфигурацией ее хирального центра С-5, определяющего принадлежность к стереохимическому ряду, т.е. энантиомер находится в α-форме. Следовательно, энантиомером по отношению к α-D-глюкопиранозе является β-L-глюкопираноза.
Этап 3. Эпимером D-глюкозы, отличающимся от нее конфигурацией С-2, является D-манноза, а эпимером, отличающимся конфигурацией С-4 — D-галактоза:

Исходя из того, что эпимеры различаются конфигурацией только одного хирального атома углерода, D-манноза и D-галактоза в циклической форме должны отличаться от D-глюкозы конфигурацией С-2 и С-4 соответственно, а конфигурация возникающего при циклизации хирального атома углерода С-1 должна быть одинаковой у всех трех эпимеров. Таким образом, по отношению к α-D-глюкопиранозе эпимером по С-2 является α-D-маннопираноза, а эпимером по С-4 — α-D-галактопираноза:


Заключение. Соотношение между приведенными выше стереоизомерами α-D-глюкопиранозы можно представить в виде следующей схемы:


 Энантиомеры α,L-Глюкопираноза
Энантиомеры α,L-Глюкопираноза



 по С1 (аномеры) β,D-Глюкопираноза
по С1 (аномеры) β,D-Глюкопираноза




 α,D-Глюкопираноза Эпимеры по С2 α,D-Маннопираноза
α,D-Глюкопираноза Эпимеры по С2 α,D-Маннопираноза

 по С4 α,D-Галактопираноза
по С4 α,D-Галактопираноза

 Диастереомеры
Диастереомеры
Задание 2. Какие биологически важные продукты могут быть получены при окислении D-глюкозы в различных условиях?
Решение. D-Глюкоза — гетерофункциональное соединение, содержащее одновременно гидроксильные и альдегидную функциональные группы. Обе группы, особенно альдегидная, способны окисляться, и результатом окисления является превращение их в карбоксильную группу.
Этап 1. При окислении в нейтральной или слабокислой среде молекула D-глюкозы не подвергается деструкции. В качестве окислителя используется раствор брома в воде, реактив Толленса или свежеприготовленный гидроксид меди (II) при нагревании.
В общем виде реакция может быть представлена как избирательное окисление альдегидной группы в карбоксильную без затрагивания гидроксильных групп:
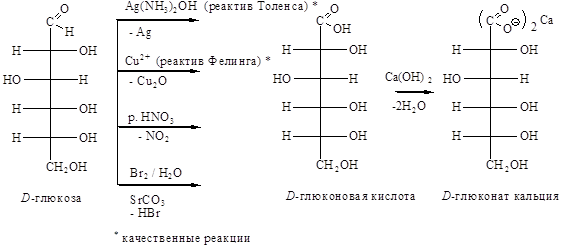
В медицине используется кальциевая соль глюконовой кислоты (кальция глюконат).
Этап 2. В сильнокислой среде в молекуле D-глюкозы окисляется не только альдегидная, но и первичноспиртовая группа. При этом образуется двухосновная D-глюкаровая кислота. Как правило, в качестве окислителя используется азотная кислота.

D -глюкоза D -глюкаровая кислота
Этап 3. Можно представить еще один случай окисления концевых углеродных атомов D-глюкозы, когда альдегидная группа сохраняется, а окисляется только первичноспиртовая группа. При этом получается D-глюкуроновая кислота.
D-Глюкуроновую кислоту нельзя получить прямым окислением D-глюкозы. Предварительно альдегидную группу D-глюкозы защищают превращением ее в гликозидную, и только потом окисляют первичноспиртовую группу:

Важная биологическая роль D-глюкуроновой кислоты состоит в том, что многие токсичные вещества выделяются с мочой в виде глюкуронидов (детоксикация).
Заключение. При окислении D-глюкозы в зависимости от условий можно получить D-глюконовую, D-глюкаровую и D-глюкуроновую кислоты.
Задание 3. В результате брожения D-глюкозы образовался продукт, который реагирует со щелочью только в мольном соотношении 1:1 и может подвергаться ацилированию. Предположите, какой вид брожения имел место и напишите схемы всех реакций.
Решение. Наиболее известные виды брожения D-глюкозы: спиртовое, молочнокислое, маслянокислое и лимоннокислое. Этанол не реагирует со щелочью, масляная кислота не подвергается ацилированию, а лимонная кислота реагирует со щелочью в соотношении 1:3. Следовательно, возможным продуктом брожения является молочная кислота:

Действительно, молочная кислота реагирует со щелочью в соотношении 1:1:

и может подвергаться ацилированию по гидроксильной группе:

Тестовые задания для самоконтроля
















 Энантиомеры α,L-Глюкопираноза
Энантиомеры α,L-Глюкопираноза

 по С1 (аномеры) β,D-Глюкопираноза
по С1 (аномеры) β,D-Глюкопираноза



 α,D-Глюкопираноза Эпимеры по С2 α,D-Маннопираноза
α,D-Глюкопираноза Эпимеры по С2 α,D-Маннопираноза





 Диастереомеры
Диастереомеры