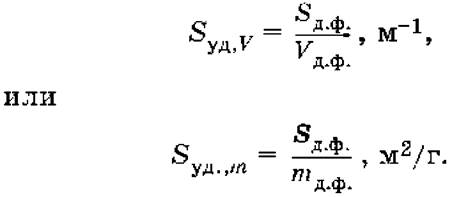Обменная адсорбция – процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого‑либо знака (катионы либо анионы) и вместо них может выделять в раствор эквивалентное число других ионов того же знака. Ввсегда специфична, т. е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима.
Правило Пакета‑Пескова‑Фаянса: на поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящих в состав кристалла, малорастворимое соединение.
Коллоидные (дисперсные) системы
Коллоидной (дисперсной) системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы. Это ультрамикрогетерогенные системы, состоящие из частиц дисперсной фазы – совокупности раздробленных частиц, размер которых лежит в пределах 10‑9‑10‑5 м, и непрерывной дисперсионной среды, в которой распределены эти частицы.
Признаки коллоидного состояния вещества – дисперсность и гетерогенность.
Степень дисперсности δ – величина, обратная среднему диаметру или, для несферических частиц, обратная среднему эквивалентному диаметру d (м‑1):

Удельная поверхность – отношение общей площади поверхности дисперсной фазы SДФ к ее общему объему или к ее массе:
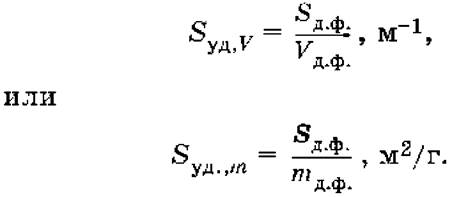
Классификация и способы получения дисперсных систем
Классификация по агрегатному состоянию фаз
| Агрегатное состояние дисперсной фазы
| Агрегатное состояние дисперсионной среды
| Условное обзначе-ние ф/с
| Название системы
| Примеры
|
|
| Ж
| Г
| Ж/Г
| аэрозоли
| туман
| |
| ТВ
| Г
| ТВ/Г
|
| дымы, пыли
|
|
| г
| Ж
| Г/Ж
| газовые
эмульсии, пены
| газированная вода, мыльная пена
|
|
| Ж
| Ж
| Ж/Ж
| эмульсии
| молоко, масло сливочное
| |
| ТВ
|
Ж
| ТВ/Ж
| лиозо-
ли, суспензии
| естественные водоемы, краски
|
|
| Г
| ТВ
| Г/ТВ
| твердые пены
| пемза, пенопласт, активированный уголь
|
|
| Ж
| ТВ
| Ж/ТВ
| твердые
эмульсии
| древесина
|
| ТВ
| ТВ
| ТВ/ТВ
| твердые золи
| драгоценные камни
|
| | | | | | | | | |
Дисперсной системы, у которой и дисперсная фаза, и дисперсионная среда являются газами, не существует, так как газы неограниченно растворимы друг в друге.
Классификация систем по размеру частиц дисперсной фазы:
1) высокодисперсные, 10‑9_10‑7 м (рубиновое стекло);
2) среднедисперсные, 10‑7_10‑5м (растворимый кофе);
3) грубодисперсные, > 10‑5м (капли дождя).
Способы получения коллоидных систем
Диспергирование
Физическое диспергирование: механическое измельчение с использованием коллоидных мельниц; электрическое распыление веществ; диспергирование ультразвуком и другие методы. Чтобы не дать образовавшимся частицам слипаться, диспергирование производят в присутствии стабилизатора – электролита или вещества, адсорбирующегося на границе раздела фаз (поверхностно‑активные вещества).
Химическое диспергирование (пептизация): перевод в коллоидное состояние свежеприготовленного осадка с помощью пептизатора.
Конденсация
Физическая конденсация: 1) метод замены растворителя, который заключается в том, что в истинный раствор вещества добавляется смешивающаяся с растворителем жидкость, в которой само вещество малорастворимо; вследствие понижения растворимости вещества в новом растворителе раствор становится пересыщенным, и часть вещества конденсируется, образуя частицы дисперсной фазы; 2) метод конденсации из паров; исходное вещество находится в паре; при понижении температуры пар становится пересыщенным и частично конденсируется, образуя дисперсную фазу.
Химическая конденсация: любая химическая реакция, в результате которой образуется плохо растворимое соединение; чтобы при этом получить коллоидный раствор, реакцию необходимо вести в разбавленном растворе при небольшой скорости роста частиц, одно из исходных веществ берется в избытке и является стабилизатором.