Цель и задачи работы: получить комплекс экспериментальных данных, характеризующих влияние ингибиторов на рост экспоненциально растущей культуры и определить тип ингибирования, используя зависимость Лайнуивера-Берка (1/µ= f(1/ S)).
Метод острых опытов изучает влияние ингибитора на поведение экспоненциально растущей культуры. Такого рода исследования позволяют выявить механизм ингибирования биосинтеза микробных полимеров и установить ингибирование синтеза конкретных биополимеров (белки микробной массы, липиды клетки, нуклеиновые кислоты и др.).
Для этого к экспоненциально растущей культуре добавляются различные дозы ингибитора и в течение 1,5-6 часов ведутся наблюдения за кинетикой роста в опыте и контроле.
Важно найти ту дозу (концентрацию) ингибитора, которая действует на наиболее чувствительное звено метаболизма (большие дозировки специфических ингибиторов могут действовать на несколько функций).
Также очень важна длительность опыта: чем она короче, тем точнее информация, т.к. повреждение одного звена метаболизма быстро отражается на многих других. Культивирование должно быть достаточно коротким для того, чтобы другие факторы среды, кроме добавленного ингибитора, не успели оказать своего действия.
Кроме того, в процессе исследований следят за выживаемостью неразмножающихся клеток в присутствии ингибитора.
Объекты исследования, оборудование, реактивы и посуда:
- посевной материал – суспензия дрожжей (р. Candida) 200-300 мл на полный эксперимент;
- перемешивающее устройство (качалка) – 2, 4, 6 шт.;
- весы – 2 шт.;
- фотоэлектроколориметр (2 шт.) и кюветы (на 5 мл);
- качалочные колбы (9 шт. на одну качалку) объемом 100 мл;
- питательная среда с раствором микроэлементов и витаминов;
- этанол как субстрат (S = 0,1 %; 0,3 %; 0,5 %);
- ингибитор – 1 % раствор CuSO4×5H2O;
- пипетки мерные объемом 10 мл – 6-8 шт.;
- пипетки мерные объемом 1 мл – 6-8 шт.;
- конические колбы объемом 250 мл – 6-8 шт.;
- пробирки со штативом (на 1 опыт, на 1 бригаду) – 5-6 шт.;
- мерные колбы объемом 50 или 100 мл – 4 шт.;
- мерные колбы объемом 500 мл – 2 шт.;
Экспериментальная часть
1. Провести короткое (до 12 часов) культивирование дрожжей р. Candida на питательной среде (ПС) с различными начальными концентрациями субстрата (этанола): 0,1 %; 0,3 %; 0,5 %. Внесение остальных компонентов питательной среды проводить согласно указаниям в лабораторной работе 2.
Условия периодического культивирования с использованием перемешивающего устройства («качалки»): t = 36o С, n = 220 об/мин.
По окончании лаг-фазы в начале экспоненциальной фазы роста (обычно через 1,5 часа для данных условий культивирования) добавить в среду ингибитор – 1 % раствор CuSO4×5Н2О. Провести 12 часовые контрольные (без ингибитора) и опытные (с ингибитором) ферментации.
Схема ферментации представлена ниже:
а) Без ингибитора (контроль):
ПС(V = 200 мл) + 0,2 мл + 0,2 мл + этанол + 20 мл →
раствор раствор 2 мл
микро- витаминов S=0,1 % посевной
элементов S=0,3 % материал
S=0,5 %
внести в 9 качалочных колб по 20 мл в каждую колбу.
б) С ингибитором (опыт) аналогично а)+0,5 мл 1% раствора CuSO4×5Н2О:
ПС(V = 200 мл) + 0,2 мл + 0,2 мл + этанол + 20 мл + 0,5 мл →
раствор раствор 2 мл
микро- витаминов S=0,1 % посевной раствор
элементов S=0,3 % материал CuSO4×5Н2О
S=0,5 %
внести в 9 качалочных колб по 20 мл в каждую колбу.
Расчетная часть
1. По экспериментальным данным, полученным в опытных и контрольных ферментациях, построить кривые роста дрожжевой культуры D = f(τ) и определить из них µmax.
Результаты представить в виде обобщающей таблицы 3.1. (Значения концентрации субстрата (этанола) для построения зависимостей Лайнуивера-Берка следует пересчитать в г/л).
Таблица 3.1 – Экспериментальные данные и расчетные показатели серии ферментаций в методе острых опытов
| №
пробы
| τ, час.
| D
| µ, час -1
| S,
г/л
| 1/ S
| 1/µmax
|
| без ингибитора
| с ингибитором
| без ингибитора
| с ингибитором
|
| Начальная концентрация субстрата 0,1 % вес.
|
| 1
| 0
|
|
|
|
|
|
|
|
| 2
| 3
|
|
|
|
|
|
|
|
| 3
| 6
|
|
|
|
|
|
|
|
| 4
| 9
|
|
|
|
|
|
|
|
| 5
| 12
|
|
|
|
|
|
|
|
| Начальная концентрация субстрата 0,3 % вес.
|
| 1
| 0
|
|
|
|
|
|
|
|
| 2
| 3
|
|
|
|
|
|
|
|
| 3
| 6
|
|
|
|
|
|
|
|
| 4
| 9
|
|
|
|
|
|
|
|
| 5
| 12
|
|
|
|
|
|
|
|
| Начальная концентрация субстрата 0,5 % вес.
|
| 1
| 0
|
|
|
|
|
|
|
|
| 2
| 3
|
|
|
|
|
|
|
|
| 3
| 6
|
|
|
|
|
|
|
|
| 4
| 9
|
|
|
|
|
|
|
|
| 5
| 12
|
|
|
|
|
|
|
|
2. Далее определить тип ингибирования графически с использованием зависимостей Лайнуивера-Берка (1/µ = f (1/ S)).
 1/µ 1/µ
1/µ 1/µ

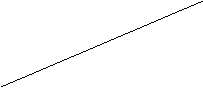 1/µmax 1/µmax
1/µmax 1/µmax

 1/µmax
1/µmax
K 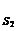 K
K 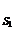 1/ S K
1/ S K  1/ S
1/ S
конкурентное неконкурентное
ингибирование ингибирование
1/µ
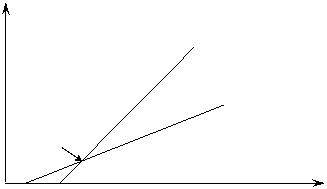
1/µmax
K 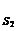 K
K  1/ S
1/ S
смешанное
ингибирование
Контрольные вопросы
1. Для каких исследовательских целей применяется метод острых опытов?
2. Какие условия должны соблюдаться при использовании метода острых опытов для изучения экспоненциально растущей культуры?
3. Приведите пример механизма действия неспецифического ингибитора.
4. Приведите пример механизма действия специфического ингибитора.
5. Как вы понимаете термин «степень токсичности»?
6. Для каких целей используются ингибиторы неспецифического действия?
7. Каким образом ионы Cu2+ поступают в клетки культуры р. Candida?
8. Опишите физиологическое состояние культуры р. Candida при воздействии на нее ионов меди?
9. При каком способе культивирования (периодическом или непрерывном) клетки могут выдержать более высокую концентрацию ингибитора?
Литература
1. Роботнова И.Л., Позмогова И.Н. Хемостатное культивирование и ингибирование роста микроорганизмов. М.: Наука, 1979. – 208 с.
2. Печуркин Н.С. и др. Популяционные аспекты биотехнологии / Н.С. Печуркин, А.В. Брильков, Т.В. Марченкова. Новосибирск: Наука, 1990. – 112 с.
3. Ашмарин И.П., Ключарёв Л.А. Ингибиторы синтеза белка. – Л.: Медицина, 1975. – 208 с.
4. Кантере В.М. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – 271 с.
5. Манаков М.Н., Победимский Д.Г. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – с. 144-172, 144-270.
Примерные темы самостоятельных работ к семинарским занятиям
1. Основные принципы регуляции обмена веществ у микроорганизмов
2. Особенности регуляции метаболизма в клетках эукариотных микроорганизмов
3. Внеклеточные ферменты микроорганизмов.
4. Основные положения термодинамики в приложении к биохимическим реакциям
5. Влияние температуры на скорость ферментативных реакций
6. Иммобилизация клеток микроорганизмов
7. Биопленки: характеристика развития, структуры и функций.
8. Иммобилизация ферментов
9. Диффузионные ограничения в процессах культивирования микроорганизмов
10. Генная инженерия: принципы и перспективы.



 1/µ 1/µ
1/µ 1/µ


 1/µmax 1/µmax
1/µmax 1/µmax

 1/µmax
1/µmax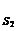 K
K 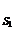 1/ S K
1/ S K  1/ S
1/ S



