Определение оптической плотности культуральной жидкости
Оптическая плотность служит качественным показателем содержания биомассы в культуральной жидкости. Для определения оптической плотности применяют фотоэлектроколориметр. При приготовлении суспензии клеток учитывают, что наиболее точные результаты получают при работе с суспензиями, имеющими показатели на среднем участке измерительной шкалы. Для разбавления суспензий используют водопроводную воду. Измеряют светорассеяние суспензий с помощью кюветы с длинной светового пути 0,5 см при длине волн 490 нм (зеленый светофильтр).
Подсчет числа клеток в культуральной жидкости производят с помощью счетной камеры Горяева-Тома, при микроскопировании проб с 40‑кратным объективом.
Определение содержания этанола.
1. Для качественного определения этанола проводится следующий анализ проб микробной суспензии:
1 мл КЖ (отфильтрованная проба) + 0,2 мл 2% К2Cr2О7 + 1 мл Н2SО4 (конц.)→
Цвет раствора характеризует степень присутствия этанола в пробе:
голубой цвет – много этанола
зеленый цвет – достаточное количество этанола
желтый цвет – отсутствие этанола.
2. Для количественного определения содержания этанола могут быть применены 2 метода.
2.1. Метод газохроматографический.
Определение производят с помощью газового хроматографа снабженного пламенно-ионизационным детектором. В качестве сорбента используют PORAPAC-QS, в процессе определения поддерживают температуру колонок 180о С. В качестве газа-носителя применяют инертные газы (гелий или азот). Температура испарителя – 220о С. При расходе газа‑носителя 4,2 л/мин этанол регистрируется на 5-6 минуте после ввода пробы. Для контроля вводят определенное количество этанола и по соотношению высоты пиков контроля и пробы судят о концентрации этанола в среде.
2.2. Оксидиметрический метод основан на окислении этанола до уксусной кислоты и воды смесью бихромата калия с серной кислотой.
3СН3СН2ОН + 2К2Cr2О7 + 8Н2SО4 → 3СН3СООН + 2Cr(SO4)2 + K2SO4 + 11H2O
Избыток бихромата оттитровывают раствором соли Мора.
К2Cr2О7 + 6FeSO4×(NH4)2SO4 + 7Н2SО4 → Cr2(SO4)3 + 3Fe2(SO4)2 + + 6(NH4)2SO4 + 7H2O + K2SO4
По количеству бихромата, израсходованного на окисление, вычисляют концентрацию этанола.
Для определения концентрации этанола в мерную колбу вносят 20 мл культуральной жидкости, доводят до метки дистиллированной водой и перемешивают. Затем отбирают 10 мл пробы в круглодонную колбу емкостью 50-75 мл, горлышко плотно закрывают резиновой пробкой с вмонтированной в нее газоотводной трубкой. В трехгорловую колбу вносят 25 мл раствора бихромата и 10 мл концентрированной серной кислоты. Конец отводной трубки должен доходить почти до конца приемника. Отгонка длится 10-15 минут. За время отгонки приемная колба должна быть заполнена на 2/3 объема колбы. Окраска раствора меняется от оранжевой до грязно-бурой. Содержимое приемника переносят в мерную колбу на 100 мл, туда сливают промывные воды от приемника и отводной трубки, доводят до метким дистиллированной водой и перемешивают. Отбирают 20 мл в коническую колбу на 250 мл, добавляют туда 20 мл дистиллированной воды и титруют раствором соли Мора.
Одновременно ведут контрольное титрование следующим образом. В коническую колбу на 250 мл помещают 5 мл раствора бихромата, 2 мл концентрированной серной кислоты, 30-40 мл дистиллированной воды и титруют раствором соли Мора. Конец титрования устанавливают капельной пробой с раствором феррицианида. Ее проводят на белой фарфоровой пластинке с помощью стеклянной палочки. Капают по капле раствор феррацианида и титруемую жидкость. Интенсивное синее окрашивание свидетельствует о конце титрования. Количество этилового спирта в г/л культуральной жидкости рассчитывают по формуле
n =  ,
,
где а, в – количество раствора соли Мора, пошедшего на титрование контрольной и опытной пробы соответственно;
25 – количество К2Cr2О7 в мл;
5 – разведение культуральной жидкости;
0,01 г этанола соответствует 1 мл К2Cr2О7.
Необходимые растворы: Н2SO4 (уд. вес 1,84), раствор К2Cr2О7 – 42,6 г/л, раствор соли Мора FeSO4×(NH4)2SO4 – 92 г и Н2SO4 – 20 г в 1 л воды, раствор феррицианида – 0,2 г/л.
Определение содержания глюкозы в питательной среде и культуральной жидкости (по реакции Фелинга)
Метод основан на восстановлении меди моносахаридами из окиси меди (II) в окись меди (I). Моносахариды в этой реакции выступают в качестве восстановителей меди и поэтому называются редуцирующими веществами (англ. reduction - восстановление). При проведении реакции используется реактив Фелинга, представляющий собой смесь растворов сульфата меди и сегнетовой соли (калий натрий виннокислый) в щелочной среде. При смешивании сульфата меди со щелочью происходит реакция:
CuSO4 + 2NaOH→ Cu(OH)2 + Na2SO4
В присутствии сегнетовой соли выделившийся гидрооксид меди (II) не выпадает в осадок, так как образует комплексное соединение. Медь (II) восстанавливается в присутствии моносахаридов с образованием окиси меди (I). Количество выпадшего осадка Сu2O (красно-бурого цвета) зависит от природы и количества редуцирующих веществ в пробе, состава жидкости Фелинга, ее щелочности, общего объема нагреваемой жидкости, температуры и длительности нагревания.
В результате этой реакции альдегидная или кетонная группа моносахарида окисляется до карбоксильной группы:
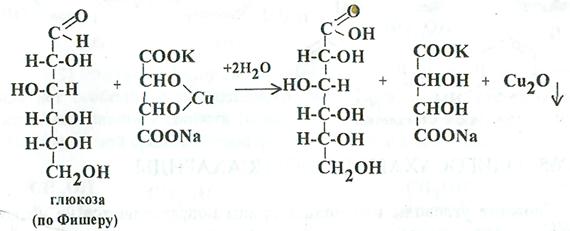
В зависимости от содержания углеводов в исследуемой жидкости, для анализа надо брать следующее количество пробы:
а) до 30 часов роста культуры – 0,5 мл
б) до 48 часов роста культуры – 1 мл
Для анализа отобрать 0,5 мл культуральной жидкости в колбу объемом 100 мл (250 мл), добавить 9,5 мл H2O и по 10 мл растворов Ф1 (CuSO4× 5H2O) и Ф2 (COOK ─ CHOH ─ CHOH ─ COONa × 4H2O), и смесь нагревают на электроплитке в течение 3 минут с момента появления первого пузырька. Затем смесь охлаждают и в колбу вносят 15 мл 20% раствора H2SO4 и 5 мл 40% раствора KJ. Выделившийся J2, оттитровывают 0,1 н раствором Na2S2O3. В конце титрования вносят в колбу несколько капель 0,5% раствора крахмала. Крахмал нужно добавлять в конце титрования, т.к. если добавлять его сразу, то образуется комплекс меди с крахмалом, который медленно реагирует с гипосульфитом натрия (Na2S2O3). Раствор в колбе должен приобрести сначала грязно-синий цвет, а по окончании титрования молочную окраску.
Аналогично готовят контрольный пробу, в которой вместо культуральной жидкости для анализа используется 10 мл H2O. Далее реакцию проводят согласно вышеописанной методике.
Используя данные титрования и учитывая разность объемов титранта (Na2S2O3) между контрольной и опытной пробами (ΔV), по калибровочному графику ΔV = f (С) определяем концентрацию редуцирующих сахаров (С). Этим методом определяют содержание в культуральной жидкости гексоз – основного источника углерода для большинства микроорганизмов.
Выявление запасного энергетически важного запасного вещества дрожжевой клетки – гликогена
На предметном стекле приготовить препарат «раздавленная капля». Добавить каплю раствора Люголя. Микроскопировать под увеличением в 40 раз. Гликоген в дрожжевых клетках окрашивается в красновато-бурый цвет.
Определение количества белка в биомассе
Метод основан на том факте, что спектрофотометрически максимум поглощения белков наблюдается при 280 нм. Он обусловлен присутствием в белках ароматических аминокислот – тирозина и триптофана. Диапазон колебаний отношений их содержания к содержанию других аминокислот довольно узок.
При определении содержания белка в дрожжевых клетках сначала проводят гидролиз дрожжей с экстракцией белков. Для этого надо внести 1 мл культуральной жидкости в мерные колбы на 50 мл, добавить 20 мл 0,5 н NаОН и поставить на кипящую водяную баню и нагревать. Время закипания засекают с момента закипания. Затем пробы охлаждают и доводят объем до 50 мл 0,5 н раствором NаОН. Остатки клеток удаляют центрифугированием. Одновременно обрабатывают контрольную пробу. Для этого нужно внести 20 мл 0,5 н NаОН, прокипятить на водяной бане 20 минут, довести объем до 50 мл 0,5 н NаОН.
В фугате определяют с помощью спектрофотометра оптическую плотность при λ = 280 нм и 260 нм. При каждой длине волны измерения проводят относительно контрольной пробы.
Если отношение  ≤ 1,70, то концентрацию белка определяют по формуле: Б = 1,45 А 280 - 0,74 А 260. Здесь А 280и А 260 – оптическая плотность при 280 и 260 нм соответственно; Б – содержание белка в биомассе, % вес.
≤ 1,70, то концентрацию белка определяют по формуле: Б = 1,45 А 280 - 0,74 А 260. Здесь А 280и А 260 – оптическая плотность при 280 и 260 нм соответственно; Б – содержание белка в биомассе, % вес.
Зная концентрацию биомассы в культуральной жидкости, можно определить концентрацию белка в биомассе.
Расчетная часть
1. Построить и проанализировать график зависимости концентрации углеродного субстрата в среде в зависимости от времени.
2. Используя экспериментальные данные, построить логарифмическую кривую роста и определить длительность фаз.
3. Вычислить значения удельной скорости роста μ по фазам роста и представить эти данные в графическом виде.
4. Рассчитать значения экономического коэффициента и метаболического коэффициента по фазам роста.
5. Вычислить выход по энергии, кислороду и белку для дрожжей.
Результаты экспериментальных исследований и расчетов свести в табл. 2.3 и 2.4.
Таблица 2.3 – Экспериментальные данные, полученные при культивировании дрожжей
| № пробы
| τ, час
| Х, г/л
| S, г/л
| Наличие гликогена
|
| 0
| 0
|
|
|
|
| 1
| 2
|
|
|
|
| 2
| 4
|
|
|
|
| 3
| 6
|
|
|
|
| 4
| 8
|
|
|
|
| 5
| 24
|
|
|
|
Таблица 2.4 – Расчетные показатели культивирования дрожжей по фазам роста
| Фазы роста
| Продолжительность фаз роста, час
| µ, час-1
| q, 
| Yx/s,
г АСБ/г субстрата
| Б,%
|
| лаг-фаза
|
|
|
|
|
|
| фаза ускорения роста
|
|
|
|
|
|
| логарифмическая фаза
|
|
|
|
|
|
| фаза замедления роста
|
|
|
|
|
|
| стационарная фаза
|
|
|
|
|
|
| фаза отмирания
|
|
|
|
|
|
Контрольные вопросы
1. Проведите сравнительный анализ роста дрожжей на глюкозе и этаноле. Объясните биохимические особенности утилизации того или иного субстрата, используя рис. 2.2.
2. Почему клетке, способной ассимилировать С2-соединения, необходим глиоксилатный шунт?
3. В каких условиях клетки дрожжей образуют уксусную кислоту?
4. Объясните роль источников минерального питания и факторов роста, которые вносятся в питательную среду для культивирования дрожжей.
5. Перечислите основные контролируемые и регулируемые параметры процесса культивирования дрожжей.
6. Каков критерий окончания процесса культивирования?
7. Каковы характерные признаки различных фаз роста?
8. Увеличиваются ли затраты на поддержание жизнедеятельности дрожжей в стационарной фазе роста?
9. На какой фазе роста содержание белка в клетках максимально?
10. Существует ли прямая корреляция между удельной скоростью роста и содержанием белка в биомассе?
11. Какие показатели представляют кинетические характеристики роста культуры?
12. Какие показатели отражают стехиометрию роста микроорганизмов?
Литература
1. Бирюков В.В. Основы промышленной биотехнологии. – М.: Высшая шк., 2004. – 356 с.
2. Манаков М.Н., Победимский Д.Г. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – с. 97-99, 173-205.
3. Еникеев Ш.Г., Белялова З.М., Валеев Р.И. и др. Получение микробной биомассы на основе этилового спирта. – Казань: КХТИ, 1988. – 32 с.
4. Кантере В.М. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – 271 с.
5. Решетник О.А. Общая микробиология. – Казань: КХТИ, 1984. – с. 59-66.
6. Егоров Т.А., Клунова С.М., Живухина Е.А. Основы биотехнологии. – М.: Академия, 2003. – 208 с.
7. Микробная биотехнология / Лещинская И.Б. Куриненко Б.М., Вершинина В.И. и др. – Казань: Унипресс: ДАС, 2000. – 368 с.
8. Елинов Н.П. Основы биотехнологии. – С-Пб.: Наука, 1995. – 600 с.
9. Беккер М.Е., Лиепиныш Г.К., Райпулис Е.П. Биотехнология. – М.: Агропромиздат, 1990. – 334 с.
10. Промышленная микробиология / Под ред. Н.С. Егорова. – М.: Высшая школа, 1989. – 688 с.



 ,
,
 ≤ 1,70, то концентрацию белка определяют по формуле: Б = 1,45 А 280 - 0,74 А 260. Здесь А 280и А 260 – оптическая плотность при 280 и 260 нм соответственно; Б – содержание белка в биомассе, % вес.
≤ 1,70, то концентрацию белка определяют по формуле: Б = 1,45 А 280 - 0,74 А 260. Здесь А 280и А 260 – оптическая плотность при 280 и 260 нм соответственно; Б – содержание белка в биомассе, % вес.



