В покое у человека в процессе метаболизма образуется 200 мл СO2 в минуту. СO2 имеет растворимость в воде выше, чем кислород, и поэтому в большем количестве переносится плазмой крови и эритроцитами в физически растворенном состоянии (около 10%). Примерно 30% молекул СO2 , поступающих в кровь, обратимо связывается с аминогруппами гемоглобина, образуя карбаминогемоглобин (карбгемоглобин):СO2+Hb= HbCO2, поскольку восстановленный гемоглобин имеет высокое сродство к СO2.
Остальные 60% молекул углекислого газа, поступающих в кровь, превращаются в бикарбонат и в такой форме СO2транспортируется к легким.
CO2 из тканей диффундирует по градиенту концентрации внутрь эритроцитов. В эритроцитах реакция
С O 2 + Н2О=Н2СО3= НСО3- + Н+
осуществляется с обязательным участием фермента карбоангидразы, которая содержится в мембранах эритроцитов. Затем угольная кислота диссоциирует на ион водорода и ион бикарбоната. Большинство ионов бикарбоната по мере образования выводится через мембрану эритроцитов в плазму крови с помощью белка транспортера. При этом один ион бикарбоната обменивается на один ион хлора (хлорный сдвиг). Ионы H+ и CO2 связываются с молекулой гемоглобина, образуя карбаминовое соединение, в виде которого переносится часть CO2 к легочным капиллярам. Вторая фракция переноса CO2 от тканей к легким – это HCO3-. HCO3- поступают в плазму крови и связываются с ионами Na+ и участвуют в регуляции pH крови.CO2 практически не выводится из организма таким путем. Основными источниками выдыхаемого CO2 являются соединения CO2 и H+- ионов с гемоглобином эритроцитов, а также физически растворенная в плазме крови фракция CO2. В капиллярах легких в эритроцитах происходит диссоциация соединений CO2 с гемоглобином и H+- ионами (эффект Бора). Напряжение CO2 в венозной крови выше, чем в альвеолярном воздухе. Физически растворенный углекислый газ диффундирует через альвеолярную мембрану в просвет альвеолярного пространства, а затем выводится из легких с выдыхаемым воздухом. Выведение CO2 из венозной крови в альвеолы сдвигает реакцию
CO2+ H2O=H2CO3=HCO3-+H+
влево с образованием H2O и CO2. CО2 диффундирует из крови в альвеолы. Карбаминовые соединения гемоглобина высвобождают CO2, и углекислый газ диффундирует в альвеолы, а затем выводится из легких во внешнюю среду.
3.3.Транспорт ионов водорода от тканей к легким. Другие виды гемоглобина. Восстановленный гемоглобин имеет более высокое сродство к протонам, чем оксигемоглобин, и связывает большинство протонов, которые образуются в вышеуказанной реакции. В результате только незначительное количество ионов водорода находится в крови в свободном состоянии. Это объясняет тот факт, что кислотность венозной крови незначительно ниже, чем в артериальной крови. В капиллярах легких – по мере образования оксигемоглобина реакция HbO2+ H+=HbH+ O2 протекает в обратном направлении с образованием оксигемоглобина и ионов водорода. Ионы водорода реагируют с ионами бикарбоната, что сдвигает реакцию влево с образованием воды и углекислого газа, который диффундирует в альвеолы и удаляется из организма с выдыхаемым воздухом.
Гемоглобин может образовывать также соединения с угарным газом (окись углерода, монооксид углерода, CO)и взаимодействовать с сильными окислителями с изменением валентности железа в геме.
Соединение гемоглобина с угарным газом называется карбоксигемоглобином (HbCO). Аффинность гемоглогбина к CO приблизительно в 300 раз больше, чем O2., т.е.гемоглобин связывает CO более активно. В этом случае гемоглобин не может быть использован для транспорта кислорода. Соединение CO с железом гема ведет к увеличению аффинности остальных молекул гематетрамерного Hb к O2.Таким образом, при связывании Hb с CO повышается аффинность Hb к O2, что препятствует отдаче кислорода в тканях и кривая связывания кислорода сдвигается влево. Из-за большой аффинности гемоглобина к угарному газу даже очень низкие парциальные давления CO приводят к связыванию значительного количества гемоглобина с CO с образованием HbCO. То, что у людей, которые находятся в условиях интенсивного уличного движения транспорта, или при курении, отравления угарным газом наступает редко, объясняется только медленным переходом угарного газа из альвеолярного газа в кровь.
Двухвалентное железо гема (Fe2+) под действием сильных окислителей (нитраты, нитриты, анилинсодержащие вещества, бертолетовая соль и др.) может окисляться в трехвалентное (Fe3+). Гемоглобин с трехвалентным железом в геме называется метгемоглобин (MetHb, также хемиглобин). Метгемоглобин не может обратимо присоединять кислород и поэтому является для транспорта кислорода неактивным. Окисление железа гема ведет к увеличению аффинности остальных молекул гема к O2. Т.е., кривая связывания кислорода частично метгемоглобинизированным гемоглобином сдвинута влево. При помощи некоторых средств восстановления (дитионит) MetHb может опять восстановиться в гемоглобин, в геме которого железо опять будет двухвалентным. В организме восстановление метгемоглобина в гемоглобин происходит под влиянием фермента метгемоглобинредуктазы. Грудные дети, у которых метгемоглобинредуктаза еще недостаточно активна, особенно подвержены действию токсических веществ, окисляющих гемоглобин в метгемоглобин.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ.
1.В каких формах кислород присутствует в крови?
2.Гемоглобин. Его роль в транспорте кислорода и углекислого газа.
3.Кривая диссоциация оксигемоглобина и ее изменения в зависимости от температуры, рН.
4.Транспорт углекислого газа от тканей к легким.
5. Транспорт ионов водорода от тканей к легким.
6. Виды гемоглобина.
РЕГУЛЯЦИЯ ДЫХАНИЯ
Дыхательная система – система внешнего дыхания - это вегетосоматическая система с четкими морфологическими границами и конкретными механизмами деятельности, начиная от забора атмосферного воздуха, последующей транспортировки кислорода до клеток, окислительного обмена в тканях и кончая удалением углекислого газа из организма.
Обеспечение клеток кислородом и удаление углекислого газа является главным, но не единственным назначением системы дыхания. Дыхательная система в различных звеньях связана с другими функциональными системами. Работа дыхательных мышц протекает в тесном взаимодействии и координации с общей моторной деятельностью организма. Процессы газообмена при дыхании тесно взаимосвязаны с функционированием сердечно-сосудистой системы. Вентиляторный аппарат обеспечивает работу обонятельного анализатора, а также звуковыражение у животных и речь у человека. Регулярное ритмическое поступление афферентации от рецепторов слизистой оболочки носа и рецепторных образований дыхательного аппарата, а также иррадиация ритмической активности из дыхательного центра оказывает огромное тоническое влияние на центральную нервную систему (ЦНС). Центральным звеном нервной регуляции дыхания является дыхательный центр (ДЦ).
Дыхательный центр.
Впервые экспериментально достаточно точное местоположение дыхательного центра в продолговатом мозге было установлено в 1885 году Н.А. Миславским. Согласно Н.А. Миславскому, дыхательный центр расположен в ретикулярной формации дна четвертого желудочка по обеим сторонам срединного шва между верхушкой и основанием писчего пера, частично кнаружи, частично кнутри от ядер подъязычного нерва. В настоящее время идет интенсивное и всестороннее изучение этой структуры, определяющей жизненно важную функцию – дыхание. По современным представлениям, дыхательный центр рассматривается в первую очередь как совокупность нейронов, активность которых синхронна с фазами дыхательного цикла. Исходя из этого признака, предложены классификации нейронов. Наиболее популярной является классификация дыхательных нейронов по Bianchi et al. (1995). Согласно этой классификации, дыхательные нейроны в соответствии с паттерном их активности подразделяются на шесть основных групп: ранние инспираторные, инспираторные с нарастающим паттерном активности, поздние инспираторные, постинспираторные, экспираторные с нарастающим паттерном активности, преинспираторные.
Дыхательные нейроны сосредоточены главным образом в пяти различных функционально-специфических отделах дыхательного центра: дорсальной дыхательной группе, вентральной дыхательной группе, пре-Бетцингеровом комплексе, комплексе Бетцингера и пневмотаксическом центре (рис. 9).
Дорсальная дыхательная группа нейронов. Данная группа нейронов расположена в области ядра солитарного тракта. Большинство клеток составляют инспираторные нейроны различных типов: Rα, Rβ, Р-клетки и др.
Rα-нейроны характеризуются дыхательной активностью, нарастающей по ходу вдоха, а также резкой ее остановкой в момент достижения объемного порога -выключения вдоха. Эти типы нейронов являются бульбо-спинальными, их аксоны образуют перекрест на уровне каудальной части продолговатого мозга, а затем направляются к спинальным мотонейронам инспираторных мышц.
Паттерн активности Rβ-нейронов напоминает таковой у Rα-нейронов, но с некоторым отличием. Активность Rβ-нейронов не обрывается в конце вдоха, а сохраняется и в начале выдоха, постепенно убывая.
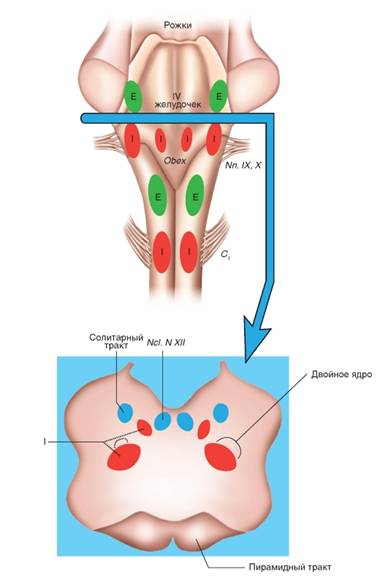
Рис.9. Дыхательный центр продолговатого мозга. Распределение респираторных нейронов в дыхательном центре продолговатого мозга. Вид на продолговатый мозг (medulla oblongata), инспираторные (I) и экспираторные нейронные группы (Е) и их приблизительное расположение. В действительности они находятся внутри ретикулярной формации и их трудно отграничить. Внизу: поперечный срез на данном уровне с инспираторными нейронными группами. Nn.IX,X – места выхода nn.Glossopharyngeus и Vagus. Ncl.N.XII – ядра подъязычного нерва. Рис. взят из кн. А.Г.Камкин, И.С.Киселева, 2012.
Установлено, что в дополнение к общему источнику драйва, получаемому от генератора центральной инспираторной активности, к Rβ-нейронам приходит афферентация от рецепторов растяжения легких. Таким образом, Rβ-нейроны участвуют в реализации рефлекса Геринга-Брейера. Сравнительно недавно были описаны Р-клетки. Они получают информацию от рецепторов растяжения легких.
Большинство нейронов дорсального ядра являются бульбоспинальными (у кошек от 50 до 80%). В отношении проприобульбарных нейронов дорсальной дыхательной группы известно, что многие из них проецируются в направлении вентролатеральных отделов дыхательного центра, а также к контрлатеральному ядру солитарного тракта. Предполагают, что эти проекции играют важную роль в передаче дыхательному центру интегрирующих афферентных импульсов, оказывающих влияние на дыхание. Ядро солитарного тракта отличается многообразием нейротрансмиттеров и нейропептидов, которые и обеспечивают его функции.
Вентральная дыхательная группа. Нейроны вентральной дыхательной группы сосредоточены в двух симметричных колонках, вытянутых в рострально-каудальном направлении и расположенных в области n. ambigualis и n. retroambigualis. Вентральная дыхательная группа подразделяется на каудальный и ростральный отделы, различающиеся по функциональным характеристикам.
Каудальный отдел вентральной дыхательной группы расположен в области n. retroambigualis. Этот отдел дыхательного центра состоит почти исключительно из бульбоспинальных экспираторных нейронов. У нейронов этой группы не обнаружено коллатералей на уровне продолговатого мозга. Предполагают, что они не имеют проекций к другим отделам бульбарного дыхательного центра. Данная группа экспираторных нейронов получает возбуждающий вход от более ростральных отделов дыхательного центра. Вероятно, активирующая афферентация поступает от экспираторных нейронов комплекса Бетцингера. Паттерн активности большинства экспираторных нейронов каудального отдела вентральной дыхательной группы характеризуется медленным нарастанием частоты импульсации на выдохе с максимумом в конце экспираторной фазы. Кроме экспираторных нейронов, в состав каудального отдела вентральной дыхательной группы входит небольшое количество инспираторных нейронов.
Ростральный отдел вентральной дыхательной группы расположен в области n. ambigualis и прилегающих параамбигуальных структурах. Этот отдел состоит в основном из инспираторных нейронов. Здесь расположены бульбоспинальные премотонейроны инспираторных мышц, а также мотонейроны мышц гортани и некоторых мышц пищевода. В данном отделе также обнаружены проприобульбарные нейроны, которым приписывается координирующая роль в регуляции тонуса верхних дыхательных путей и инспираторных мышц. Паттерн активности инспираторных бульбоспинальных нейронов рострального отдела вентральной дыхательной группы характеризуется постепенным нарастанием частоты импульсации по ходу инспираторной фазы, аналогично паттерну активности диафрагмы и наружных межреберных мышц. В этом отделе дыхательного центра обнаружены нейроны с ранним инспираторным паттерном активности. Залпы таких нейронов характеризуются ранним началом, слегка опережающим активность диафрагмального нерва, быстрым достижением максимума с последующим снижением ее к концу инспираторной фазы. Считают, что ранние инспираторные нейроны являются источником ингибирования активности экспираторных премоторных клеток каудального отдела вентральной дыхательной группы и поздних инспираторных нейронов дорсальной дыхательной группы.
В последнее время большое значение в генерации ритма дыхания придается пре-Бетцингерову комплексу. У кошек он расположен в ростральной части n. ambigualis и вентролатеральной области ретикулярной формации каудальнее n. retrofacialis и ростральнее n. lateralis retikularis. При внеклеточной и внутриклеточной регистрации активности нейронов обнаружена область концентрации разнообразных типов дыхательных нейронов, в том числе двух типов преинспираторных нейронов, ранних инспираторных и постинспираторных нейронов. В данной структуре расположены те типы нейронов, которые согласно трехфазной теории ритмогенеза считаются необходимыми для генерации дыхательного ритма. Мнение о ведущей роли комплекса пре-Бетцингера в ритмогенезе опирается на некоторые экспериментальные данные. Так, в опытах in vitro удаление этого образования приводило к прекращению генерации дыхательного ритма в срезах ствола мозга. Локальные нарушения синаптической передачи в комплексе пре-Бетцингера также приводили к нарушению дыхательного ритма in vitro. Изучение нейронного состава комплекса пре-Бетцингера показало, что в данной структуре содержатся те типы нейронов, которые необходимы для генерации ритма в условиях in vitro: преинспираторные и пейсмекерные, а также нейроны, имеющие значения для переключения дыхательных фаз в этих условиях: преинспираторные и постинспираторные. Следует, однако, заметить, что вывод об исключительной роли данного образования в процессе генерации ритма дыхания является преждевременным и требует экспериментального исследования в условиях in vivo.
Нейроны пре-Бетцингерова комплекса отличаются разнообразием медиаторов и их рецепторов.
Комплекс Бетцингера. Данный отдел дыхательного центра расположен в области n. retrofacialis. Большинство клеток комплекса Бетцингера относится к экспираторным нейронам. Функционально нейроны этого отдела неоднородны. Здесь обнаружены экспираторные нейроны, дающие проекции в каудальные отделы дыхательного центра и характеризующиеся нарастающим паттерном активности. Аксоны нейронов отдают множество коллатералей, большинство которых идет в направлении других вентральных отделов дыхательного центра. Экспираторные нейроны этого комплекса образуют моносинаптические тормозные проекции в направлении бульбоспинальных инспираторных нейронов дорсальной и вентральной дыхательных групп, каудальной группы ядер шва и других образований ствола. В вентральной части комплекса Бетцингера описана группа мелких нейронов с экспираторной активностью. Дендриты этих нейронов образуют широкие разветвления вблизи вентральной поверхности продолговатого мозга. Предполагают, что эта группа нейронов принимает участие в механизме центральной хеморецепции.
Вышеописанные структуры, собственно, и образуют дыхательный центр продолговатого мозга. По современным представлениям, их вполне достаточно для генерации дыхательного ритма.
На уровне организма как системы в регуляции дыхания принимают участие и другие структуры центральной нервной системы. Среди них особое место с давних пор занимают структуры варолиева моста. В настоящее время известно, что в процессе регуляции дыхания принимают участие нейроны группы А5 и А6, содержащие катехоламины, межтройничная область, а также каудальная часть ретикулярной формации моста. Наибольшее количество нейронов, разряжающихся синхронно с дыхательными фазами, обнаружено в области между парабрахиальными ядрами и ядрами Келликера-Фузе. Эта область получила название пневмотаксического центра, а совокупность находящихся здесь нейронов – понтинной дыхательной группы. Отличительной особенностью этой группы является присутствие высокого процента нейронов с пиком активности, приходящимся на момент перехода фаз дыхательного цикла. Поэтому допускается, что нейроны данной группы принимают непосредственное участие в механизмах переключения дыхательных фаз. Нейроны понтинной дыхательной группы дают широкие проекции к клеткам всех отделов бульбарного дыхательного центра (бульбоспинальным, глоточным, подъязычным мотонейронам, к спинальным мотонейронам дыхательных мышц). Получены данные, что нейроны промежуточной части ядра Келликера-Фузе контролируют постинспираторную моторную активность. Нейроны понтинной дыхательной группы получают афферентацию от различных популяций нейронов бульбарного дыхательного центра. Предполагается, что одной из важных функций нейронов этой группы является адаптация респираторных рефлексов (рефлекс Геринга-Брейера) и дыхательных рефлексов с каротидных хеморецепторов. Из этого следует, что структуры варолиева моста могут играть более значительную роль в формировании нормального и патологического паттернов дыхания, чем предполагалось ранее.
Необходимо также отметить, что конкретные отношения между структурами варолиева моста и бульбарного дыхательного центра, определяющие генерацию и контроль дыхательного паттерна, остаются пока неизвестными.
Несмотря на достаточно обширные сведения о нейронном составе дыхательного центра, механизмы автоматической генерации дыхательного ритма до настоящего времени остаются невыясненными. Отсутствует интегральная теория ритмогенеза дыхания. В настоящее время предлагаются три модели генерации ритма дыхания: модель нейронных сетей, пейсмекерная модель и гибридная модель.
Согласно модели нейронных сетей, для генерации дыхательного ритма необходима сеть дыхательных нейронов с различными функциональными свойствами, взаимодействующих между собой с помощью возбуждающих и тормозных синаптических связей. Кроме того, сетевой пейсмекер требует обязательного притока самой разнообразной афферентации, которая на выходе из сети становится ритмической. Данная модель совпадает по сути с существующим мнением о рефлекторной природе автоматии дыхательного центра. Недостатком этой модели является отсутствие экспериментального подтверждения тормозных проекций от ранних инспираторных к постинспираторным.
В пейсмекерных моделях основой генерации ритма являются функции нейронов с пейсмекерными свойствами, которые обусловлены особенностями мембранной проводимости. В истинных пейсмекерах мембрана спонтанно с определенной периодичностью становится проницаема для ионных деполяризующих токов. На сегодня, пейсмекерные клетки были найдены в основном в условиях in vitro у плодов или новорожденных животных.
В гибридных моделях клетки с пейсмекерными свойствами являются составной частью нейронной сети, синаптические взаимодействия внутри которой в комбинации со свойствами отдельных нейронов регулируют паттерн активности моторных респираторных нейронов.
Нервная регуляция дыхания.
Регуляция дыхания является рефлекторной. Важный принцип, который лежит в основе системы управления дыханием – принцип управления с самоадаптацией. Задача полной системы управления дыханием – согласование и объединение трех подсистем (химической, мышечной и управления воздухоносными путями) таким образом, чтобы обеспечить равенство вентиляционного и метаболического газообмена при минимальном расходе энергии на дыхание. Самоадаптация дыхательной системы предполагает взаимодействие всех контуров управления в ответ на возмущающие факторы в соответствии с заданной «уставкой». Дыхательную систему рассматривают как систему автоматического регулирования по отклонению. Управление дыханием осуществляется по принципу обратной связи: отклонение регулируемых параметров (PаCO2 и PaO2) от требуемых значений воздействует через рецепторы на дыхательный центр так, что происходят изменения МОД, приводящие к компенсаторному уменьшению возникающих отклонений. Кроме того, в системе управления дыханием используется и регулирование по возмущению. Так, увеличение МОД при мышечной деятельности возникает под влиянием импульсации, приходящей от работающих мышц и сигналов, которые поступают из высших отделов ЦНС. Эта информация о предстоящих отклонениях в газовом составе артериальной крови вызывает ответ ДЦ, который обеспечивает упреждающее увеличение МОД, что предупреждает последующие изменения газового состава крови. Оценка значения сигналов о возмущении и выработка адекватного по величине ответного изменения МОД происходят путем самообучения, которое направлено на предупреждение и уменьшение отклонений в газовом составе артериальной крови. При неадекватном изменении МОД наступает отклонение газового состава артериальной крови. Путем обратной связи происходит приближение МОД к должной величине и выработка более точного условно-рефлекторного ответа на сигнал о возмущении.
Таким образом, управление внешним дыханием осуществляется самообучающейся комбинированной системой, которая основана на регуляции как по отклонению, так и по возмущению.
Нервная регуляция дыхания начинается с раздражения специфических и неспецифических рецепторов и сигналов из супрабульбарных отделов. Выделяют хеморецепторный и механорецепторный контуры регулирования. Каждый дыхательный рефлекс реализуется в структурах одного из основных контуров управления дыхательной системой.
Хеморецепторный контур регулирования включает периферические (артериальные) (рис.10) и центральные хеморецепторы.
Периферические хеморецепторы расположены в месте бифуркации общих сонных артерий и в дуге аорты, а также в каротидных и аортальных тельцах в непосредственной близости с артериальными барорецепторами, но раздельно от них. Периферические хеморецепторы – это специализированные рецепторные клетки, которые возбуждаются в основном при снижении артериального рО2 и увеличении в артериальной крови рСО2. Эффекты уменьшения рО2 и увеличения рСО2 в артериальной крови опосредуются на уровне 1 типа клеток каротидных или аортальных телец. Периферические хеморецепторы иннервированы волокнами нейронов, тела которых расположены в солитарном комплексе и ретроамбигуальном ядре. При возбуждении периферических хеморецепторов сигналы по волокнам синокаротидного нерва передаются к инспираторным нейронам дорсальной дыхательной группы дыхательного центра, активация которого вызывает увеличение вентиляции легких и усиление поступление кислорода в организм человека. Увеличение вентиляции легких при стимуляции периферических хеморецепторов низким рО2 и повышенным рСО2 называется периферическим хеморефлексом, функция которого заключается в поддержании нормального уровня напряжения кислорода в артериальной крови посредством регуляции вентиляции легких. Выраженное проявление этого рефлекса наблюдается только при уменьшении содержания кислорода во вдыхаемом воздухе ниже 60 мм рт. ст.
Центральные хеморецепторы представляют собой нейроны, которые расположены в ростральных вентро-латеральных отделах продолговатого мозга, в частности в позадитрапециевидном ядре, а также в области ядер шва и голубого пятна. При увеличении концентрации Н+ ионов внеклеточной жидкости мозга происходит закрытие специфических калиевых каналов мембраны хеморецепторных нейронов, что вызывает деполяризацию мембранного потенциала. В результате деполяризации происходит высвобождение медиатора АТФ в синаптическую щель, что вызывает в дальнейшем генерацию потенциалов действия в афферентных чувствительных волокнах, которые передаются к нейронам дыхательного центра и обусловливают активацию генерации дыхательного ритма. В результате происходит увеличение вентиляции легких и восстановление нормальной величины рН внеклеточной жидкости мозга. При уменьшении рН внеклеточной жидкости мозга на 0,01 единицы величина вентиляции легких возрастает в среднем на 4л/мин.
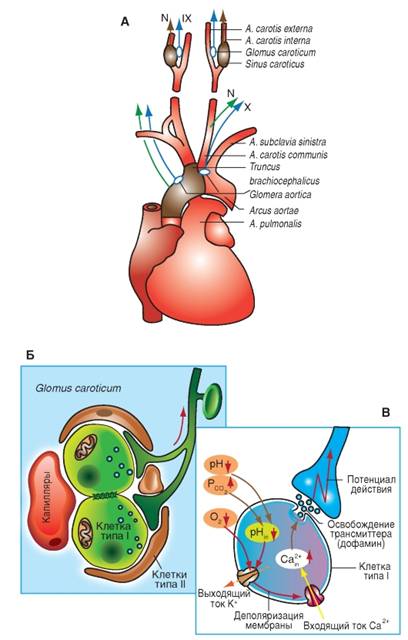
Рис.10. Периферические хеморецепторы.
А – каротидные тельца (glomera carotica) в месте бифуркации сонной артерии получают кровь из наружной сонной артерии (a.carotis externa) и иннервируются языкоглоточным нервом (IX пара). По аортальным тельцам циркулирует кровь из аорты и они иннервируются ветвями блуждающего нерва (n.vagus, X пара). Б – показаны две клетки типа I с их синапсами на афферентных волокнах синусного нерва сонной артерии, причем обе клетки окутаны глиаподобными клетками типа II и имеют тесный контакт с открытыми капиллярами. В – схематически представлены механизмы передачи сигнала с помощью медиатора (трансмиттера). Рис. взят из кн..А.К.Камкин, И.С.Киселева «Атлас по физиологии», т.2, 2012.
Изменения рН в области центральных хеморецепторов обусловлены изменениями рСО2 в артериальной крови. Увеличение вентиляции легких при стимуляции центральных хеморецепторов Н+ - ионами водорода называется центральным хеморефлексом. Функция этого рефлекса заключается в поддержании значения рН внеклеточной жидкости мозга в пределах физиологической нормы.
Механорецепторный контур регулирования осуществляется при участии трех типов механорецепторов легких:
1) быстро адаптирующихся рецепторов растяжения легких;
2) медленно адаптирующихся рецепторов легких;
3) J-рецепторов.
От быстро адаптирующихся рецепторов (ирритантные) начинаются рефлекторные дуги защитных дыхательных рефлексов. Ирритантные рецепторы расположены в эпителии и субэпителиальном слое от верхних дыхательных путей до альвеол. Эти рецепторы стимулируются механическими или химическими раздражителями (пыль, слизь, табачный дым, пары едких веществ, например, аммиак, эфир). Раздражение рецепторов слизистой носовой полости посредством афферентных нервных волокон тройничного нерва вызывает рефлекс чихания; рецепторов эпифаренгиальной области – через волокна языкоглоточного нерва - нюхательный или аспирационный рефлекс; раздражение рецепторов слизистой гортани и трахеи – через волокна блуждающего нерва – кашлевой рефлекс. Эти рецепторы отвечают за рефлекторные изменения типа дыхания при большом количестве легочных заболеваний и являются также причиной сужения бронхов и спазма гортани.
При стимуляции медленно адаптирующихся рецепторов легких, локализованных в гладких мышцах бронхов и трахеи, в экспериментах на животных возникает рефлекс Геринга-Брейера. Данный тип рецепторов связан афферентными нервными волокнами блуждающего нерва с нейронами дорсальной дыхательной группы дыхательного центра. Стимуляция этих рецепторов при увеличении объема легких на вдохе вызывает прекращение фазы вдоха и начинается фаза выдоха. Во время сна у человека рефлекторное выключение вдоха с помощью рефлекса Геринга - Брейера обусловливает периодическую смену фаз вдоха и выдоха. Современные исследования показали, что у человека саморегуляция дыхания через блуждающие нервы (рефлекс Геринга-Брейера) не имеет такого значения как у животных. У человека тормозный рефлекс Геринга-Брейера не возникает при нормальном дыхательном объеме. Для его возникновения требуется растяжение легких, превышающее обычный дыхательный объем. Активация рецепторов растяжения легких вызывает также рефлекторное расширение бронхов (бронходилятацию) и стимуляцию сердечной активности, что имеет значение при физической работе. В настоящее время считается, что отсутствие тормозного дыхательного рефлекса у человека является результатом возросшей у него в процессе эволюции активностью мозга и развитием речи, которые приводят к подавлению поступающих в нервную систему импульсов с рецепторов легких.
J -рецепторы формируются окончаниями немиелизированных (С-волокна) и тонких миелизированных афферентных волокон блуждающего нерва. Они находятся в области стенки альвеолярных легочных капилляров или в интерстиции легочной ткани. Они возбуждаются при скоплении жидкости в альвеолярной стенке (отек) и под влияние ряда биологически активных веществ (гистамина, брадикинина, простагландина), которые освобождаются при заболеваниях и травмах легкого. Возбуждение этих окончаний ведет к апное, снижению частоты сердечных сокращений и артериального кровяного давления, а также к спазму гортани и уменьшению активности скелетной мускулатуры в связи с торможением α-мотонейронов. Это комплексный соматический и висцеральный рефлекторные ответы.
В формировании дыхания широко участвуют собственные спинальные рефлексы дыхательных мышц. За исключением диафрагмы, дыхательные мышцы, так же как и другие поперечно полосатые мышцы, содержат мышечные веретена (рецепторы растяжения), которые передают их афферентное влияние не только спинальным мотонейронам самих дыхательных мышц, но и респираторным нейронам продолговатого мозга. На этой основе деятельность дыхательных мышц может приспосабливаться к сопротивлению легких и грудной клетки.
Функции мотонейронов дыхательных мышц. Электрические импульсы от инспираторных и экспираторных бульбоспинальных нейронов дыхательного центра передаются по аксонам к мотонейронам сегментов спинного мозга: С3-С5 и Т1-Т12. Аксоны мотонейронов С3-С5 образуют диафрагмальные нервы, которые иннервируют мышечные волокна диафрагмы, а аксоны мотонейронов сегментов Т1- Т12 иннервируют наружные и внутренние межреберные мышцы. Активация электрической активности этих мотонейронов под влиянием команд из дыхательного центра вызывает сокращение диафрагмы, наружных или внутренних межреберных мышц, что приводит к изменениям грудной полости в фазу вдоха или выдоха. При глубоком дыхании у человека становится активной фаза выдоха за счет активации экспираторных нейронов вентральной дыхательной группы дыхательного центра Нисходящие команды от экспираторных нейронов дыхательного центра через мотонейроны, иннервирующих мышцы живота и внутренние межреберные мышцы вызывают сокращение экспираторных мышц. Это дает возможность увеличить глубину или частоту дыхания, и в целом, увеличить вентиляцию легких








