

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ФИЗИОЛОГИЯ ДЫХАНИЯ
Методическое пособие для преподавателей
и самостоятельной работы студентов
Ульяновск 2015
ОГЛАВЛЕНИЕ
| 1. | Внешнее дыхание | 3 |
| 1.1. | Механизм вдоха и выдоха | 3 |
| 1.2. | Вентиляция легких | 11 |
| 1.3. | Физиологическое значение паттерна дыхания | 17 |
| 1.4. | Региональные различия вентиляции легких | 21 |
| 1.5. | Физиология дыхательных путей | 21 |
| 2. | Газообмен между альвеолами и кровью легких | 24 |
| 3. | Транспорт газов кровью | 28 |
| 3.1. | Транспорт кислорода кровью | 28 |
| 3.2. | Транспорт углекислого газа от тканей к легким | 32 |
| 3.3. | Транспорт ионов водорода от тканей к легким. Виды гемоглобина | 33 |
| 4. | Регуляция дыхания | 34 |
| 4.1. | Дыхательный центр | 35 |
| 4.2. | Нервная регуляция дыхания | 42 |
| 4.3. | Роль супрабульбарных структур головного мозга в регуляции дыхания | 46 |
| 4.4. | Дыхание в различных условиях | 50 |
| 5. | Лабораторные занятия | 57 |
| Литература | 69 |
Под дыханием высших животных и человека понимают совокупность процессов обеспечивающих поступление во внутреннюю среду организма кислорода, использование его для окисления органических веществ и удаление из организма углекислого газа
Функцию дыхания у человека реализуют:
1. внешнее или легочное дыхание, осуществляющее газообмен между наружной средой и газовым составом альвеол;
2. обмен газами между альвеолами легких и кровью;
3. кровообращение, обеспечивающее транспорт газов к тканям и от них;
4. газообмен между кровью и тканями;
5. внутреннее, или тканевое, дыхание, осуществляющее непосредственный процесс клеточного окисления;
6. средства нейрогуморальной регуляции дыхания.
Результатом деятельности системы внешнего дыхания является обогащение крови кислородом и освобождение от избытка углекислоты. Изменение газового состава крови в легких обеспечивают три процесса:
|
|
1 - непрерывная вентиляция альвеол для поддержания нормального газового состава альвеолярного воздуха;
2 - диффузия газов через альвеолярно-капиллярную мембрану;
3 - непрерывный кровоток в капиллярах легких в соответствии с объемом их вентиляции.
ВНЕШНЕЕ ДЫХАНИЕ.
Механизм вдоха и выдоха.
Аппарат вентиляции состоит из двух анатомо-физиологических образований: грудной клетки с дыхательными мышцами и легких с дыхательными путями. Грудной отдел позвоночника и грудина с четырьмя укрепленными на них 12 парами ребер с дыхательными мышцами вместе с диафрагмой образуют жесткий, подвижный, обладающий эластичностью футляр для легких, который изменяет свой объем вследствие сокращений дыхательных мышц. Вслед за изменением объема грудной клетки легкие пассивно изменяют свой объем, тем самым обеспечиваются фазы дыхательного акта - вдоха или выдоха (рис.1.).
. 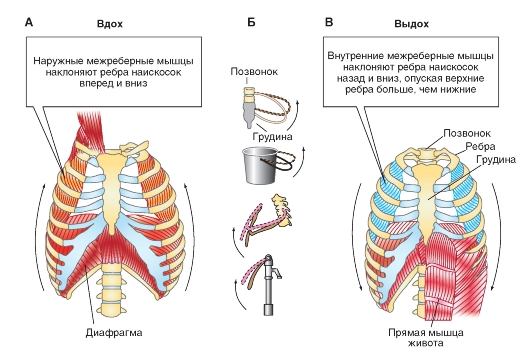 Рис.1. Работа дыхательных мышц. Объяснение в тексте. (Рис. взят из кн. А.Г.Камкин, И.С.Киселева «Атлас по физиологии». Т.2, 2012).
Рис.1. Работа дыхательных мышц. Объяснение в тексте. (Рис. взят из кн. А.Г.Камкин, И.С.Киселева «Атлас по физиологии». Т.2, 2012).
Дыхательные мышцы, за счет деятельности которых осуществляются периодические изменения объема грудной клетки, относятся к поперечнополосатой мускулатуре. Различают инспираторные мышцы (отвечающие за вдох) и экспираторные мышцы (отвечающие за выдох).
Важнейшей инспираторной мышцей является диафрагма. Она представляет собой тонкую куполообразную пластину, прикрепленную к нижним peбрам. К диафрагме подходят нервы от диафрагмального ядра, находящегося на уровне 3 -5 шейных сегментов спинного мозга. При сокращении диафрагмы органы брюшной полости смещаются вниз и вперед и вертикальные размеры грудной полости возрастают. Кроме того, при этом поднимаются и расходятся ребра, приводя к увеличению ее поперечника. При спокойном: дыхании диафрагма смещается примерно на 1 см., а при форсированном дыхании амплитуда ее движений (экскурсий) может достигать 10 см. Парализованная диафрагма при вдохе смещается не вниз, а вверх, в связи с уменьшением внутригрудного давления. Это, так называемое парадоксальное движение, можно увидеть при рентгеноскопии, если попросить больного вдохнуть. Диафрагма является наиболее сильной мышцей вдоха, которая обеспечивает 2/3 вентиляции.
|
|
К основным инспираторным мышцам относятся также наружные межреберные и межхрящевые мышцы. Наружные межреберные мышцы соединяют соседние ребра. Их волокна направлены вперед вниз (рис.2.). При сокращении этих мышц ребра поднимаются и смешаются вперед. Это приводит к увеличению размеров грудной клетки в боковом и переднезаднем направлениях. К этим мышцам подходят межреберные нервы вышележащих сегментов. При параличе межреберных мышц серьезных расстройств дыхания не возникает, так как движение диафрагмы будет обеспечивать вентиляцию.
К вспомогательным инспираторным мышцам относятся лестничные, поднимающие два верхних ребра, и грудино-ключично-сосцевидные, поднимающие грудину. В спокойном дыхании при физиологических условиях эти мышцы практически не участвуют, однако при физической нагрузке могут очень интенсивно работать. Меньшую роль играют мышцы крыльев носа, вызывающие раздувание ноздрей, и мелкие мышцы головы и шеи.
Во время вдоха мышцы преодолевают ряд сил:
1.эластическое сопротивление грудной клетки (после достижения 70% жизненной емкости) и внутренних органов, отдавливаемых книзу диафрагмой:
2.эластическое сопротивление легких;
3.динамическое (вязкое) сопротивление всех перемещаемых тканей;
4.аэродинамическое сопротивление дыхательных путей;
5.тяжесть перемещаемой части грудной клетки;
6.силы, обусловленные инерцией перемещаемых масс.
Энергия мышц, затраченная на преодоление всех видов динамического сопротивления (обусловленное трением), переходит в тепло, и в дальнейшем процессе дыхания не участвует. Остальная часть энергии мышц переходит в потенциальную энергию растяжек всех пластических тканей и потенциальную энергию тяжести перемещаемой части грудной клетки. При расслаблении мышц вдоха под действием пластических сил грудной клетки, внутренних органов и силы тяжести грудной клетки ее объем уменьшается – происходит выдох, который при спокойном дыхании является пассивным актом. При активном форсированном выдохе к перечисленным силам присоединяется сокращение внутренних межреберных мышц и мышц брюшного пресса.
|
|
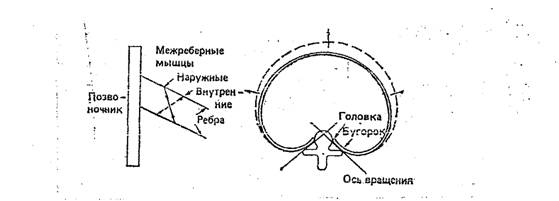
Рис. 2. Схема крепления наружных межреберных и внутренних межреберных мышц.
Какой же механизм обеспечивает пассивное изменение объема легких в результате изменения объемов грудной клетки? Доказательством пассивного изменения объема легких служит опыт на модели Дондерса. Модель Дондерса представляет собой следующее устройство (рис.3).
В емкость (1) с дном из резиновой мембраны, помещаются изолированные легкие (лягушки, собаки и др.), которые сообщаются с атмосферой только через канюлю(3). При оттягивании мембраны вниз (2) (имитация движений диафрагмы), атмосферный воздух входит в альвеолы легких и они расширяются. При прогибании мембраны внутрь емкости легкие спадаются (4, 6 манометры, 5 краник).
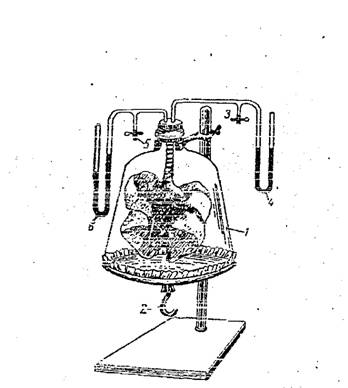
Рис.3. Схема модели Дондерса.
Большое значение в этом механизме имеет эластическая тяга легких. Три фактора определяют эластическую тягу легкого: эластичные волокна легкого и их геометрическое расположение; силы поверхностного натяжения в альвеолах и пленка сурфактанта, выстилающая альвеолы изнутри; крепление каждой альвеолы в окружающей легочной ткани.
Эластическими свойствами обладают не только легкие, но и грудная клетка. Поверхностным натяжением называется сила, действующая в поперечном направлении на воображаемый отрезок длиной 1 см. Эта сила обусловлена тем, что межмолекулярное сцепление внутри жидкости гораздо сильнее, чем на границе ее раздела с газом, поэтому поверхность жидкости становится как можно меньше. Хорошим примером может служить образование мыльного пузыря. Его стенки стремятся максимально сократиться, и в результате образуется сферическая поверхность, площадь которой при данном объеме максимальна. Внутри такого пузыря действует давление, равное по закону Лапласа 4 σ/r, где σ - поверхностное натяжение, а r - радиус.
В выстланных жидкостью альвеолах в создании давления участвует только одна поверхность, поэтому в числителе этого уравнения следует поставить не 4, а 2.
|
|
Первые данные о том, что силы поверхностного натяжения могут иметь значение для растяжимости легких, были получены Нейергардом. Он обнаружил, что легкие, наполненные солевым раствором, растянуть гораздо легче, чем тогда, когда в них находится воздух.
Дальнейшие доказательства были получены при изучении крошечных пузырьков пены из отечных легких животных, отравленных ядовитыми газами. Исключительная стабильность этих пузырьков говорила о крайне низком поверхностном натяжении образующей их жидкости.
Так были сделаны первые шаги к открытию сурфактанта легких.
Сурфактант. Сейчас уже известно, что некоторые из выстилающих стенки альвеол клеток вырабатывают секрет, значительно снижающий поверхностное натяжение альвеолярной жидкости. Точный состав этого секрета пока не выяснен. Показано, что сурфактант представляет собой смесь, которая состоит из фосфолипидов (90-95%) и его важнейший компонент – дипальмитоил-фосфатидилхолин (ДПФХ). Наряду с этим он содержит четыре специфических для сурфактанта протеина (SP-A,SP-B,SP-C, и SP-D), а также небольшое количество угольного гидрата, альбумины плазмы крови и IgA.
Существует два типа альвеолярных эпителиальных клеток. Клетки I типа имеют форму растекшегося яйца с длинными цитоплазматическими выростами, стекающими тонким слоем по стенкам альвеол. Клетки II типа более компактны, и под электронным микроскопом в них видны осъмиофилъные пластинчатые тельца, которые выбрасываются в альвеолы и превращаются в cурфактант. Фосфолипид ДПФХ синтезируется в легких из жирных кислот, либо приносимых кровью, либо образующихся на месте. Синтез и замена сурфактанта пpoиcxoдит очень быстро. Сурфактант образуется лишь на поздних стадиях эмбрионального развития после 32-й недели беременности, достигая максимального количества к 35 неделе.Поэтому, если у новорожденных не хватает этого вещества, то могут возникать расстройства дыхания, подчас приводящие к смерти. До рождения образуется избыток сурфактанта. После рождения этот избыток удаляется альвеолярными макрофагами. Сурфактант регулярно инактивируется и конвертируется в мелкие поверхностно неактивные агрегаты. Примерно 70-80% таких агрегатов поглащают остальной пул мелких агрегатов сурфактанта. Образованию компонентов сурфактанта у плода способствуют глюкокортикоиды, пролактин, гормоны щитовидной железы, эстрогены, андрогены, факторы роста, инсулин, β – адренергические агонисты. У взрослых продукцию сурфактанта регулируют ацетилхолин и простагландины. Синтез сурфактанта находится также под контролем блуждающего нерва.
Каков же механизм действия сурфактанта? Оказывается, молекулы ДПФХ с одного конца являются гидрофобными, а с другого - гидрофильными, поэтому образуют тонкий слой на поверхности воды. Действующие между ними силы молекулярного отталкивания противодействуют силам притяжения между молекулами воды, обусловливающим поверхностное натяжение. В этом случае его уменьшение при снижении площади поверхности объясняется более плотным примыканием друг к другу молекул ДПФХ, за счет чего силы взаимного отталкивания между ними становится больше.
|
|
В чем же состоит физиологическая роль сурфактанта?
1. Снижение поверхностного натяжения на границе «вода-воздух» является главной функцией сурфактанта. Благодаря низкому поверхностному натяжению в альвеолах увеличивается растяжимость легких и, тем самым, уменьшается совершаемая при этом работа.
2. Сурфактант способствует поддержанию относительно одинаковых размеров альвеол в ходе дыхательного цикла, поддерживает стабильность альвеол, что является важным для нормального газообмена.
3. Сурфактант способствует тому, что поверхность альвеол остается сухой. Силы поверхностного натяжения вызывают не только спадение альвеол, но и «засасывание» в них жидкости из капилляров. Сурфактант уменьшает эти силы и тем самым препятствует образованию такого транссудата.
4. Сурфактант предотвращает непосредственный контакт пневмоцитов с посторонними частицами и инфекционными агентами, попадающими в альвеолы с вдыхаемым воздухом. Циклические изменения поверхностного натяжения, происходящие при вдохе и выдохе, обеспечивают зависимый от дыхания механизм чистки. Обволакиваемые сурфактантом пылевые частицы транспортируются из альвеол в бронхиальную систему, из которой они удаляются со слизью.
5. Сурфактант регулирует количество макрофагов, которые мигрируют в альвеолы из межальвеолярных перегородок, стимулируют активность этих клеток. Бактерии, проникающие в альвеолы с воздухом, опсонизируются сурфактантом, что облегчает их фагоцитоз альвеолярными макрофагами.
6. Сурфактант присутствует в бронхиальном секрете, покрывая бронхиолярные экзокриноциты и реснитчатые клетки, и имеет тот же химический состав, что и альвеолярный сурфактант. Вероятно, сурфактант необходим для стабилизации дистальных воздухоносных путей.
Таким образом, при недостатке сурфактанта, возможно, легкие были бы более «жесткими» (менее растяжимы), в них образовывались бы участки ателектаза (спавшиеся альвеолы), а в альвеолы пропотевала бы жидкость. Все это наблюдается при «респираторном дистресс-синдроме новорожденных». Вероятная причина этого синдрома – недостаточная выработка сурфактанта.
Растяжимость легких зависит как от поверхностного натяжения альвеол, так и от тканевых эластических структур легкого. Она выявляется в опытах с легкими, заполненными жидкостью, и определяет их растяжимость. Растяжимость таких легких значительно больше, чем содержащих воздух. Однако при относительно высоком давлении, когда объем легких приближается к максимальному, их растяжимость снижается. Отсюда можно заключить, что основное значение эластических структур легких сводится к тому, что: 1) они вносят свой компонент в эластическое сопротивление легких; 2) предохраняют легкие от перерастяжения. Последнее в физиологических условиях, по-видимому, особенно важно не только по отношению к легким в целом (которые защищены от перерастяжения грудной клеткой), но и для отдельных альвеол и их групп, предельные размеры которых в случаях высокого альвеолярного давления (например, при кашле) лимитируются эластическими свойствами составляющих их тканевых структур.
Следующим обязательным условием пассивного движения легких и изменениями объема грудной клетки является герметичность грудной клетки. В результате этих условий происходит следующее.
Легкие, находящиеся внутри грудной клетки, отделены от ее стенок плевральной полостью (щелью), в которой находится жидкость.
Под влиянием одностороннего влияния атмосферного давления легкие в грудной клетке находятся в растянутом состоянии. За счет того, что легкие обладают эластичностью, давление в плевральном щелевидном пространстве (плевральное давление) меньше альвеолярного на величину, обусловленную эластической тягой легких. Давление в плевральной щели может быть измерено путем прокола грудной стенки полой иглой, соединенной с манометром. Как только игла попадает в плевральное пространство, манометр показывает давление ниже атмосферного. Плевральное давление часто называют отрицательным, принимая уровень атмосферного давления за 0. После спокойного выдоха оно ниже атмосферного примерно на 3-5 см. вод. ст. (0,3-0,5 кПа), а во время спокойного вдоха – на 6 -8 см вод. ст. (0,6-0,8 кПа). Отрицательное давление в плевральной полости стремится сжать грудную клетку, а эластическая тяга самой грудной клетки направлена в противоположную от тяги легких сторону (что облегчает вдох). Соотношение всех указанных сил определяет уровень спокойного дыхания и величину объема воздуха в легких после выдоха – так называемую функциональную остаточную емкость (ФОЕ).
Когда глубина вдоха становится выше 70% жизненной емкости, эластичность грудной клетки начинает противодействовать вдоху, и ее тяга направлена в ту же сторону, что и эластическая тяга легочной ткани.
Увеличение объема грудной клетки при сокращении мышц вдоха приводит к уменьшению давления в плевральной полости. В результате этого объем воздуха в легких увеличивается, а давление его становится ниже атмосферного. Вследствие образующейся разницы между давлением в окружающей среде и в альвеолах наружный воздух поступает по трахеобронхиальным путям в альвеолы.
Уменьшение объема грудной клетки при выдохе приводит к повышению плеврального давления. В результате этого и под действием эластической тяги легких объем воздуха в альвеолах снижается, его давление становится выше атмосферного, воздух начинает выходить наружу. Когда эластическая тяга легких уравновесится понижающим давлением в плевральной полости, выдох заканчивается. Таким образом, действие дыхательных мышц на легкие осуществляется через изменения давления в плевральной полости. Непосредственной же причиной движения воздуха через дыхательные пути при вдохе и выдохе являются колебания альвеолярного давления. При вскрытии грудной клетки (нарушение герметичности плевральной щели, пневмоторакс) наблюдается спадение легких. При пневмотораксе проявляется в полной мере влияние эластической тяги легких на их объем. При пневмотораксе легкие займут объем коллапса, который значительно меньше, чем остаточный объем. Вентиляция легких при разгерметизации плевральной полости становится невозможной.
Скрепление альвеол друг с другом является третьим фактором, который определяет эластичность легкого. Стремление к сжатию альвеол большого объема, которые скреплены с альвеолами меньшего объема, растягивают последние, предотвращая их коллапс. Это эластичное взаимодействие в легочной ткани имеет большое значение для поддержания диаметра маленьких бронхов в легочной ткани. Если уменьшается стремление к ретракции альвеол большого объема, то это может привести к сужению или коллапсу маленьких бронхов и способствовать увеличению сопротивления дыхательных путей.
Таким образом, эластическая тяга легкого (ретракционная сила) не должна быть не слишком большой (плотное легкое; трудности растяжения например, при недостатке сурфактанта), ни слишком маленькой (вялое легкое; коллапс бронхиол например, при эмфиземе).
Вентиляция легких
Обмен воздуха между атмосферой и альвеолами называется вентиляцией легких. Вентиляция легких обеспечивает постоянство состава альвеолярного газа. Она осуществляется прерывно, циклически, путем возвратно- поступательного движения воздуха в ходе чередования инспираторной и экспираторной фаз в работе дыхательной мускулатуры.
Статическими показателями вентиляции легких являются легочные объемы и емкости. Некоторые из этих показателей можно измерить с помощью спирометра или спирографа. Так, если испытуемый при спокойном дыхании делает выдох в спирометр, то получаем дыхательный объём (ДО, глубина дыхания). При каждом вдохе в лёгкие поступает 300 – 800мл воздуха. Если же обследуемый делает максимально глубокий вдох, а затем как можно более глубокий выдох, то регистрируется объём, который соответствует жизненной емкости легких (ЖЕЛ). Однако даже после максимального выдоха в них остается некоторое количество воздуха – остаточный объем (ОО), равный приблизительно 1200мл. При спокойном дыхании кроме дыхательного объема человек может дополнительно вдохнуть ещё около 3000 мл воздуха. Этот объем получил название резервного объема вдоха (РО вдоха). После спокойного выдоха он может выдохнуть еще около 1300 мл - резервный объем выдоха (РО выдоха). Жизненная емкость легких составляется из дыхательного объема,- резервного объема вдоха и резервного объема выдоха. Для характеристики внешнего дыхания определяют также резерв вдоха, равный резервному объему вдоха и дыхательному объему: функциональную остаточную емкость (ФОЕ), как то количество воздуха, которое остается в легких после спокойного выдоха: общую емкость легких (ОЕЛ), то количество воздуха. которое содержится в легких на высоте максимального вдоха: (ОО+ЖЕЛ). Соотношение все выше указанных объемов и емкостей показано в таблице 1.
Таблица 1
Общая емкость легких
|
Общая Мкость легких |
Жизненная Мкость Легких | Резервный объем вдоха |
Емкость вдоха | |
| Дыхательный объём | ||||
| Резервный объём выдоха |
Функциональная остаточная ёмкость |
Уровень спокойного Дыхания | ||
|
Остаточный объём | ||||
Положение грудной клетки после спокойного выдоха рассматривается как стандартное и соответствует моменту расслабления мускулатуры. Это состояние дыхательного аппарата определяют как уровень свободного дыхания, который следует рассматривать как исходную точку для определения всех объемов и емкостей. Легочные объемы обычно выражают в процентах по отношению к общей ёмкости лёгких.
Необходимо также отметить, что все легочные объемы находятся в зависимости от возраста, роста, пола, массы тела. Поэтому их следует сравнивать с должными величинами. Например, по формуле Антони (1962) ДЖЕЛ – должная жизненная емкость – определяется путем умножения основного обмена (рассчитанного по таблицам Гарриса и Бенедикта) на коэффициент 2,6 для мужчин и 2,2 – для женщин. Величину ЖЕЛ нужно выражать в процентах к должной величине. В норме ДЖЕЛ соответствует 100%, а увеличение или уменьшение этого показателя на 15% не являются существенными. Функциональную остаточную емкость и остаточный объем нельзя измерить с помощью простого спирометра. Для этого применим метод разведения газа, например, гелия. ФОЕ также можно измерить с помощью общего плетизмографа.
В качестве динамических показателей внешнего дыхания служат количество дыхательных циклов за одну минуту и легочная вентиляция, определяемая тем количеством воздуха, которое поступает в верхние дыхательные пути за единицу времени.Обычно, за единицу времени берется минута. Поэтому, то количество воздуха, которое поступает в верхние дыхательные пути за l минуту, называют минутным объемом дыхания (МОД) У мужчин в состоянии покоя МОД равняется 4 - 7 литрам, у женщин 3,5 - 6 литрам.
До сравнительно недавнего времени в качестве почти единственного показателя внешнего дыхания использовали минутный объем дыхания (МОД). Но оказалось, что этот интегральный показатель не дает достаточно полной информации ни о самой функции дыхания., ни о ее регуляции. Поэтому не случайно на протяжении последних лет физиологи и клиницисты все большее внимание уделяют анализу отдельных компонентов дыхательного цикла. Всю совокупность объемных и временных параметров, характеризующих структуру дыхательного цикла и легочную вентиляцию в целом, называют паттерном дыхания. В качестве параметров, определяющих паттерн дыхания, входят:
-количество дыхательных циклов за одну минуту (частота дыхания, f);
-длительность отдельного цикла (Тт) - величина, обратная частоте дыхания: Тт = 60/f, с;
- длительность инспираторной и экспираторной фаз (Ti, Те), с;
- доля вдоха в обшей длительности цикла: - отношение Ti / Тт;
- дыхательный объем (глубина дыхания V т), л;
- средние скорости инспираторного и экспираторного потоков получаемые путем деления дыхательного объема на длительность соответствующей фазы (Vi = V т / Ti;
Ve = V т / Те), л/с;
- максимальные, или, точнее, пиковые скорости инспираторного и экспираторного потоков(Vi пик; Ve пик);
- легочная вентиляция (V. л) обычно за минуту, минутный объем дыхания (M0Д), который можно рассчитать как произведение частоты дыхания на его глубину
(V = f х V т), либо средней скорости инспираторного потока на «полезный цикл» и, если поток выражен в л/с. — на 60 (V = V x Ti /Тт х 60).
Наиболее простой способ графической регистрации паттерна дыхания - спирография. Она позволяет непосредственно определять как объемные, так и основные временные параметры дыхательного цикла (рис.4,5).
Другим распространенным и более современным методом регистрации дыхательного паттерна служит пневмотахография. Пневмотахография дает возможность непосредственно измерить скорости инспираторного и экспираторного потоков, в том числе их пиковые значения, что немаловажно, например, в клинической практике. Прохождение кривой скорости потоков через нулевую линию (смена направления) позволяет точно определить границы между фазами дыхательного цикла и, следовательно, их длительность (рис.4). Недостатком данного метода является необходимость интегрирование пневмотахограммы для получения объемных показателей - глубины дыхания, минутной вентиляции. Зато одно из преимуществ пневмотахографии состоит в меньшем сопротивлении потокам воздуха.

Рис.4 Спирограмма и пневмотахограмма дыхательного цикла (по оси абсцисс – длительность вдоха (Ti)и выдоха (Те), по оси ординат слева скорость инспираторного и (положительные) и экспираторного (отрицательные) потоков (стрелки –пиковые значения), мл/с; справа – VT , мл
Рис.взят из монографии Бреслава И.С., 1984.
Парциальные давления СО2 и О2 в альвеолярном воздухе, а значит и парциальные давления этих газов в артериальной крови определяет только альвеолярная вентиляция. Состояние нормальной или измененной альвеолярной вентиляции характеризуют также по величине напряжения СО2 в артериальной крови. Различают следующие виды вентиляции:
нормовентиляция, или нормальная альвеолярная вентиляция, которая подразумевает нормальные значения напряжения СО2 в артериальной крови (у женщин 5,07±0,3 кПа, у мужчин 5,47±0,3кПа);
гипервентиляция подразумевает, что альвеолярная вентиляция превысила потребности обмена веществ. При этом напряжение СО2 в артериальной крови стало ниже нормального уровня;
гиповентиляция подразумевает, что значение напряжения СО2 в артериальной крови превысило нормальный уровень.
. 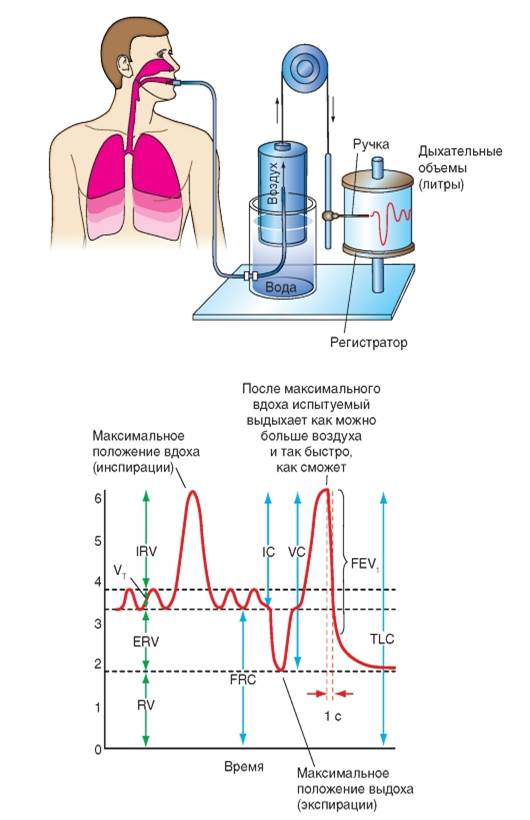
Рис.5. Спирометр и спирограмма. (Рис. взят из кн. А.Г.Камкин, И.С.Киселева «Атлас по физиологии»,2012).
Чисто описательно и без ссылки на газообмен или газы крови вводится ряд понятий для характеристики типа дыхания:
эйпное – нормальное спокойное дыхание;
гиперпноэ – дыхание с повышенным минутным дыханием;
тахипноэ - частота дыхания увеличена;
апноэ- остановка дыхания.
Терминами «диспноэ» и «ортопноэ» обозначают субъективно испытываемую потребность дыхания.
ТРАНСПОРТ ГАЗОВ КРОВЬЮ
Кислород и углекислый газ частично переносятся в крови в физически растворенном виде. Физическое растворение О2 с СО2 подчиняется закону Генри, согласно которому количество растворенного в жидкости газа пропорционально его парциальному давлению, поэтому содержание физически растворенного О2 в крови крайне мало. Из-за своей незначительной физической растворимости О2 транспортируется в основном транспортным протеином-гемоглобином (Hb), на котором атомы железа в геме обратимо связываются с кислородом, т.е. кислород в крови химически связан с гемоглобином.
Транспорт кислорода кровью.
Кислород присутствует в крови в двух формах: растворенный в плазме и в воде, содержащейся в эритроцитах; а также в виде обратимой связи с молекулами гемоглобина в эритроцитах. Растворимость кислорода в жидкости при 37°C очень низкая и составляет 0,225 мл/л-1·кПа-1 (3 мл O2в 1 л плазмы), что недостаточно для жизнедеятельности организма в целом, поскольку в покое в организме человека в минуту потребляется примерно 250 мл кислорода. Проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов.
Гемоглобин - это хромопротеид, представляющий собой тетрамер. Каждый мономер состоит из гема и глобина. Гем - это порфириновое соединение, связанное с одним атомом железа. Глобин - это полипептид, представляющий собой α-цепь (141 аминокислота) и β-цепь (146 аминокислот). Гомология между α-и β-цепью достаточно высока, что дает возможность цепям иметь одинаковые конформации. Таким образом, комплекс гемоглобина имеет форму [α(Гем)]2[β (Гем)]2 и может связывать 4 молекулы О2. При обратимой реакции присоединенная к гему молекула О2 связывается с атомом железа, которое находится во второй степени окисления (т.е. это двухвалентное железо Fe2+). Соединение, образовавшееся в результате связывания называется оксигемоглобин (HbO2), тогда как гемоглобин без О2 называется дезоксигемоглобин (Hb). Это присоединение О2, которое проходит без изменения степени окисления (оксидации) железа, называется оксигенацией (это не оксидация или окисление), отщепление О2 - дезоксигенация. В 96-98% случаев гемоглобин взрослых представляет собой форму HbA1, глобин которого состоит из 2 α-субъединиц и 2 β-субъединиц. В отличие от глобина взрослых, глобин плода гемоглобина HbF состоит из двух α-цепей и двух γ-цепей. Оксигенированная кровь - светло-красная, тогда как дезоксигенированная - синевато-темнокрасная (синюшно-багровый цвет НЬ). Если абсолютная концентрация дезоксигенированного гемоглобина в капиллярной крови повышается более, чем на 50 г/л, то это приводит к посинению кожи и слизистых покровов (цианоз).
Связывание кислорода гемоглобином. Наиболее важным фактором насыщения гемоглобина кислородом является pO2крови. Общее количество кислорода, переносимого гемоглобином в крови, зависит также содержания гемоглобина в крови. Чтобы лучше представить свойства реакции связывания О2 гемоглобином, принимают во внимание только концентрацию О2, связанного с гемоглобином, это значит, концентрацию оксигенированного гема в гемоглобине (HbO2). Ее можно соотнести к кислородной емкости крови, что значит к общей, способной к связыванию, концентрации гемоглобина, и таким образом, получить насыщение О2:
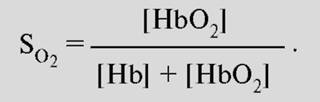
Экспериментально установлена количественная взаимосвязь между этими величинами, которая называется кривой диссоциации оксигемоглобина (рис.7). Кривая диссоциации HbO2 имеет крутой наклон между 10 и 60 мм рт.ст. pO2 относительно пологой части – между 70 и 100 мм рт. ст. Это обусловлено тем, что при pO2 60 мм рт. ст. содержание оксигемоглобина достигает порядка 90%., после чего дальнейшее увеличение pO2 вызывает незначительное связывание кислорода с гемоглобином.
Количество кислорода, которое может связаться с гемоглобином эритроцитов при насыщении 100% его количества, называется кислородной емкостью гемоглобина. 1 г гемоглобина связывает 1,34мл кислорода. Поэтому в норме при концентрации гемоглобина 150г/л каждые 100мл крови могут переносить 20,0мл кислорода. Кислородная емкость крови отражает истинное количество кислорода в крови, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97%, то в 100 мл крови содержится примерно 19,4мл кислорода.
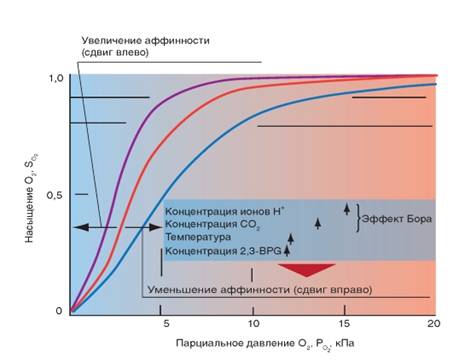
Рис.7. Кривая диссоциации оксигемоглобина.
На кривой связывания О2 (сатурационная кривая) крови (рис.8) показана зависимость между насыщением гемоглобина О2 (SO2) от РО2, так что кривая отражает кислородную емкость крови при разных значениях РО2. Кривая имеет S-образную форму и парциальное давление полунасыщения (Р0,5) в 3,6 кПа. Далее при увеличении значения РО2 насыщение гемоглобина кислородом увеличивается от 75 до 98%. Кривая действительна для приведенных значений, характерных для нормальной артериальной крови. Для сравнения приведена кривая связывания кислорода миоглобином, имеющая форму гиперболы. Как видно из нижнего участка кривой, одинаковой с артериальной кровью, SO2 достигается при меньших значениях РО2. Как видно из верхнего участка кривой связывания кислорода миоглобином, насыщение SO2 мало зависит от РО2.
На связывание гемоглобином кислорода (аффинность, сродство) влияет ряд факторов. При этом, в первую очередь, изменяется положение кривой и форма кривой, но в меньшей степени. Отсюда можно описать уменьшение аффинности как сдвиг кривой связывания гемоглобином кислорода вправо (повышенный Р0.5), а увеличение аффинности, как сдвиг кривой связывания гемоглобином кислорода влево (пониженный Р0,5). Повышение температуры приводит к понижению аффинности, т.е. приводит к сдвигу кривой связывания вправо (рис. 7). Наоборот, охлаждение вызывает сдвиг кривой влево. У гомойотермных организмов значение этого влияния небольшое, хотя температура крови на периферии тела отчетливо может отклоняться от температуры всего организма.
На связывание кислорода гемоглобином оказывает влияние 2,3-дифосфоглицерат. 2,3-дифосфоглицерат образуется в эритроцитах при гликолизе. 2,3-дифосфоглицерат обратимо связывается с гемоглобином, понижая его сродство к кислороду. Содержание в эритроцитах 2,3-дифосфоглицерата увеличивается при гипоксии, например, при пребывании человека в условиях высокогорья, что является одним из факторов адаптации. 2,3-дифосфоглицерат, понижая сродство гемоглобина к кислороду, способствует более легкой отдаче кислорода клеткам тканей и их нормальному кислородному снабжению в условиях недостаточного поступления в организм человека кислорода через легкие.
. 
Рис. 8. Сатурационная кривая О2.
Более важным является влияние концентрации ионов Н+ и РСО2. Повышение концентрации ионов Н+ (понижение рН) вызывает снижение аффинности гемоглобина к кислороду (сдвиг кривой вправо), понижение концентрации ионов Н+ вызывает повышение аффинности гемоглобина к кислороду. Эта зависимость, известная как эффект Бора, осуществляется путем аллостерического обменного влияния (термин «аллостерический» означает «связанный с другим центром») между местом связывания Н+ и местом связывания О2. Эффект Бора может быть связан также с изменением РСО2: повышение РСО2сдвигает кривую связывания О2 вправо, понижение - влево. Это влияние основывается, в первую очередь, на том, что повышение РСО2 ведет
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!