

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Физико-химические методы анализа основаны на взаимосвязи между составом системы и её физическими и физико-химическими свойствами.
Решение аналитической задачи физико-химическими методами обычно разбивается на следующие этапы:
- приготовление стандартных растворов (систем), отличающихся друг от друга только содержанием определяемого вещества;
- количественная оценка (измерение величины) некоторого свойства системы для каждого из стандартных растворов;
- графическое выражение установленной зависимости (построение калибровочного графика) в координатах: концентрация определяемого вещества (по оси абсцисс) – численное выражение свойства (по оси ординат);
- измерение выбранного свойства для исследуемого раствора и определение его концентрации по калибровочному графику.
Функциональная зависимость между численным значением физического или физико-химического свойства системы и содержанием анализируемого вещества может быть выражена графиком или формулой. Если все члены формулы известны, то результат анализа может быть установлен не только графическим, но и расчётным путем.
Классификация физико-химических методов может быть основана на природе обнаруживаемых или определяемых частиц. Различают следующие виды анализа: изотопный, элементный (атомно-ионный), структурно-групповой (функциональный), молекулярный, вещественный, фазовый.
Целью изотопного анализа является установление изотопного состава различных систем. Изотопный анализ широко используется в физике, геологии, биологии. Например, определение дейтерированной воды в обычной воде, «тяжёлого» кислорода (изотоп кислород-18) в смеси с распространённым изотопом – кислородом-16. Изотопный анализ необходим при исследовании искусственных элементов, например трансурановых.
|
|
При элементном анализе необходимо определить, из каких элементов состоит вещество. Вещественный анализ определяет в каких формах присутствуют компоненты в объекте и каково содержание этих форм. Например, в каком химическом состоянии присутствует элемент медь (медь в минерале может быть в виде оксида, сульфида или смеси этих соединений). Вещественный анализ имеет много общего с молекулярным и фазовым анализом.
Молекулярный анализ –это обнаружение и определение химических соединений. Типичным примером является анализ смеси газов. Например, определение в воздухе основных компонентов (азота, кислорода, диоксида углерода, инертных газов, озона) и таких примесей, как оксиды азота или серы. Среди методов молекулярного анализа ныне главенствующее положение занимают хроматографические методы.
Для химиков-органиков, специалистов в области биотехнологии, химической переработки растительного сырья, а также во многих других областях исследований важным является ещё один вид анализа – структурно-групповой (промежуточный между элементным и молекулярным анализом). Его задачей, прежде всего, является определение функциональных групп органических соединений – карбоксильной, гидроксильной, аминной и др.
Задачей фазового анализа является обнаружение включений в неоднородном объекте. Так, например, сульфид и оксид меди не распределены в минерале гомогенно, а образуют отдельные фазы.
Другой способ классификации физико-химических методов базируется на использовании свойств изучаемых систем или физических принципов, на которых основано действие приборов для анализа. В этом случае различают ниже перечисленные группы физико-химических методов, детальная характеристика которых будет дана в соответствующих разделах.
Оптические методы основаны на исследовании оптических свойств анализируемых систем, включают следующие группы методов: фотометрическиий (колориметрия, фотоколориметрия, нефелометрия, турбидиметрия и др.), рефрактометрический, поляриметрический, люминесцентный; спектральный (эмиссионный спектральный анализ, атомно-абсорбционная спектроскопия, спектроскопия в ИК-, УФ- и видимой областях диапазона электромагнитных волн и др.).
|
|
Электрохимические методы основаны на исследовании электрохимических свойств анализируемых систем, включают следующие группы методов: электролитический, кондуктометрический, потенциометрический; полярографический (полярография, инверсионная хронопотенциометрия, амперметрическое титрование и др.).
Термические методы основаны на определении термодинамических свойств систем, включают: дифференциальный термический анализ, термогравиметрию, термографию, калориметрию.
Резонансные методы основаны на исследовании резонансных свойств электронов и ядер некоторых элементов, включают: методы электронного парамагнитного резонанса (ЭПР), ядерного магнитного резонанса (ЯМР), в том числе методы ЯМР высокого разрешения, широких линий, импульсный метод.
Ряд других физических свойстванализируемых систем используется в масс-спектрометрическом, радиохимическом, нейтронно-активаци-онном, рентгено-флуоресцентном методах анализа.
Физико-химические методы разделения и концентрирования основаны на таких явлениях как экстракция, сорбция, ионный обмен и включают хроматографию, диализ, электрофорез и др.
Физико-химические методы анализа позволяют в производственных условиях автоматически контролировать и регулировать технологические процессы. Такой контроль обеспечивает непрерывное наблюдение за производством и автоматическую запись результатов наблюдений. В качестве контролирующих приборов применяют различные автоматические анализаторы.
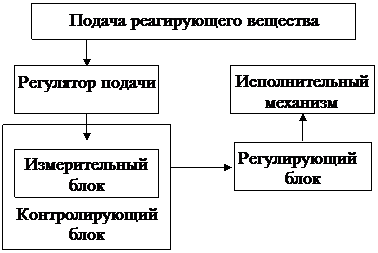
Любой автоматический анализатор состоит из следующих основных частей (рисунок 1.1, а): блока контроля (сосуда, в котором протекают регули-
 |  | ||
а б
а – при помощи автоматического анализатора;
б – при помощиавтоматического регулятора.
Рисунок 1.1 – Схемы автоматического контроля процесса
|
|
лируемые процессы, идёт измерение регулируемых параметров); измерительного блока (прибора, определяющего значение регулируемого параметра); регистрирующего блока (прибора, регистрирующего значения регулируемого параметра, он может быть указывающим или автоматически записывающим).
Схема автоматического регулирования процесса (рисунок 1.1, б) вместо регистрирующего блока включают следующие приборы: регулирующий блок (прибор, обеспечивающий сравнение значений измеренного параметра системы с ранее заданным нормальным параметром для данного технологического процесса, в зависимости от технологического процесса заданный параметр может быть постоянным или переменным); исполнительный механизм (управляется регулирующим блоком в зависимости от регулируемого параметра системы и воздействует на регулятор подачи реагирующего вещества; в некоторых схемах регулятор подачи отсутствует, а его роль выполняет исполнительный механизм).
Действие измерительных блоков основано на измерениях величин, характеризующих некоторые физико-химические свойства – температуру, величину рН, электропроводность, окраску веществ, мутность, электродвижу-щую силу и др. Регулирующими и регистрирующими блоками служат приборы для автоматического непрерывного измерения фототоков, величины рН, температуры, давления, показателей преломления и др. Измеряемые параметры записываются с помощью автоматических регистраторов либо передаются для обработки и регистрации на компьютер.
В биотехнологии физико-химические методы анализа и автоматическое регулирование широко используют в процессах культивирования микроорганизмов, выделения и очистки целевых продуктов. В области химической переработки древесины и растительного сырья физико-химические методы используются для изучения химического состава гидролизных сред, растительных экстрактов, в том числе биологически активных веществ.
Физико-химические методы имеют ряд особенностей, отличающих их от классических методов количественного химического анализа –гравиметрического (весового) и титриметрического (объёмного):
|
|
- первый этап разработки и применения любого физико-химического метода – установление зависимости между составом исследуемой пробы и тем или иным её свойством (зависимость «состав-свойство»), выраженным обычно математически в виде формулы или графика. Так, в потенциометрии используют связь между активностью иона в растворе и потенциалом электрода, в эмиссионной спектроскопии – между интенсивностью излучений определённых длин волн и содержанием отдельных элементов в пробе, переведённых в состояние плазмы. Особенно важно в вышеприведённых примерах то, что при разных формах анализа определяют различные концентрации: потенциометрически определяют активную концентрацию, а методом пламенной фотометрии –общую. Необходимо уметь пересчитывать один вид концентрации в другой;
- еще одна характерная черта физико-химических методов анализа – независимость показателей свойств вещества или системы в обычных условиях от его объёма. Например, потенциал электрода не зависит от того, в какой объём раствора он погружен; интенсивность излучения веществом, которое вводят в пламя горелки, не зависит от общего объёма введённого раствора, а определяется только скоростью его подачи и концентрацией. Это позволяет значительно упростить процедуру исследования;
- кроме того, некоторые физико-химические методы позволяют изучать состав, строение, свойства различных систем без каких-либо химических операций. Современная промышленность выпускает ионоселективные электроды для определения рН, рСа, рК, pNa, pN 03, pNH 4, pCl и др. Такие электроды можно погрузить в исследуемые растворы (например, в питательные среды, культуральные жидкости, гидролизаты растений и др.) непосредственно при контроле технологических процессов и постоянно или периодически снимать показания как визуально, так и в автоматическом режиме.
Метод инфракрасной спектроскопии даёт подробную характеристику важнейших атомных групп и химических связей в неизменённых исследуемых образцах различных материалов, биологических объектов или отдельных соединений. Возможность работать с ненарушенными образцами имеет значение по двум причинам. Во-первых, при помощи этого приёма мы получаем информацию об истинном состоянии исследуемых систем и их компонентов. Во-вторых, именно такие методы позволяют осуществлять дистанционные измерения как при помощи постоянно погруженных датчиков, так и путём измерения спектров поглощения или отражения.
Физико-химические методы анализа – это экспресс-методы. Несмотря на то, что используют дорогостоящую аппаратуру, достигается большая экономия средств и сил благодаря быстроте определения. Большая часть методов обладает и высокой чувствительностью, что значительно расширяет возможности исследования при одновременном снижении расходов на реактивы.
|
|
Чувствительность физико-химических методов. При выборе метода обнаружения и количественного определения малых долей примесей необходимо знать чувствительность, которая показывает минимальные пределы содержания компонента на единицу массы анализируемого материала или на единицу объёма раствора. Чувствительность метода нередко лимитирует величина поправки в контрольном (холостом) опыте, которая зависит от содержания примесей в применяемых реагентах, от примесей, попадающих в контрольное вещество из окружающей среды, от потерь в ходе анализа. Наиболее типичные пути загрязнения: внесение примеси с реагентами, абсорбирующимися из воздуха и десорбирующимися со стенок лабораторной посуды.
Достигаемая чувствительность зависит также от квалификации аналитика и качества измерительной аппаратуры. Каждый прибор имеет свой собственный предел измерений. При работе вблизи границы чувствительности метода возникают большие погрешности, и результаты измерений плохо воспроизводятся. С уменьшением содержания определяемого компонента растет абсолютное значение погрешности. Чувствительность можно характеризовать обнаруживаемым минимумом, величина которого зависит от предельной концентрации, объёма раствора и связанной с этим величиной предельного разбавления. Обнаруживаемый минимум обычно выражают в единицах массы (например, в микрограммах).
Чувствительность также характеризуют минимально обнаруживаемой концентрацией, т.е. наименьшей концентрацией данного вещества, обнаруживаемого в данных условиях данным методом в единицах массы на единицу объёма (моль/л или мкг/мл). Иногда чувствительность выражают в процентах. Предел чувствительности зависит от способа выполнения реакции и других факторов. При инструментальных методах анализа показания любого прибора служат мерой количества определяемого элемента. Для оценки предела чувствительности, т.е. величины разности полезного сигнала и сигнала контрольного опыта или фона прибора, применяют статистические методы.
Минимально определяемое содержание компонента с допустимым уровнем надёжности, выражаемое в массовых единицах, называется абсолютным пределом чувствительности. Минимально определяемое количество элемента, выражаемое в процентах или частях на миллион, называется относительным пределом чувствительности. Для увеличения чувствительности метода необходимо увеличить отношение полезного сигнала к фону. Для сравнения возможностей различных методов иногда чувствительность выражают в граммах в пробе (или просто граммах). В таком случае количество определяемого компонента или соединения относят к минимальной пробе, необходимой для анализа данным методом. Сравнительную чувствительность в этом случае можно представить, как отрицательный логарифм величины. Границу чувствительности некоторых методов можно показать на следующих примерах: весовой и объёмный анализ – 10-2-100 %; колориметрия – 10-5-100 %; кулонометрия – 10-3-100 %; нефелометрия – 10-8-100 %.
Поскольку обычно анализируют большое количество проб, несколько различающихся по составу, значительную роль играет, с одной стороны, воспроизводимость, т.е. близость полученных результатов к какой-то средней величине, с другой – избирательность (селективность), т.е. возможность определения какого-то компонента в присутствии других. В зависимости от чувствительности и количества материала, которое с их помощью можно установить, методы физико-химических анализов малых концентраций квалифицируются как макро- (более 10-1 г), полумикро- (10-2-10-l г), микро -(10-3-10-2 г), ультрамикро -(10-7-10-4 г) и субмикрометоды (10-9-10-7 г).
Контрольные вопросы и задания
1 Какие физические свойства используют при физико-химических методах анализа?
2 Почему в биотехнологии и в технологии химической переработки растительного сырья широко применяют физико-химические методы анализа?
3 Каковы преимущества физико-химических методов анализа перед другими аналитическими методами?
4 Дайте определение терминов «чувствительность метода», «воспроизводимость метода», «селективность метода». Что лимитирует чувствительность анализов?
Оформление результатов эксперимента
Оценка воспроизводимости и правильности анализа – необходимый этап при решении задач физико-химическими методами. Эти показатели существенно зависят от различных видов погрешностей при анализах.
Вне зависимости от источника погрешности (ошибки) по своей природемогут быть грубыми (промахи), систематическими или случайными.
Грубые ошибки возникают, как правило, из-за невнимания и усталости исследователя, временного выхода из строя измерительного прибора. Обычно такие ошибки проявляются при записи измеренной величины на фоне результатов анализов других проб, например ошибка в порядке числа: 12,2 вместо 122 и пр. Для устранения грубых погрешностей требуются повторные измерения. Тщательная и аккуратная работа, контроль помогают избежать грубых погрешностей. Наиболее часто встречаются промахи – явные огрехи анализа, допущенные из-за некомпетентности аналитика. Типичный пример промаха – ошибочный отбор аликвотной пробы в объёмном анализе, когда пипетка, градуированная в двух сечениях, используется как пипетка, градуированная на полное вытекание жидкости.
Систематические погрешности – это односторонние (по знаку) погрешности, вызванные неисправностью измерительного прибора, недостатком метода. Если величина систематической погрешности известна, то учёт её (исключение) не представляет труда. Причины систематической погрешности можно установить при детальном рассмотрении процедуры анализа.
Случайные погрешности, в отличие от систематических, не имеют видимой причины. Точнее говоря, причины их столь многочисленны и каждая из них столь незначительно влияет на общий результат анализа, что рассматривать их индивидуально не имеет смысла. Общая случайная погрешность непостоянна ни по абсолютному значению, ни по знаку, но появление существенной случайной погрешности тем менее вероятно для каждого анализа, чем больше её абсолютное значение. Оценка случайных погрешностей проводится на основе теории математической статистики. К. Гаусс в начале XIX в. показал, что случайные ошибки подчиняются так называемому нормальному закону распределения, из которого следует: чем больше ошибка, тем реже она встречается, а положительные ошибки так же вероятны, как и отрицательные (рисунок 1.2).
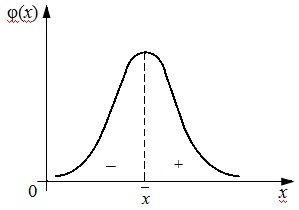
 –среднее значение; φ(x) – относительная вероятность измерения х.
–среднее значение; φ(x) – относительная вероятность измерения х.
Рисунок 1.2 – Кривая плотности вероятности нормально
распределенной случайной величины
 Графики, полученные при многократных анализах в зависимости от наличия в них погрешностей
Графики, полученные при многократных анализах в зависимости от наличия в них погрешностей 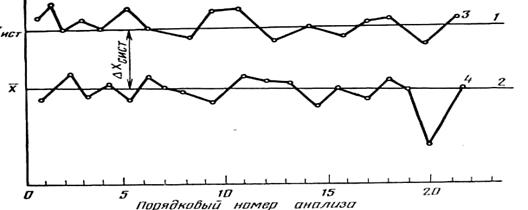 , представлены на рисунке 1.3.
, представлены на рисунке 1.3.
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
 | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
 | |||||||||||||||
1 – безупречный анализ (х ист); 2 – то же с систематической погрешностью ( );
);
3 – ломаная линия, отвечающая эксперименту без систематической погрешности;
4 – реальный случай химического анализа; Δ х сист – систематическая погрешность.
Рисунок 1.3 – Случайные и систематические погрешности при
многократных анализах
На оси абсцисс отложен порядковый номер параллельного анализа из числа многократных определений, на оси ординат – найденные в процессе анализа значения содержания компонента х (Сх). Для наглядности точки, соответствующие результатам отдельных серий анализа, соединены ломаными или прямыми линиями. Прямая 1 отвечает безупречному анализу, когда во всех многократных определениях отсутствуют как систематические, так и случайные погрешности, равно как и промахи. Этот пример, несомненно, идеализирован. Идеализированными считают и примеры, которым отвечают прямая линия 2(отсутствие случайных погрешностей, все результаты анализа отягощены постоянной отрицательной систематической погрешностью) и ломаная линия 3 (отсутствие систематической погрешности, среднее значение определяемой величины совпадает с истинным).
Реальным случаям химического анализа отвечает ломаная линия 4, где результаты анализа осложнены постоянной систематической погрешностью и случайной погрешностью переменной величины. Результат анализа № 20 в четвёртой серии вызывает подозрение, так как он сильно отличается от среднего  . Не исключено, что при выполнении этого анализа допущен промах. Систематическая погрешность характеризует правильность результата. Случайные ошибки определяют его точность и воспроизводимость.
. Не исключено, что при выполнении этого анализа допущен промах. Систематическая погрешность характеризует правильность результата. Случайные ошибки определяют его точность и воспроизводимость.
Для характеристики качества анализа рекомендуется использовать количественно определяемые понятия правильность и воспроизводимость, а термин точность оставлен как качественное понятие, характеризующее и правильность, и воспроизводимость метода одновременно.
Чувствительность анализа выражают как тангенс угла наклона калибровочного (градуировочного) графика. В аналитической химии это означает, что систематические погрешности нельзя устранить многократным повторением анализа, поэтому нужно выявить причины и учесть их при подведении результатов анализа. Случайные погрешности нельзя устранить. Их только можно и нужно свести к минимуму. Чем больше случайный разброс данных при анализе, тем больше должно быть число определений. Усреднение последних даст результат измерений, наиболее близкий к истинному, соответственно, меньше будет вероятность близости единичного результата измерений к истинному значению.
Погрешности могут возникнуть на всех этапах выполнения анализа. При отборе пробы, например, появляются случайные погрешности, связанные с негомогенностью вещества (гетерогенные фазы) или градиентом концентраций (гомогенные фазы). Перечисленных погрешностей нельзя полностью избежать даже при правильном отборе пробы. Неверный отбор пробы приводит к неизбежному преобладанию отдельных компонентов в пробе и возникновению систематической погрешности. Поэтому в процессе подготовки пробы к анализу её обычно растворяют. При этом случайными погрешностями можно пренебречь, а возможность появления систематических погрешностей (загрязнения от реактивов и материала сосудов) будет мала.
Методы разделения, применяемые при подготовке пробы к анализу, могут быть источником больших систематических и случайных погрешностей, связанных с неполным разделением из-за осаждения, частичного растворения, соосаждения, а также влияния на эти процессы изменения температурных условий. Непосредственный процесс измерения неизбежно связан с возникновением случайных погрешностей при получении сигнала, например, в результате температурных колебаний во время работы с пламенным фотометром, а также при трансформировании полученного сигнала в электрический, его усилении и преобразовании (шумы). Описанные случайные погрешности сказываются на результатах, как правило, занижая их. Систематические погрешности измерений и оценки результатов можно устранить точным соблюдением условий работы и правильной градуировкой.
Погрешности измерений и оценки результатов измерений должны быть меньше, чем погрешности самого аналитического метода. При работе с растворами несложно установить, даёт ли данный метод анализа систематические ошибки. Для этого значение, полученное в результате анализа, сравнивают с теоретическим, поскольку известно соотношение компонентов в приготовленном стандартном растворе. По-другому обстоит дело при работе с твёрдыми веществами, когда сложно приготовить стандарт с гомогенным составом. В таком случае правильность метода анализа для часто встречающихся на практике гетерогенных объектов считают доказанной, если найденное значение совпадает с результатом, полученным другим методом, отличным от первого. При расхождении результатов решить вопрос о том, какой из методов даёт систематическую погрешность, можно только с привлечением нескольких (большего числа) методов анализа.
Различают три вида систематических погрешностей. Аддитивные погрешности возникают, если, например, не учитывают расход реагентов на холостую пробу и др. Причиной появления погрешностей другого вида – мультипликативных – служит, например, неверный титр или неправильно проведённая градуировка. К третьему виду относятся погрешности, нелинейно связанные с изменяемой величиной. Причины их появления многообразны и должны быть определены в каждом конкретном случае.
Метод анализа, полностью свободный от систематических погрешностей, не свободен от случайных погрешностей. Выявление случайных погрешностей можно осуществить при статистическом описании вероятности их появления в процессе анализа определённого числа проб. Погрешности можно выразить в абсолютных единицах с размерностью определяемых величин (мг, моль, моль/л и т.д.) и относительных единицах (обычно %).
Точность метода анализа – довольно сложная его характеристика, в которой необходимо различать две стороны: воспроизводимость и правильность.Воспроизводимость измеряют отклонением отдельных результатов от среднего значения, правильность – отклонением среднего значения от истинного.
Воспроизводимость – необходимый, но недостаточный признак правильности результатов. Без удовлетворительной воспроизводимости нельзя ожидать и точности. Однако даже хорошая воспроизводимость вовсе не доказывает точность метода. Воспроизводимость устанавливается по обычным правилам статистической обработки результатов, её расчёт не вызывает затруднений.
Однако никакая математическая обработка результатов не может решить вопрос об их правильности или неправильности. Этот вопрос может быть решён только экспериментально, при помощи следующих приёмов:
- выполнение анализа другим методом;
- способ добавок, т.е. перед началом анализа в образец вводят точное количество вещества, подлежащего определению;
- полный анализ и учёт возможного влияния других элементов;
- параллельный анализ стандартного образца, близкого по составу.
Осуществление любых опытов, в том числе и определений физико-химическими методами, почти всегда предполагает не одно, а ряд повторных измерений, результаты которых будут пригодны для дальнейшей статистической обработки. Отдельные измерения всегда отличаются друг от друга, их разброс определяет точность анализа и характеризуется случайной погрешностью наблюдения. Погрешности связаны с несовершенством наших органов чувств, изменением внешних условий (температуры, влажности, давления), случайными причинами, например, грязными стенками бюретки, заеданием стрелки прибора и др.
Среднее значение полученного результата по разным причинам может отличаться от истинного. Разница между ними определяет правильность определения и представляет собой систематическую погрешность, которая повторяется от опыта к опыту. Причиной случайной погрешности могут быть несовершенство приборов, влияние посторонних компонентов, загрязнение реактивов и др.
Обработка результатов измерений включает следующие процедуры:
- определение среднего арифметического (n) по данным нескольких параллельных измерений;
- вычисление стандартного отклонения (S) по формуле
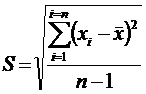 ; (1.1)
; (1.1)
- вычисление при необходимости величины стандартного отклонения среднего значения по формуле
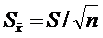 . (1.2)
. (1.2)
Математическая теория погрешностей требует определения ещё одной величины – точности прямого измерения (ε). Эту величину определяют по уравнению, вывод которого можно найти в математической теории погрешностей. При использовании этого уравнения задаются значением надёжности (α), т.е. долей случаев, в которых при данном числе измерений среднее арифметическое лежит в определённых пределах. При физико-химических и аналитических измерениях обычно принимают α = 0,95 или α = 0,99. Это означает, что 95 или 99 % всех измерений лежит в указанных пределах:
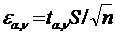 . (1.3)
. (1.3)
Коэффициент tα , ν называют коэффициентом нормированных отклонений, или критерием Стьюдента, его величину находят по специальным таблицам в зависимости от α и v = n – 1. Величину v называют числом степеней свободы. Коэффициенты нормированных отклонений для значений α,равных 0,95 и 0,99 приведены в таблице 1.1.
Таблица 1.1 – Коэффициенты нормированных отклонений tα , ν
| α | v = n – 1 | ||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 0,95 | 4,30 | 3,18 | 2.78 | 2,57 | 2,45 | 2,37 | 2,31 | 2,26 | 2,23 |
| 0,99 | 9,93 | 5,84 | 4.60 | 4,03 | 3,71 | 3,50 | 3,36 | 3,25 | 3,17 |
Математическая теория погрешностей позволяет определить грубые
погрешности (d груб) при помощи трех критериев:
- по стандартному отклонению, тогда
d груб > 3 S / 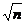 ; (1.4)
; (1.4)
- по точности прямого измерения, тогда
d груб > εα,ν  ; (1.5)
; (1.5)
- по Q -критерию, который вычисляют по формуле
Q = (x 1 – x 2)/ R, (1.6)
где R – размах варьирования.
Грубой погрешностью считают ту, для которой Q -критерий больше табличного, определённого в зависимости от числа степеней свободы v и надёжности α. Значения этого критерия приведены в таблице 1.2.
Таблица 1.2 – Значения Q -критерия
| α | v = n – 1 | |||||||
| 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 0,95 | 0,94 | 0,77 | 0,64 | 0,56 | 0,51 | 0,48 | 0,46 | 0,45 |
| 0,99 | 0,99 | 0,89 | 0,76 | 0,70 | 0,64 | 0,58 | 0,53 | 0,48 |
Первые два критерия наиболее точные, но требуют полного расчёта погрешностей. Q -критерий часто позволяет исключить грубые погрешности, что может значительно сократить время обработки результатов. После исключения грубых погрешностей точность измерений значительно повышается. Таким образом, стандартное отклонение S, а также точность прямого измерения ε характеризуют точность результатов наблюдения (если для данной серии опытов можно вывести среднее значение). В некоторых случаях из серии наблюдений среднее вывести нельзя. Например, сравнивают результаты определений, полученные для разных навесок анализируемого вещества. В этом случае в качестве критерия точности измерений применяют стандартное отклонение S.
Если измерения сделаны неточно, то полученные значения измеряемых величин резко различаются, а квадратичная погрешность слишком велика. Если же наблюдатель внимателен и строго следит за тем, чтобы условия работы были одинаковыми, то результаты наблюдения близки. Для оценки точности наблюдений сравнивают значение стандартного отклонения S с точностью отсчётов на применяемых приборах. Если оно лежит в пределах точности отсчётов, то измерения проведены удовлетворительно. Для уменьшения стандартного отклонения иногда повторяют наблюдения или увеличивают их число, при этом всегда обращают особое внимание на точность отсчётов. В результате можно составить поэтапную схему обработки результатов измерений:
- определение среднего значения ряда вариантов;
- установление отклонения полученного значения от среднего для каждого варианта;
- определение стандартного отклонения;
- нахождение по таблицам коэффициента нормированных отклоне-ний при заданной надёжности и числе вариантов;
- определение точности прямого измерения;
- установление грубых просчётов по какому-либо критерию;
- повторная обработка данных по этой же схеме после исключения грубых просчётов (если снова обнаруживается необходимость исключения вариан-тов, что указывает на некачественный эксперимент);
- если грубый просчёт прерывает ряд вариантов, следовательно, в эксперимент вкралась ошибка, он должен быть повторён заново;
- при выполнении анализов физико-химическими методами погрешности могут возникать на разных этапах, наиболее важные среди них: отбор средней пробы и взятие навески, подготовка навески к анализу (растворение, выделение анализируемого вещества, осуществление аналитической реакции и т.д.), выполнение физико-химического измерения.
На каждом из этапов возникающие стандартные отклонения различны по величине. Общее стандартное отклонение определяется по формуле
S ∑ = 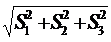 . (1.7)
. (1.7)
В некоторых случаях необходимо определить стандартные отклонения на каждом из указанных этапов:
- чтобы определить погрешность физико-
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!