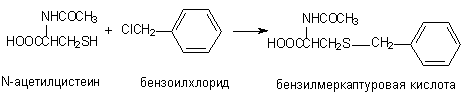В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырёк - микросому, отсюда и название - микросомальное окисление. Эта система обеспечивает первую фазу обезвреживания большинства гидрофобных веществ.
В ходе первой фазы в структуру вещества RH вводится полярная группа ОН-.
Далее происходит реакция конъюгации; конъюгат в зависимости от растворимости и молекулярной массы удаляется либо почками, либо с фекалиями.
Вторая фаза - реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными системами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма.
Существуют два основных способа биотрансформации различных веществ в печени.
· Первый из них заключается в химической модификации активного участка вещества путем окисления, восстановления, гидроксилирования, сульфоокисления, дезаминирования, деалкилирования или метилирования. В этих процессах участвуют микросомальные ферменты (монооксигеназы, связанные с цитохромом Р450 и b5), цитоплазматические глутатионтрансферазы и т. д. В результате этих биохимических реакций обычно происходит инактивация лекарственных веществ (например, бензодиазепинов).
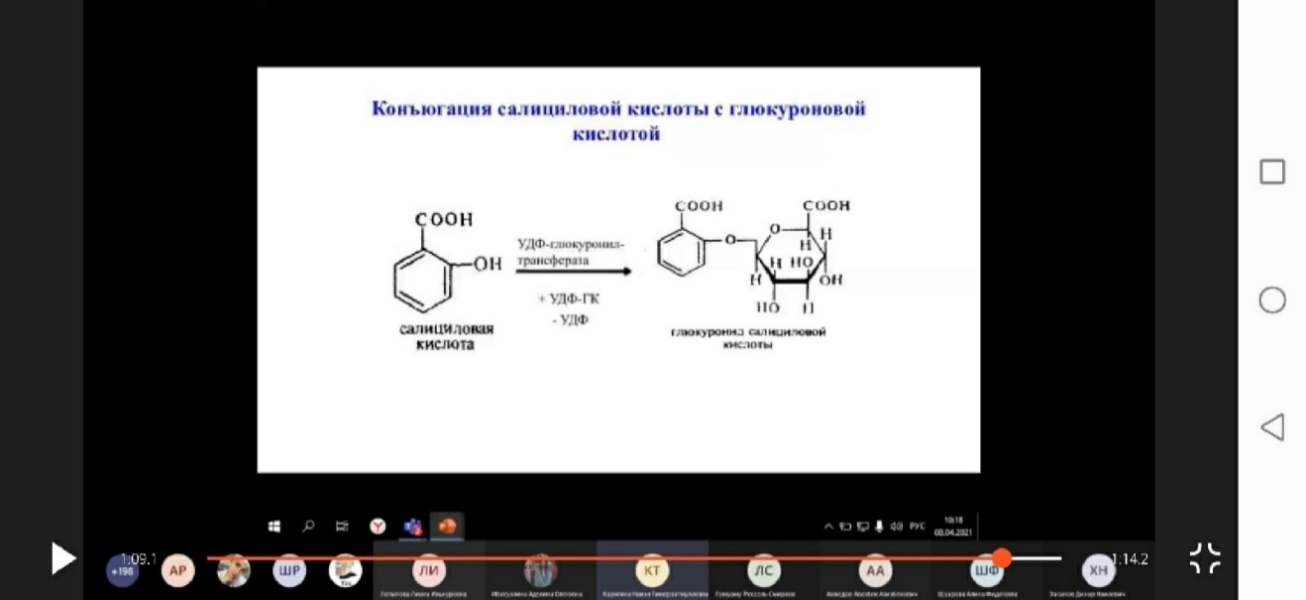
· Второй способ печеночной элиминации - это перевод жирорастворимых веществ в водорастворимые (глюкурониды, сульфаты, ацетильные, тауриновые и глициновые производные), которые затем выводятся с мочой или желчью. Наиболее часто происходит реакция конъюгации с глюкуроновой кислотой, катализируемая глюкуронилтрансферазами. Как правило, конъюгированные формы более водорастворимы и менее активны, чем исходные.
Первый тип реакций конъюгации.
1) Конъюгация с глюкуроновой кислотой; источником является УДФ-глюкуроновая (уридиндифосфат) кислота. Глюкуронидной конъюгации подвергаются природные соединения (билирубин, стероидные гормоны и др.), ксенобиотики (фенолы, стероиды, морфин, левомицетин,). В реакцию вступают субстраты, которые имеют гидроксильную, карбоксильную или аминогруппу. Процесс конъюгации приводит к образованию эфиров глюкуроновой кислоты - глюкуронидов. Ферменты - УДФ-глюкуронилтрансферазы локализованы в эндоплазматической сети клеток печени, в меньшей степени - в почках, пищеварительном тракте, коже.
 глюкуроновая кислота
глюкуроновая кислота
RXH + УДФ-глюкуронат —► RX-глюкуронид + УДФ 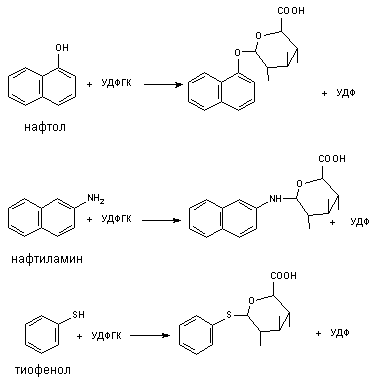
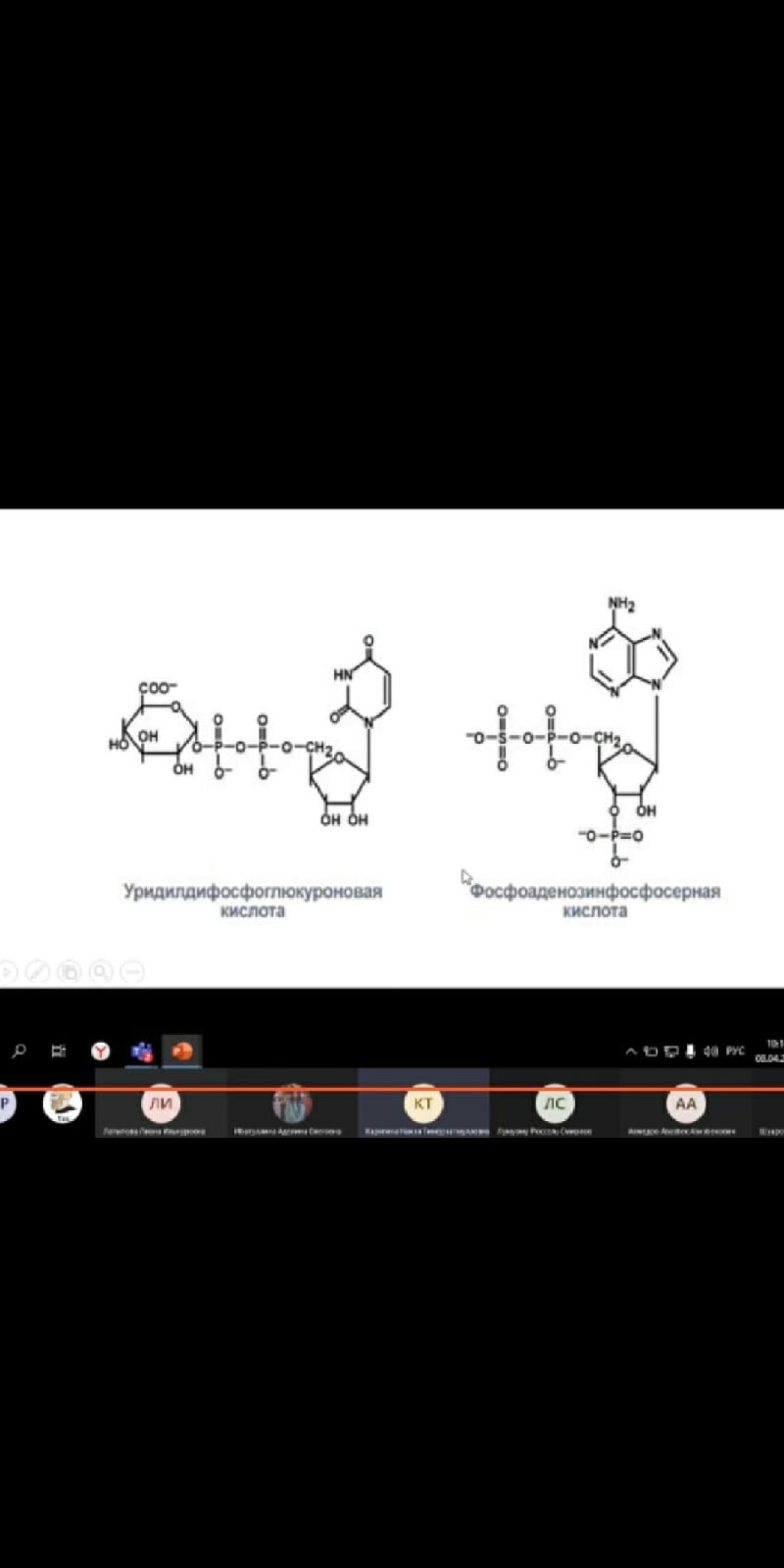
2) Сульфатная конъюгация; активной формой серной кислоты является 3'-фосфоаденозин-5'-фосфосульфат (ФАФС). Сульфатной конъюгации подвергаются эндогенные токсические продукты гниения белков в кишечнике (индол, скатол, фенолы), а также стероиды, йодтиронины, токоферолы, нафтохиноны и др. Происходит, в основном, в печени. Ферменты - сульфотрансферазы.
RXH + ФАФ~S03Н -> RX-SO3H + ФАФ 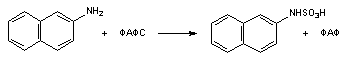
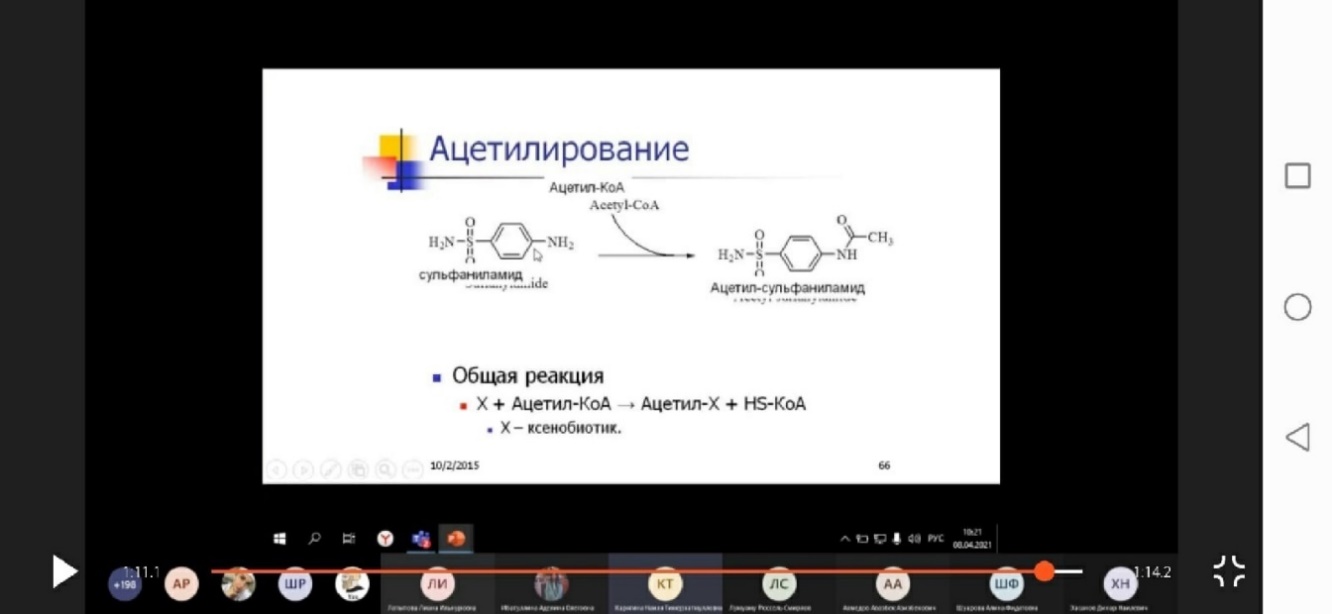
3) Ацетильная конъюгация. Происходит в печени, а также в слизистой пищеварительного тракта и в ретикулоэндотелиальных клетках селезенки и легких. Источник ацетильных групп - ацетил-КоА. Ферменты -ацетилтрансферазы. Этому типу конъюгации подвергаются вещества, имеющие свободную аминогруппу (серотонин, гистамин, сульфаниламиды, гидразиды изоникотиновой кислоты и др.).
R-NH2 + ацетил-КоА -> R-NH-CO-CH3 + HS-KoA.

4) Метильная конъюгация; В качестве донора метильной группы выступает метионин в форме S-аденозилметионина (SАМ), ферменты - метилтрансферазы. Метильной конъюгации подвергаются фенолы, амины, тиоловые соединения. Образуются соответственно О-, N- и S-метиловые конъюгаты. Процесс наиболее интенсивен в печени.
R-OH + СНз-SAM -> R-O-CH3 + SАМ

Среди эндогенных веществ, таким образом, метаболизируют адреналин, норадреналин, дофамин. При этом образуются малоактивные 3-метоксипроизводные катехоламинов.
5) Тиосульфатная конъюгация используется при обезвреживании цианидов. Конъюгирующим веществом является сера тиосульфата. Источником тиосульфата в тканях являются серосодержащие аминокислоты. Конъюгация происходит с цианидами неорганического (синильная кислота, цианиды натрия, калия) и органического (ацетонитрил, акрилонитрил, бензилцианид и др.) происхождения.

Второй тип реакций конъюгации
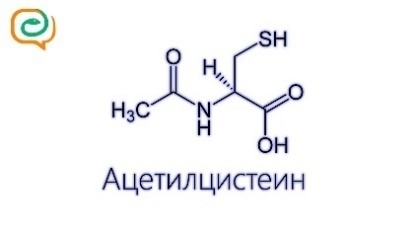
1) Конъюгация с глутатионом и цистеином. Алифатические и ароматические соединения, содержащие в молекуле атомы галогенов, в организме могут взаимодействовать с SH-содержащими эндогенными соединениями: цистеином, ацетилцистеином, глутатионом и т.д.
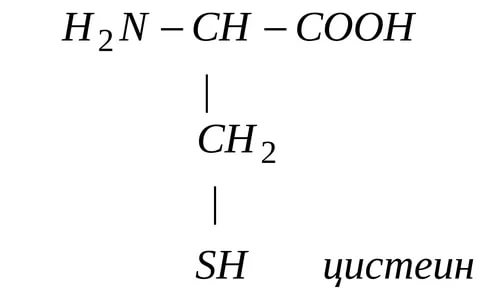
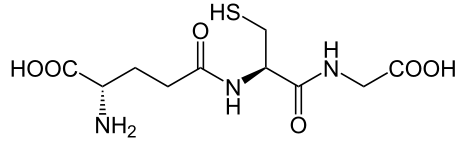 глутатион
глутатион
Реакции конъюгации глутатиона с ксенобиотиками катализируют ферменты глутатион-S-трансферазы (GST). Их активность индуцируется при поступлении в организм различных ксенобиотиков. В подавляющем большинстве случаев взаимодействие ксенобиотиков с глутатионом приводит к их детоксикации. 
2) Реакции конъюгации с аминокислотами. Предварительно происходит активация ксенобиотика (ароматических и гетероциклических карбоновых кислот). Глициновые конъюгаты обозначают как «гиппуровые» кислоты.


Аналогичным образом происходит взаимодействие ксенобиотиков с цистеином и ацетилцистеином:
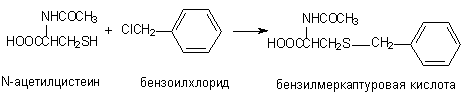

115. Процессы свободнорадикального окисления. Активные формы кислорода: супероксиданион, гидроксилрадикал, пероксид водорода, гипогалогениды, NО. Их значение в норме и при патологии.
Свободное окисление протекает при участии свободнорадикальных форм кислорода, которые образуются в процессе одноэлектронного восстановления кислорода и прежде всего супероксид-аниона кислорода.
Реакции свободнорадикального окисления протекают в активном центре соответствующих ферментов. Эти процессы приводят к образованию супероксид-аниона кислорода.
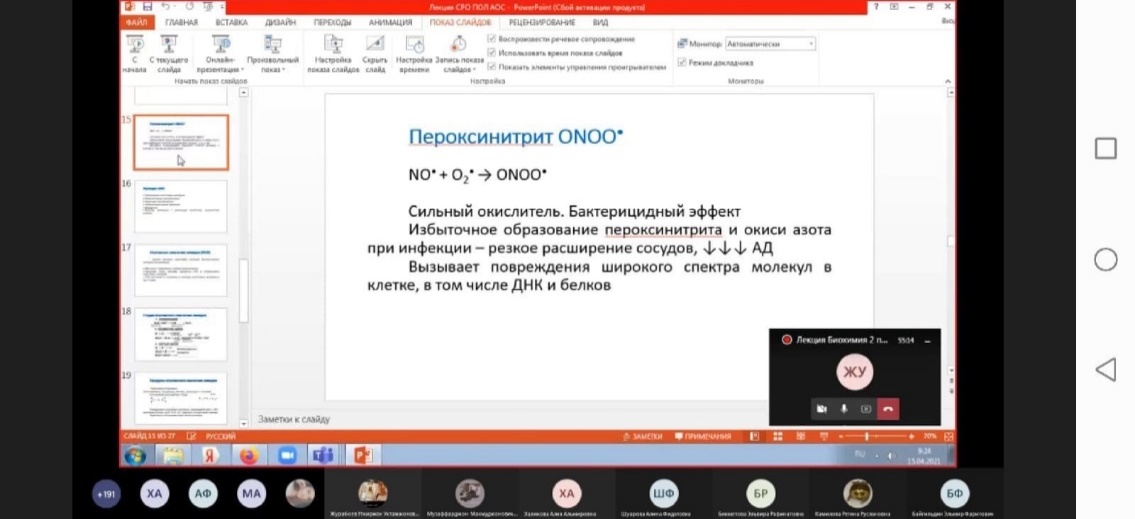
Образование супероксид-аниона кислорода имеет важное биологическое значение. Он является высокореакционным соединением, которое следствие высокой гидрофильности не может покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей. Он способен активировать NO-синтазу, которая образует в тканях NO-радикал, обладающий свойствами вторичного посредника (активирует растворимую гуанилатциклазу, продукт которой – цГМФ – проявляет вазодилататорные свойства). С другой стороны, супероксид-анион способен снижать содержание NO-радикала, превращая его в пероксинитрит ONOOH.
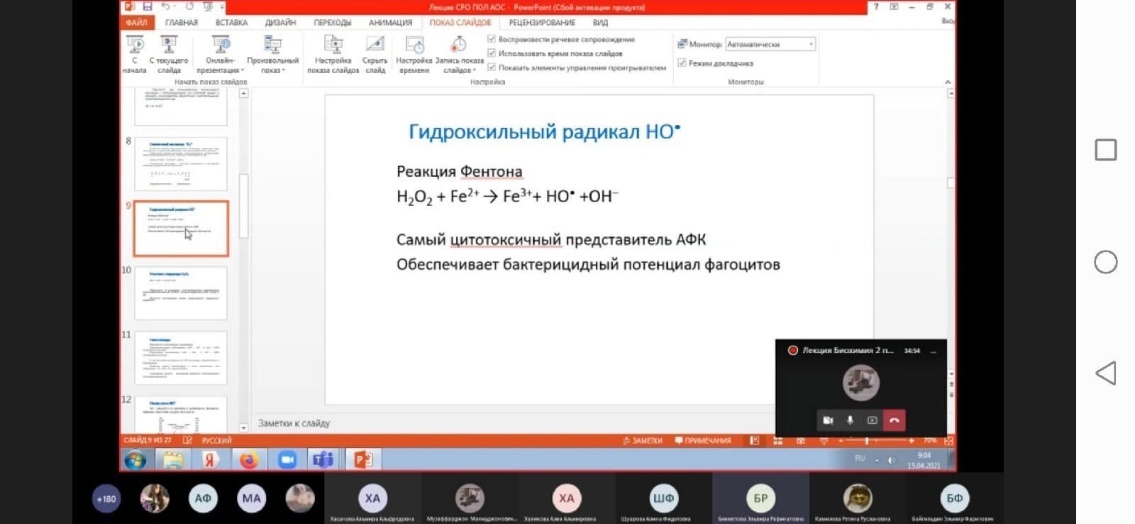
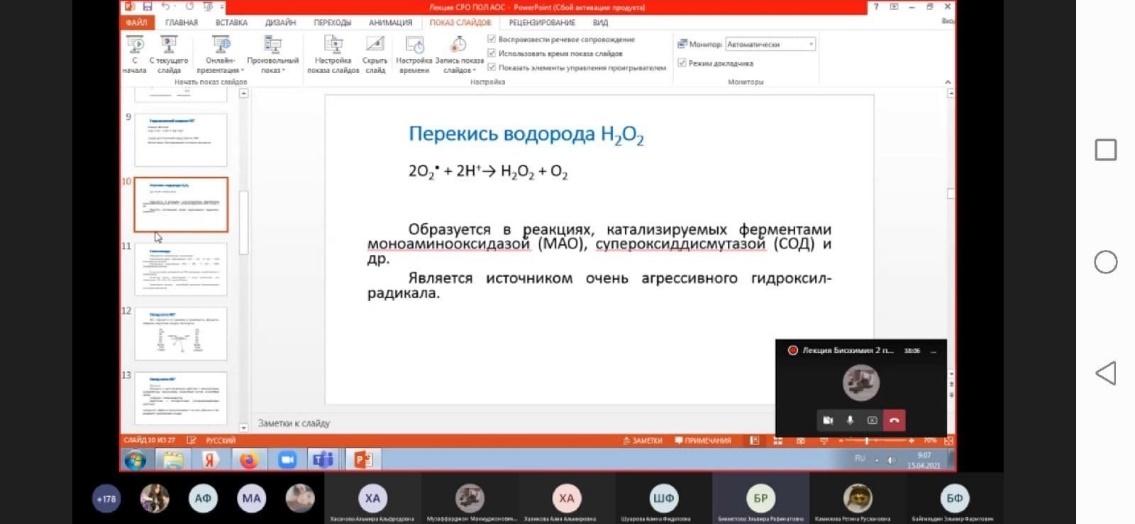
Фермент супероксиддисмутаза превращает супероксид-анион кислорода в менее реакционноспособный и более гидрофобный пероксид водорода Н2О2. Пероксид водорода является субстратом каталазы и глутатионзависимых пероксидаз, которые катализируют его превр 
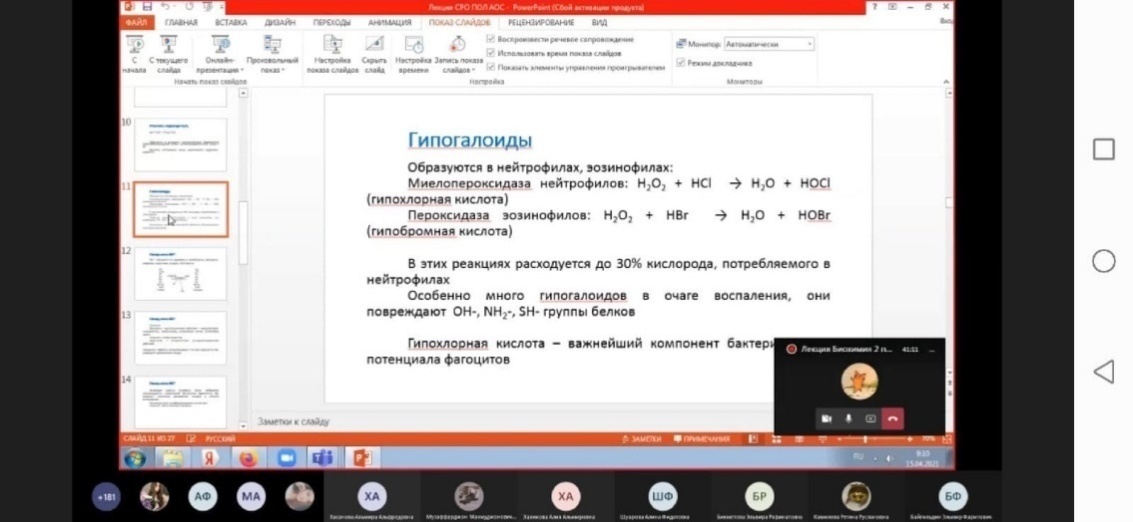
ащение в молекулу воды. Однако пероксид водорода может генерировать гидроксил-радикал в присутствии двухвалентного железа или превращаться в гипохлорит-анион ОСl
– ферментом миелопероксидазой.
Как гипохлорит-анион, так и гидроксил-радикал являются сильными окислителями. Они способны модифицировать белки, нуклеиновые кислоты, индуцировать перекисное окисление липидов (от которого наиболее сильно «страдают» полиненасыщенные мембранные липиды) и в результате цепных реакций приводить к множественным нарушениям мембран и к гибели клеток. Важным дополнением этих реакций является способность NO-радикала при взаимодействии с супероксид-анионом образовывать пероксинитрит, который может индуцировать так называемый апоптоз (запрограммированная гибель клеток), а в ходе своего спонтанного распада превращаться в гидроксил-радикал.
Активные формы кислорода(АФК)
- 2% клеточного кислорода превращается в АФК, которые являются побочными продуктами кислородзависимых реакций
- АФК-свободные радикалы-молекулы, имеющие неспаренный электрон на молекулярной или внешней атомной орбитали
- Благодаря неспаренному электрону имеют высокую реакционную способность
Источники АФК
- Дыхательная цепь
- Микросомальное окисление
- Окисление гемоглобина
- Родиолиз воды


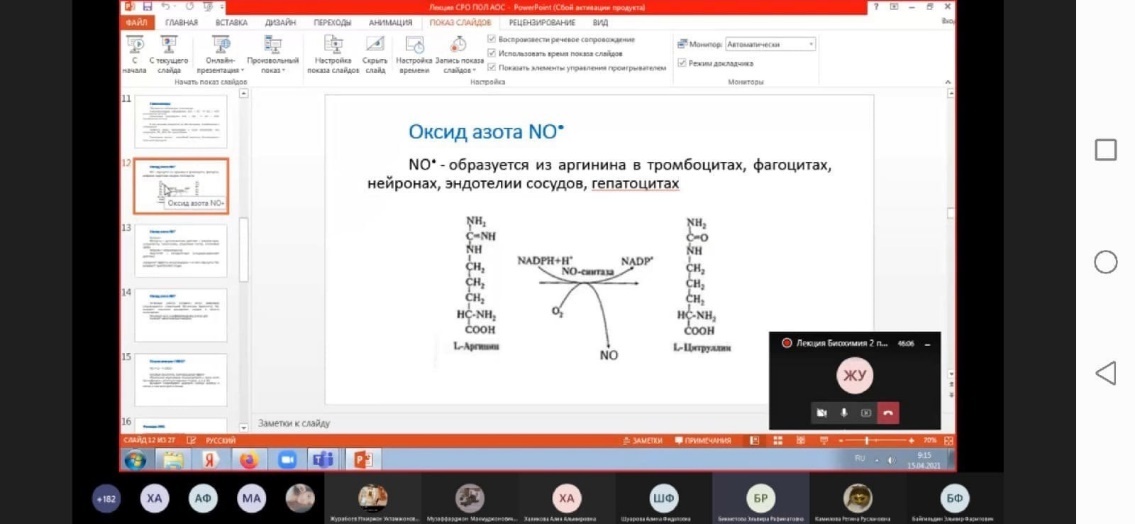
Оксид азота
Функции
Фагоциты-цитотоксическое действие—микобактерии, сальмонеллы, токсоплазмы, опухолевые клетки, патогенные грибы
Нейроны-нейромедиатор
Эндотелий-вазодилатация(сосудорасширяющее действие)
определяет эффекты нитроглицерина—из него образуется NO, расширяет кровеносные сосуды
Оксид азота NO
Активация работы головного мозга (нейронов) сопровождается стимуляцией NO-синтазы. Выделяется NO, вызывает локальное расширение сосудов в области возбуждения
Регулирует рост и дифференцировку клеток ЦНС
Улучшает синаптическую передачу
Функции АФК
· Обновление клеточных мембран
· Межклеточная сигнализация
· Агрегация тромбоцитов
· Нейромедиаторные функции
· Фагоцитоз
· Фактор эволюции—регуляция апоптоза, количества клеток
Высокореакционные свободные радикалы кислорода, характеризующиеся высоким окислительным потенциалом и способностью к быстрым превращениям, могут индуцировать цепные реакции. В настоящее время признается важная роль свободнорадикальных процессов в развитии возрастных и патологических состояний в тканях. Свободнорадикальные превращения вовлекаются в механизмы, повышающие выживаемость клеток в неблагоприятных условиях, а снижение генерации свободных радикалов в организме способствует ослаблению клеточного иммунитета. Однако усиленная генерация свободных радикалов сопровождает патологические состояния (болезнь Паркинсона, Альцгеймера) и сам процесс биологического старения.
| Вид
АФК
| Хим.
символ
| Время полужизни при
T 37 ºC, c
| Свойства
|
| Супероксид-радикал
|
О2
|
10–6
| Хороший восстановитель, умеренный окислитель. Обладает свойствами внутриклеточного мессенджера: сигнальный механизм при взаимодействии различных подтипов глутаматных и аспартатных рецепторов, регуляция активности хлорных каналов, индукция образования пор в митохондриальной мембране. Участвует в окислительной модификации SН- и NН2-групп низкомолекулярных соединений. Вазоконстриктор. Антисептик
|
| Гидроксил-радикал
|
НО•
|
10–9
| Мощный окислитель. Чрезвычайно активен в реакциях акцептирования и переноса электронов. Участвует в окислительной модификации нуклеиновых кислот, белков, липидов, простагландинов. Диффундирует на очень малые расстояния
|
| Перекись водорода
|
Н2О2
|
10–100
| Оксидант, характеризуется малыми скоростями взаимодействия с органическими субстратами. Обладает высокой диффузной способностью. Обладает свойствами мессенджера: активация факторов транскрипции NF-κB, АР-1, редокс-регуляция экспрессии генов
|
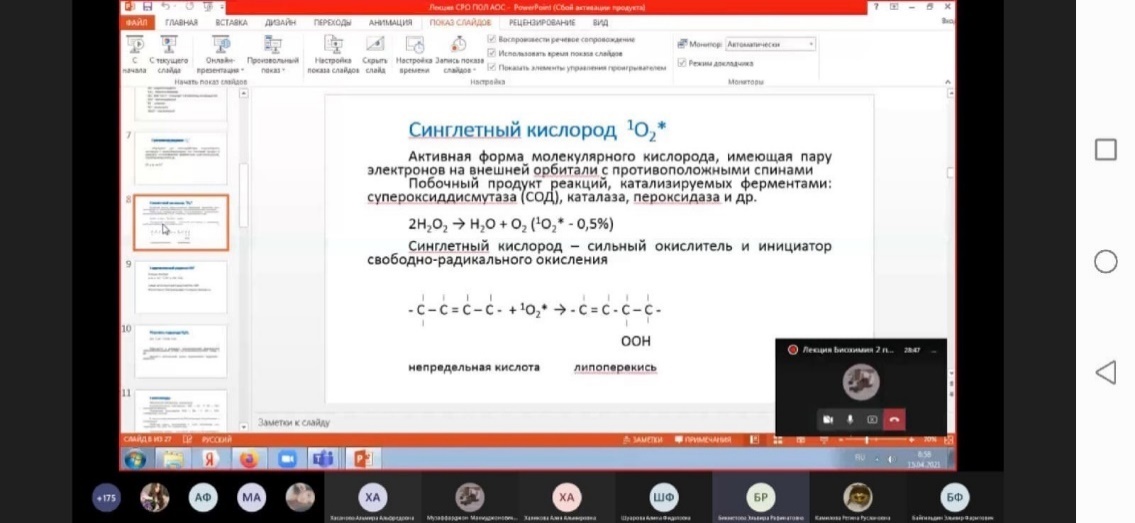
| Синглетный кислород
|
1О2
|
10–6
|
Мощный окислитель
|
| Пероксильный радикал
| ROO•
| 10–2
| Характеризуется низкой окислительной активностью по сравнению с НО•, но более высокой диффузией. Участвует в регуляции гемодинамики. Вазодилататор
|
| Алкоксильный радикал
| RO•
| 10–6
| Эффективен при взаимодействии с липидами, приводит к их окислительной модификации. Окислительные свойства на уровне НО•
|
| Монооксид азота
| NO•
| 10–3
| Умеренный окислитель, хорошо диффундирует, хороший восстановитель. Обладает свойствами медиатора, вторичного мессенджера или нейромодулятора. Участвует в образовании межнейрональных контактов, экспрессии генов, иммуногенезе, активации гуанилилциклазы. Вазодилататор
|
| Перокси-нитрит
| ONOO–
| 10–7
| Мощный окислитель. Участвует в реакции нитрования белкового тирозина, окислении SH-групп и металлопротеинов, разрыве цепей ДНK, активирует поли-(АДФ-рибоза)-полимеразу, регулирует уровень внутриклеточного НАД. Характеризуется более низкой, чем у NO•, но более высокой, чем у НО•, диффузной способностью
|
| Гипохлорит
| OСl–
| 10–6
| Мощный окислитель. Характеризуется более высокой, чем у ONOO–, диффузной способностью, участвует в окислении тиоловых и дисульфидных групп белков и ДНK, хлорировании тирозина. Является редокс-регулятором клеточного сигнала через тирозинкиназу
|
116. Перекисное окисление липидов (ПОЛ) в биологических мембранах. Свободнорадикальный механизм ПОЛ. Роль процессов ПОЛ в норме и при патологии. Антиоксиданты и антиоксидантные ферменты (супероксиддисмутаза, каталаза, пероксидаза, глутатионтрансфераза).
ПОЛ — цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнорадикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалентные «сшивки», всё это активирует протеолитические ферменты в клетке, гидролизующие повреждённые белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание Fe2+ молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
В результате свободнорадикального окисления жирных кислот образуются гидроперекиси и диеновые конъюгаты (первичные продукты), которые очень нестабильны. При участии металлов переменной валентности они быстро метаболизируют во вторичные (альдегиды и диальдегиды) и третичные (шиффовы основания) продукты перекисного окисления липидов.
В норме они поддерживаются на определенном уровне и выполняют ряд функций:
1. индуцируют апоптоз (запрограммированную гибель клеток);
2. регулируют структуру клеточных мембран и тем самым обеспечивают функционирование ионных каналов, рецепторов, ферментных систем;
3. обеспечивают освобождение из мембраны арахидоновой кислоты, из которой синтезируются биорегуляторы (простагландины, тромбоксаны, лейкотриены);
4. ПОЛ может выступать в качестве вторичного мессенджера, участвуя в трансформации сигналов из внешней и внутренней среды организма, обеспечивая их внутриклеточную передачу;
5. АФК участвуют в клеточном иммунитете и фагоцитозе.
Активация ПОЛ характерна для многих заболеваний и патологических состояний:
1. атеросклероз и другие сердечнососудистого заболевания;
2. поражения ЦНС (болезнь Паркинсона, Альцгеймера);
3. воспалительные процессы любого генеза;
4. дистрофия мышц (болезнь Дюшенна);
5. онкологические заболевания;
6. радиационные поражения;
7. бронхолегочные патологии.
Повышение ПОЛ при патологии приводит к:
1. Разрушению, фрагментации клеточных мембран, повреждению и гибели клеток.
2. ПОЛ модифицирует ЛП, особенно ЛПНП. Они легче проникают в сосудистую стенку, лучше захватываются макрофагами, что ускоряет развитие атеросклероза.
3. Продукт ПОЛ малоновый диальдегид (МДА) - токсичен, канцерогенен, мутагенен.
4. ПОЛ ускоряет процесс старения организма.
Ферментные антиоксидантные системы:
1. Супероксиддисмутазная.
Компоненты: супероксиддисмутаза (СОД), каталаза.
Назначение: инактивация супероксидных радикалов (НО2•).
Нарушения: приобретенные расстройства синтеза ферментов, дефицит меди и железа.
2. Глутатионовая.
Компоненты: глутатион, глутатионпероксидаза, глутатионредуктаза, НАДФ·Н2.
Назначение: инактивация и разрушение гидропероксидов липидов.
Нарушения: наследственно обусловленные и приобретенные нарушения синтеза ферментов, дефицит селена, нарушения пентозного цикла (уменьшение образования НАДФ·Н2).
Пероксидаза и каталаза
Пероксидаза (Н2O2-оксидоредуктаза) катализирует в присутствии перекиси водорода окисление различных органических соединений, фенолов, аминов, а также аскорбиновой и диоксифумаровой кислот.
Разложение перекиси водорода осуществляется пероксидазой по схеме:
Выделяющийся при этой реакции активный кислород способен окислять ряд органических и неорганических веществ. Пероксидаза с перекисью водорода образует комплексное соединение, в результате чего перекись активируется.

Каталаза обладает как каталазной, так и пероксидазной активностью. Раньше полагали, что функция каталазы ограничивается только разложением перекиси водорода до O2 и Н2O. В настоящее время установлена и другая важная функция каталазы, заключающаяся в катализе окисления донаторов водорода перекисью водорода. Так, например, каталаза окисляет метанол, этанол и другие спирты, а также альдегиды перекисью водорода. Каталаза действует пероксидативно при низкой концентрации перекиси водорода и при непрерывном поступлении донаторов водорода.
Неферментные антиоксиданты:
1. «Истинные» антиоксиданты.
Компоненты: токоферолы, убихиноны, нафтохиноны, флавоноиды, стероидные гормоны, биогенные амины.
Назначение: инактивация свободных радикалов жирных кислот.
Нарушения: гиповитаминоз Е, нарушение регенерации «истинных» антиоксидантов.
2. Вспомогательные антиоксиданты.
Компоненты: аскорбиновая кислота, серосодержащие соединения — глутатион, цистин, цистеин.
Назначение: регенерация «истинных» антиоксидантов.
Нарушения: гиповитаминоз С, нарушения пентозного цикла, дефицит серосодержащих соединений.
117. Химический состав мышц: важнейшие белки (миозин, актин, актомиозин, тропонин) и экстрактивные вещества. Биосинтез креатина, обмен креатинфосфата. Биохимические механизмы мышечного сокращения и расслабления.
Химический состав мышц.
Вода составляет 70 – 80 % веса мышцы.
Белки.
Основные белки мышц.
Миозин является одним из основных сократительных белков мышц, составляющий около 55 % общего количества мышечных белков. Из него состоят толстые нити (филаменты) миофибрилл.
Молекулярная масса миозина скелетных мышц около 500000. Молекула миозина имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с мол. массой 205000–210000 и несколько коротких легких цепей, мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в «головке» миозиновой молекулы и принимающие участие в проявлении АТФазной активности миозина, гетерогенны по своему составу.
Кратковременная обработка трипсином расщепляет молекулу миозина на два фрагмента. Из хвостового участка (С-концевой участок молекулы) образуется легкий меромиозин (ЛММ) - фрагмент длиной 90 нм, а из остальной части, включающей «головки»,- тяжелый меромиозин (ТММ). ЛММ, подобно миозину, образует нити, однако он не обладает АТФазной активностью и не связывает актин. ТММ катализирует гидролиз АТФ и связывает актин. ТММ можно расщепить далее путем более длительной обработки трипсином или папаином, в результате чего получается один S2-фрагмент длиной 40 нм с мол. массой 62000 и два S1-фрагмента с мол. массой 110000, представляющие собой «головки» миозина.
Толстые нити (толстые миофиламенты) в саркомере надо понимать как образование, полученное путем соединения большого числа определенным образом ориентированных в пространстве молекул миозина.
Актин, составляющий 20% от сухой массы миофибрилл. Известны две формы актина: глобулярный актин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой.
Актомиозин образуется при соединении миозина с F-актином. Актомиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2+ и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
Тропонин – глобулярный белок, его мол. масса 80000. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+.
В скелетных мышцах содержится ряд важных азотистых экстрактивных веществ: адениновые нуклеотиды (АТФ, АДФ и АМФ), нуклеотиды неаденинового ряда, креатинфосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др. Количество нуклеотидов неаденинового ряда (ГТФ, УТФ, ЦТФ и др.) в мышечной ткани по сравнению с концентрацией адениновых нуклеотидов очень мало.
К азотистым веществам мышечной ткани принадлежат имидазолсодержащие дипептиды карнозин и ансерин.


Карнозин Ансерин
Карнозин и ансерин – специфические азотистые вещества скелетной мускулатуры позвоночных. Они увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением. Имидазолсодержащие дипептиды не влияют непосредственно на сократительный аппарат, но увеличивают эффективность работы ионных насосов мышечной клетки.
Среди свободных аминокислот в мышцах наиболее высока концентрация глутаминовой кислоты (до 1,2 г/кг) и ее амида глутамина (0,8–1,0 г/кг). В состав различных клеточных мембран мышечной ткани входит ряд фосфоглицеридов: фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и др. Кроме того, фосфоглицериды принимают участие в обменных процессах, в частности, в качестве субстратов тканевого дыхания. Другие азотсодержащие вещества: мочевина, мочевая кислота, аденин, гуанин, ксантин и гипоксантин – встречаются в мышечной ткани в небольшом количестве и, как правило, являются либо промежуточными, либо конечными продуктами азотистого обмена.
Безазотистые вещества
Гликоген. Его концентрация колеблется от 0,3 до 2% и выше. В мышцах находят лишь следы свободной глюкозы и очень мало гексозофосфатов. В процессе метаболизма глюкозы, а также аминокислот в мышечной ткани образуются молочная, пировиноградная кислоты и много других карбоновых кислот. В том или ином количестве в мышечной ткани обнаруживаются также триглицериды и холестерин.
Состав неорганических солей в мышцах разнообразен. Из катионов больше всего калия и натрия. Калий сосредоточен главным образом внутри мышечных волокон, а натрий – преимущественно в межклеточном веществе. Значительно меньше в мышцах магния, кальция и железа. В мышечной ткани содержится ряд микроэлементов: кобальт, алюминий, никель, бор, цинк и др.
Биосинтез креатина протекает в две стадии в почках, в печени, в поджелудочной железе. Из печени с током крови креатин поступает в мышечную ткань, где, фосфорилируясь, превращается в креатинфосфат (который после дефосфорилирования превращается в креатинин, выделяющийся с мочой), участвует в химических процессах, связанных с мышечным сокращением, источник энергии АТФ.
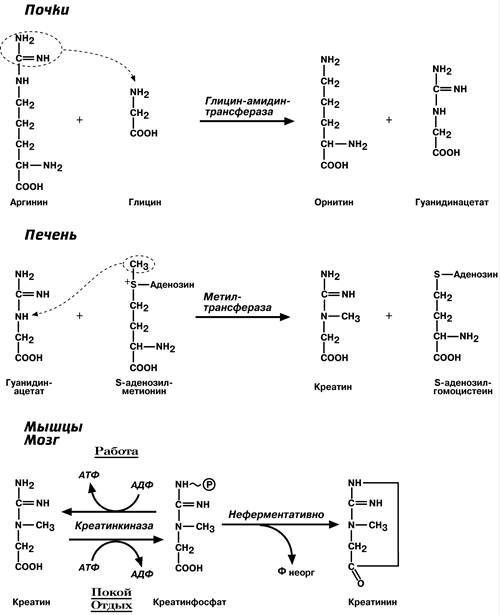
Синтез креатина в тканях человека протекает в две стадии. На первой стадии в почках образуется гуанидинацетат:
На второй стадии в печени происходит реакция трансметилирования:
Синтезированный в печени креатин поступает в кровь и доставляется в мышцы. Там он взаимодействует с АТФ, в результате чего образуется макроэргическое соединение креатинфосфат. Эта реакция легко обратима.
В состоянии покоя мышцы накапливают креатинфосфат (его содержание в неработающей мышце в 3-8 раз выше, чем содержание АТФ). При переходе к мышечной работе изменяется направление реакции и образуется АТФ, необходимый для мышечного сокращения.
В результате неферментативного дефосфорилирования креатинфосфата образуется креатинин – ангидрид креатина.
Биохимический цикл мышечного сокращения состоит из 5 стадий:
· 1-2-3 – стадии сокращения;
· 4-5 – стадии расслабления.
1 стадия – в стадии покоя миозиновая «головка» может гидролизовать АТФ до АДФ и Фн, но не обеспечивает освобождения продуктов гидролиза. Образуется стабильный комплекс: миозин-АДФ-Фн.
2 стадия – возбуждение двигательного нерва приводит к освобождению ионов Са2+ из саркоплазматического ритикулума мышечного волокна. Ионы Са2+ связываются тропонином С (Тн-С). В результате этого взаимодействия изменяется конформация всей молекулы тропонина, а затем – тропомиозина. Вследствие этого в актине открываются центры связывания с миозином. Миозиновая «головка» связывается с F-актином, образуя с осью фибриллы угол около 900.
3 стадия – присоединение актина к миозину обеспечивает высвобождение АДФ и Фн из актин-миозинового комплекса. Это приводит к изменению конформации этого комплекса и угол между актином и миозиновой «головкой» изменяется с 900 до 450. В результате изменения угла филаменты актина втягиваются между филаментами миозина, т. е. происходит их скольжение навстречу друг другу. Укорачиваются саркомеры, сокращаются мышечные волокна.
4 стадия – новая молекула АТФ связывается с комплексом актин-миозин.
5 стадия – комплекс миозин-АТФ обладает низким сродством к актину и поэтому происходит отделение миозиновой «головки» от F-актина. Филаменты возвращаются в исходное состояние, мышца расслабляется. Затем цикл возобновляется.

118. Саркоплазматические белки: миоглобин, его строение и функция. Особенности энергетического обмена в мышцах. Клинико-биохимические исследования при инфаркте миокарда. Биохимические изменения при мышечных дистрофиях. Креатинин и креатинурия у детей.
Миоглоби́н —кислородосвязывающий белок скелетных мышц и мышцы сердца. Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотной последовательности. В практической медицине этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина в крови.
В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает.
Миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию передачи кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
· Гем - молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метильные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть тема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В теме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fe2+, находящимся в центре молекулы.
· Апомиоглобин - белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 -спиралей.
-Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8).
· Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре.
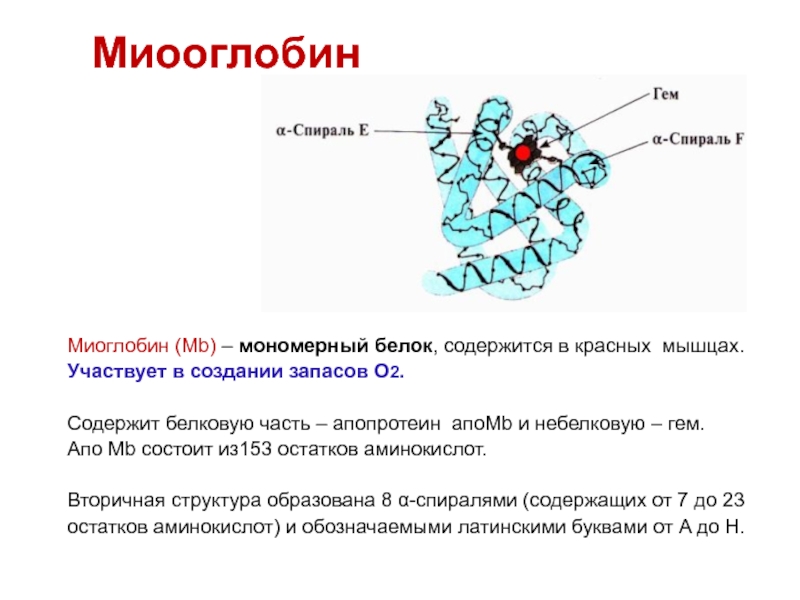
миоглобин*



 глюкуроновая кислота
глюкуроновая кислота








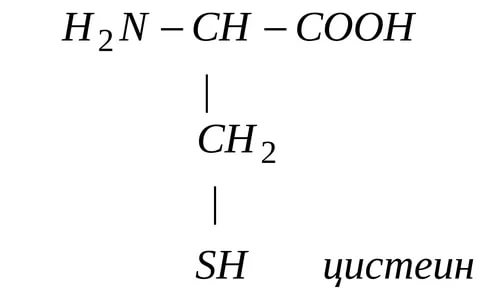
 глутатион
глутатион