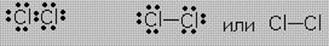Классификация ионов:
1. По знаку заряда: катионы (положительные, K+, Ca2+, H+) и анионы (отрицательные, S2-, Cl-, I-).
2. По составу: сложные (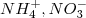 ,
, 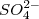 ) и простые (Na+, F-)
) и простые (Na+, F-)
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы. Между анионами и катионами возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь.
Задание. Написать электронные формулы следующих ионов: K+, Ca2+, Cl-, S2-.
Задания для самостоятельного выполнения.
Заполнить таблицу: «Зависимость физических свойств веществ от типа кристаллической решетки»
Ковалентная химическая связь
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2.
Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.

Элементы с большей электроотрицательностью будут оттягивать общие электроны от элементов с меньшей электроотрицательностью.
Для наглядного изображения ковалентной связи в химических формулах используются точки (каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре).
Пример. Связи в молекуле Cl2 можно изобразить так: 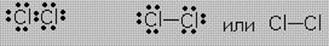
Но молекулы могут образовывать и разные атомы неметаллов и в этом случае общая электронная пара будет смещаться к более электроотрицательному химическому элементу – ковалентная полярная связь.
Демонстрация схемы образования полярной ковалентной связи.
Составление электронных формул молекул йодоводорода и воды:
••
H •• J •• - электронная формула молекулы йодоводорода,
••
H → J - структурная формула молекулы йодоводорода.
••
H •• O •• - электронная формула молекулы воды,
••
H
Н →О - структурная формула молекулы воды.
↑
Н
Вывод: Металлы имеют более низкое значение электроотрицательности, чем неметаллы. И между ними она сильно отличается, тогда возникает ионная связь. Связь образованная между атомами элементов, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь.
Вопросы для самоконтроля
- Атом, какого химического элемента имеет заряд ядра +11
– Записать схему электронного строения атома натрия
– Внешний слой завершен?
– Как добиться завершения заполнения электронного слоя?
– Составить схему отдачи электрона
– Сравнить строение атома и иона натрия
- Определить атом, какого элемента с количеством протонов 17.
– Запишите схему электронного строения атома.
– Слой завершен? Как этого добиться.
– Составить схему завершения электронного слоя хлора.
Задание по группам:
1-3 группа: Составьте электронные и структурные формулы молекул веществ и укажите тип связи Br2; NH3.
4-6 группы: Составьте электронные и структурные формулы молекул веществ и укажите тип связи F2; HBr.
Задания для самостоятельного выполнения.
Составить конспект «Типы кристаллических решеток»



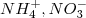 ,
, 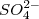 ) и простые (Na+, F-)
) и простые (Na+, F-)